代谢组分析多巴胺依赖的肝脏代谢昼夜节律
生物钟与新陈代谢紧密联系在一起,在很大程度上依赖于器官系统之间多方面的相互作用来维持适当的时间。遗传和/或环境因素可以破坏器官之间的沟通,改变节律活动。物质使用导致多巴胺信号的改变,然后是反馈系统中昼夜节律基因表达和代谢的重新编程。然而,大脑中多巴胺信号的改变是否会影响周围器官的昼夜代谢尚未被充分探索。本研究对纹状体中刺状神经元(iMSN)多巴胺D2受体(D2R)表达缺失(iMSN-D2RKO)的小鼠肝脏代谢组进行了分析,发现与对照组小鼠相比,发现肝脏昼夜代谢组发生了深刻变化。本研究于2022年3月发表在《Proc Natl Acad Sci USA》IF:11.205期刊上。
技术路线:

主要实验结果:
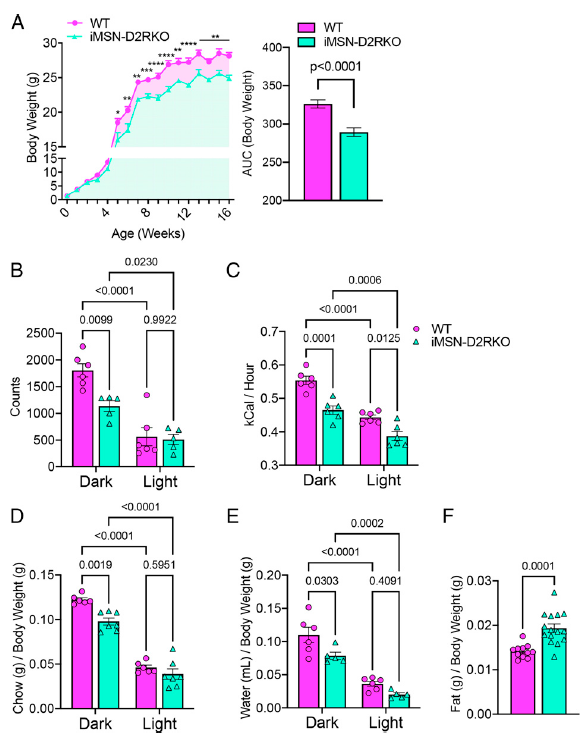
在纹状体中,多巴胺受体信号通路是控制生理响应非常重要的通路,包括吃和运动行为,这些都会极大程度的影响代谢。因此,作者探究了纹状体中典型的和多巴胺D2R改变的信号通路对于生理参数的影响,首先比较野生型小鼠和同窝生在iMSNs中D2R特异性缺失小鼠间的生理参数。
由于食物摄取和运动活动会影响体重,所以作者记录了两种基因型小鼠从出生到成年的体重。有趣的是,观察到在出生后前5周两种小鼠的体重没有差异;此后,相比于野生型,iMSN-D2RKO小鼠的体重显著下降(图1A)。因此,作者在量热笼子中检测了小鼠的日常活动和能量消耗以及饮食行为,这可以解释成年iMSN-D2RKO小鼠和WT小鼠之间的体重差异。结果发现在活动笼中,iMSN-D2RKO 小鼠在活跃期而不是在非活跃期的光束中断计数明显低于 WT 同窝小鼠(图1B)。此外,iMSN-D2RKO小鼠的能量消耗在黑暗期和有光期均显著降低(图1C)。与之相关的是,iMSN-D2RKO小鼠在黑暗期的鼠粮消耗量比野生型小鼠低(图1D),但是有光期无差异,同样的趋势也适用于水的摄取(图1E)。有趣的是,尽管事物摄入量减少且体重减轻,但是与WT小鼠比较,iMSN-D2RKO小鼠却具有更高的性腺的脂肪含量(图1F)。
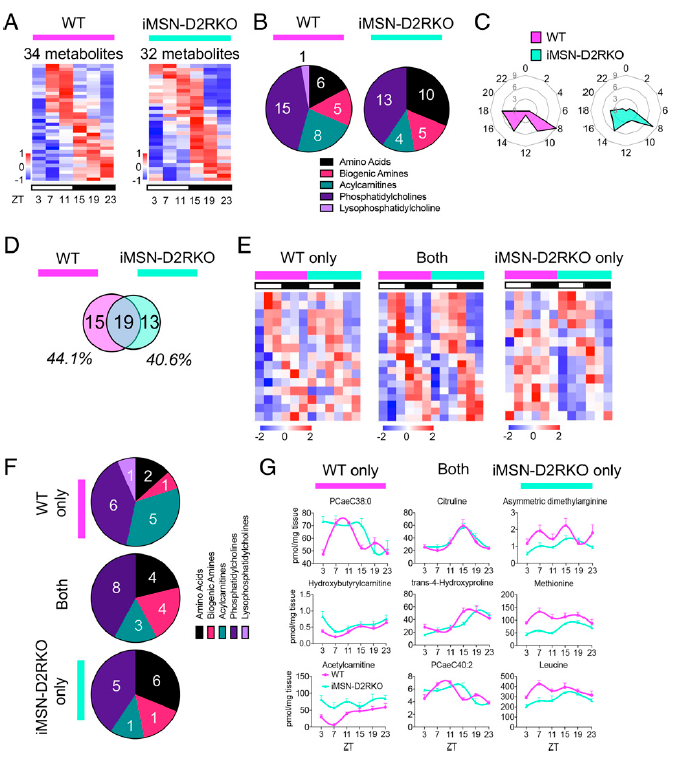
肝脏在代谢过程中具有中心地位。无论是遗传还是环境挑战都能顺着昼夜节律重编程肝脏代谢。因此,作者分析了iMSN-D2RKO小鼠和同窝野生型小鼠在昼夜循环中的肝脏的代谢组。为此,每4小时从两种基因型小鼠身上采集肝脏组织,跨越六个时间点(授时因子时间[ZT] 3、7、11、15、19、23)的完整昼夜周期。核心时钟基因的表达证实了用于代谢物分析的样本的节律性。使用非参数检验JTK_CYCLE分析昼夜节律性,以确定每个基因型显著振荡的昼夜节律代谢物的数量(图2A)。发现180个代谢物中有近20%的代谢物(WT和iMSN-D2RKO小鼠中分别有34和32个代谢物)在两种基因型中出现显著振荡。重要的是,80%的振荡代谢物是脂质,包括酰基肉碱、磷脂酰胆碱、鞘磷脂和溶血磷脂酰胆碱。剩余的振荡代谢物属于氨基酸和生物胺类(图2B)。特别是,WT中32%的节律性代谢物和iMSN-D2RKO肝脏中46%的节律性代谢物是氨基酸衍生的代谢物。相分析显示ZT8和ZT14 ~ ZT18是昼夜代谢产物丰度最高的主要时间点(图2C)。这些数据表明,节律性代谢物在WT和iMSN-D2RKO肝脏中显示出相似的昼夜节律模式。然而,除了在两种基因型中振荡的代谢物子集之外,尽管昼夜节律参数有相似之处,但对在每种基因型中振荡的个体代谢物的比较确定了独特的代谢物,它们仅在 WT 或 iMSN-D2RKO 肝脏中振荡(图2D和2E)。令人惊讶的是,在iMSN-D2RKO小鼠中,与WT小鼠比较,将近44%的肝脏代谢物丢失了昼夜节律性,此外,40%的代谢产物在iMSN-D2RKO肝脏中显示新生振荡,而在WT中没有观察到。在分析的代谢物中,iMSN-D2RKO肝脏的节律性损失最大的是酰基肉碱(图2F和2G)。这些分析表明纹状体神经元对肝脏的影响以前被忽略,因为与 WT 相比,iMSN-D2RKO 小鼠肝脏中的代谢物显示出昼夜节律改变的特征。
3、iMSN中D2R丢失改变了可卡因处理鼠的肝脏节律代谢组
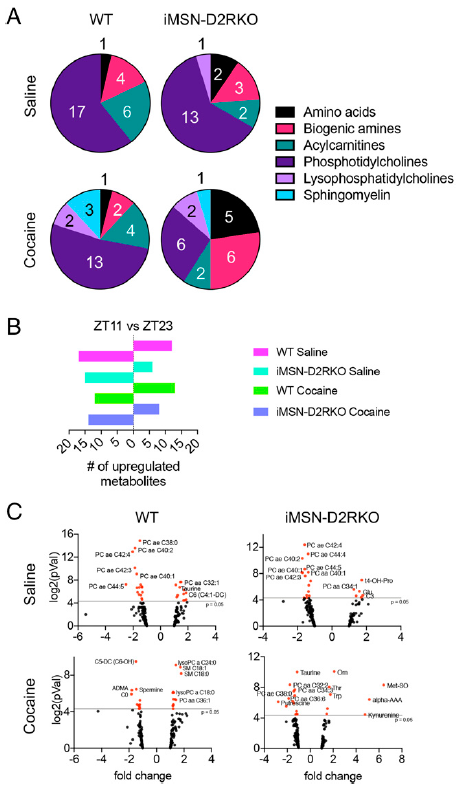
在基础条件(生理盐水)下,iMSN 中缺乏 D2R 信号对昼夜肝脏代谢物的影响促使作者进一步分析多巴胺能挑战对 WT 和突变小鼠肝脏代谢的影响。使用可卡因处理,它可以增加纹状体中的多巴胺水平,扰乱昼夜节律。为此,比较了生理盐水和可卡因处理(ZT3)的WT小鼠和iMSN-D2RKO小鼠的肝脏代谢组。引人注目的是,在生理盐水处理的 WT 小鼠中,73% 的代谢物在服用可卡因后失去了节律性。 在急性可卡因处理后,生理盐水条件下只有 26% 的先前振荡代谢物保持其节律性(图3A-3B)。有趣的是,在WT肝脏中,可卡因使乙酰肉碱的振荡减少了四倍(图3C)。与盐水处理的对照小鼠组织相比,可卡因给药后 iMSN-D2RKO 肝脏中 25% 的昼夜节律代谢物失去节律性(图3D)。相反,在生理盐水处理的iMSN-D2RKO 小鼠中75%的震荡代谢物不受可卡因的影响。然而,与生理盐水处理小鼠的肝脏相比,可卡因处理后 iMSN-D2RKO 肝脏中诱导出数量惊人的新生振荡代谢物(图3D和3E)。在服用可卡因的iMSN-D2RKO小鼠中,节律性酰基肉碱和磷脂酰胆碱的数量明显高于服用盐水的小鼠(图3F)。因此,纹状体iMSNs中D2R信号的缺失不仅在基础条件下严重影响肝脏代谢,在可卡因刺激下也会影响肝脏代谢。
可卡因干扰纹状体中涉及D2R介导的iMSNs调节的昼夜基因表达和代谢谱。因此,分析和比较了在 ZT3 单次注射可卡因的 iMSN-D2RKO 和 WT 小鼠肝脏的完整昼夜节律代谢谱(图3G-3I)。在服用可卡因的WT小鼠中,检测到的代谢物有16%出现振荡,而在iMSN-D2RKO小鼠中,高达41%的代谢物出现振荡(图3G)。此外,相分析显示可卡因处理的WT小鼠和iMSN-D2RKO小鼠的生理代谢产物并不一致,在WT小鼠中,有光期节律峰值在ZT8附近,而iMSN-D2RKO小鼠则是在ZT-ZT6直接摆动。这种差异性并不依赖于可卡因注射本身,因为在所有的生理盐水和可卡因注射组都观察到了类似的现象。相反,两种基因型的黑暗期的峰值都维持在ZT16(图3H)。此外,在WT可卡因诱导的小鼠中,酰基肉碱只构成肝脏中振荡代谢物的~ 7%,但在iMSN-D2RKO小鼠中,其构成占据昼夜代谢物的~ 30%(图3I)。这些数据表明纹状体D2R介导节律性肝脏代谢物的调控,并且显示出多巴胺信号在脑中可作用于调控肝脏生理。

图3可卡因引起的肝脏昼夜代谢紊乱
4、可卡因对肝脏代谢组的不同影响
环境线索,包括光照,食物摄取,运动,都可帮助维持中枢和外周组织的昼夜节律同步。为确定活体内代谢物水平的时间依赖性差异,比较了可卡因处理的 WT 和 iMSN-D2RKO 小鼠在 ZT11 和 ZT23 的明暗阶段的代谢组学特征,两个节点分别是光暗阶段的最后时间点(图4A)。只有在可卡因处理后,WT肝脏中的日间依赖代谢物才包括鞘磷脂和溶血磷脂胆碱(图4A)。随后比较了ZT11和ZT23代谢产物的上调(图4B)。在生理盐水处理的小鼠的肝脏中,发现超过50%的在时间点之间变化的代谢物在黑暗期表现出更高的水平,在生理盐水条件下,WT和iMSN-D2RKO肝脏ZT23位点可以观察到磷脂酰胆碱的时间依赖性上调(图4C)。令人惊讶的是,可卡因逆转了这一趋势,并在 WT 小鼠的肝脏中诱导 ZT11 的代谢物水平高于 ZT23 的代谢物水平(图4B)。总之,我们的研究结果表明,iMSN 中的 D2R 信号传导中断和急性可卡因挑战会改变肝脏的时间代谢。
参考文献:
Cervantes M, Lewis RG, Della-Fazia MA, Borrelli E, Sassone-Corsi P. Dopamine D2 receptor signaling in the brain modulates circadian liver metabolomic profiles. Proc Natl Acad Sci U S A. 2022;119(11):e2117113119. doi:10.1073/pnas.2117113119






