CDK16通过磷酸化PRC1促进三阴性乳腺癌的进展和转移
细胞周期蛋白依赖性激酶16 (CDK16)是一种非典型的PCTAIRE激酶,其活性依赖于细胞周期蛋白Y (CCNY)家族。CCNYs已被报道调节乳腺干细胞的活性和乳腺的发育,是多种癌症中的一种癌蛋白。然而,目前尚不清楚CDK16是否在乳腺癌中发挥作用,以及是否可以作为乳腺癌的治疗靶点。鉴于此,有相关研究提出CDK16在三阴性乳腺癌(TNBC)中起着关键作用,是一种新的TNBC治疗靶点,该研究在2022年4月发表在《Journal of Experimental & Clinical Cancer Research》,IF:11.161。
技术路线:
主要研究结果:
1. CDK16在TNBC中高表达,且与不良临床结果相关
作者分析了CCNY依赖性非典型CDKs的表达和临床相关性,发现CDK16在所有乳腺癌亚型中均有表达,在基底样乳腺癌样本中表达最高(图1A)。此外,CDK16高表达与不良预后显著相关(图1B-D)。与TCGA数据集的结果一致,乳腺癌联合数据库(图1E)和GSE76250数据集(图1G)也发现TNBC中CDK16表达水平高于正常乳腺组织,且CDK16高表达与不良临床结果呈正相关(图1F)。此外,CPTAC数据库分析显示,乳腺肿瘤组织中CDK16蛋白表达较正常乳腺组织显著升高(图1H)。在所有乳腺癌亚型中,CDK16仅在TNBC中升高(图1I)。使用组织芯片(T=50, P=4)进行免疫组化(IHC)分析,免疫组化分析显示,TNBC肿瘤中CDK16蛋白的表达明显高于邻近的非癌组织,并主要分布在细胞质中(图1J)。临床样本(N=6, T=6)检测进一步证实了TNBC中CDK16蛋白表达的增加(图1K)。这些数据表明高表达的CDK16可能在TNBC的进展中发挥作用。
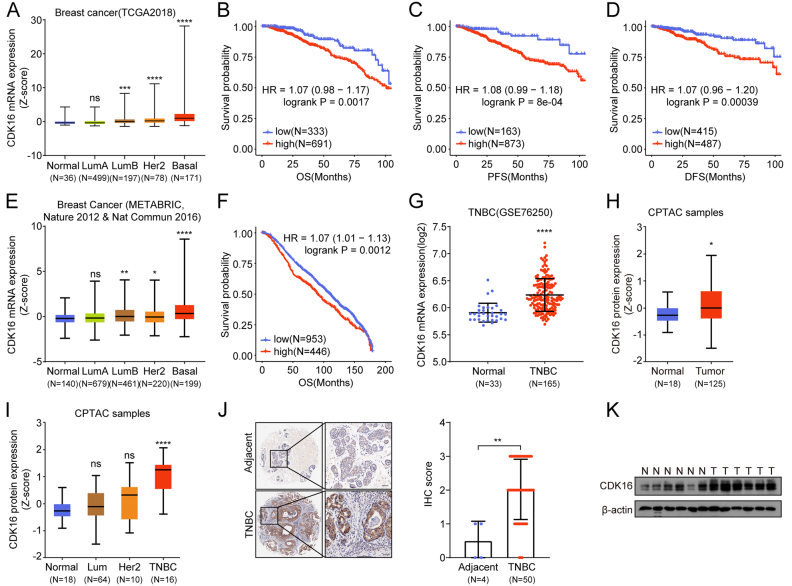
图1 CDK16在TNBC中高表达,与不良临床结果相关
2. 抑制CDK16在体内外均可抑制TNBC的肿瘤生长
集落形成分析显示,CDK16敲低显著降低了TNBC细胞的增殖和克隆能力(图2A, B)。为了确定CDK16的功能是否取决于其酶活性,通过靶向CDK16 3’-UTR的shRNA耗尽内源性CDK16,然后恢复shRNA耐药的野生型CDK16 (CDK16)或激酶不活化的CDK16D304A突变体(D304A)。尽管过表达效率相当(图2C),野生型CDK16而非CDK16D304A突变体可以挽救2D-colony形成分析显示的细胞增殖缺陷(图2D, E),这表明CDK16在TNBC中的功能需要激酶活性。
进一步使用两个细胞系来源的异种移植(CDX)模型来研究CDK16在TNBC进展中的作用。CDK16基因敲除(CDK16-KD)显著延迟了异种移植瘤模型的肿瘤形成(图2F),抑制了肿瘤生长,与对照组相比,CDK16-KD组的肿瘤体积、质量和大小都有所减少(图2G-I)。另一种异种移植模型得到了一致的结果(图2J-M)。总之,这些结果表明CDK16对TNBC进展至关重要。
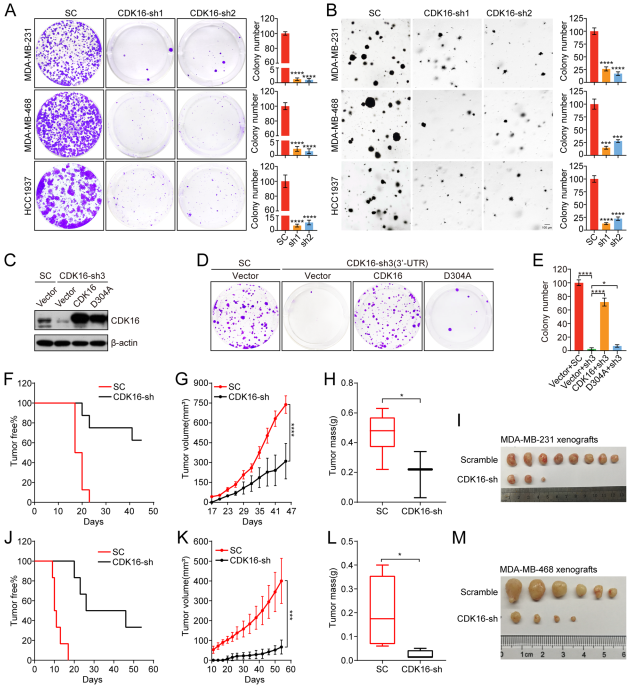
图2 CDK16敲低可抑制TNBC的体内外肿瘤生长
3. 在患者来源的类器官和异种移植模型中,CDK16的下调抑制TNBC的肿瘤进展
考虑到临床意义,建立了PDO和PDX模型(图3A),以进一步评估靶向CDK16在TNBC中的治疗效果。与CDX模型的观察结果一致,在所有三个PDO模型中,与对照组相比,CDK16-KD组的类器官形成效率和类器官生长显著降低 (图3B-D),表明CDK16敲低抑制了TNBC的进展。类器官Ki67染色分析显示,CDK16-KD组各类器官中Ki67+细胞的比例明显低于对照组,对应于CDK16-KD类器官的增殖抑制表型(图3E)。PDX模型的结果进一步验证了靶向CDK16在TNBC中的抗肿瘤作用:减缓肿瘤发生(图3F),抑制肿瘤生长(图3G),最终抑制肿瘤进展(图3H, I)。综上所述,这些数据表明靶向CDK16在TNBC的临床治疗中具有巨大的潜力。
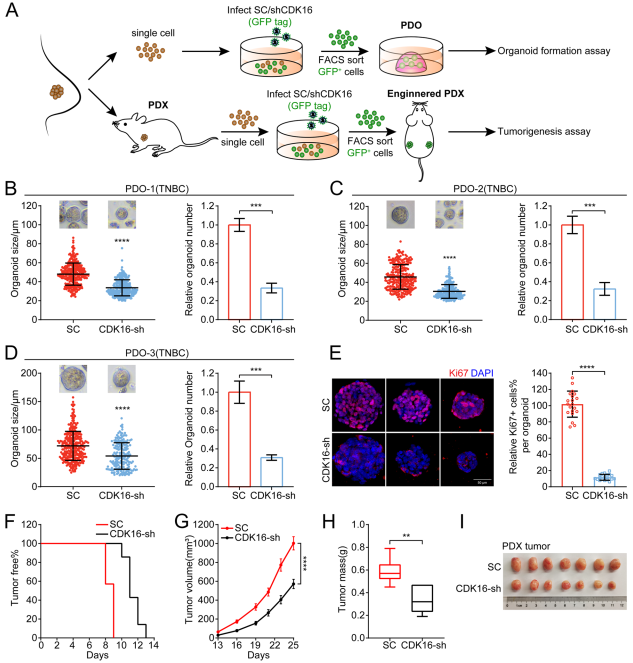
图3在患者来源的类器官和异种移植模型中,CDK16的下调抑制TNBC的肿瘤进展
4. CDK16促进TNBC细胞迁移和肿瘤转移
乳腺癌患者CDK16表达与转移复发风险呈正相关,提示CDK16可能参与TNBC转移。为了验证这一可能性,通过生物发光成像(BLI)定量监测体内肿瘤转移。western blot分析证实CDK16过表达(CDK16-OE) (图4A)。Transwell和愈合化验显示,CDK16-OE显著提升细胞入侵和迁移(图4 B, C)。体内,老鼠的metastasis-free生存时间轴承CDK16-OE细胞相比明显缩短小鼠的轴承控制细胞(图4 d, E),而CDK16-OE严重加重肺转移负担 (图4D, F)和肺转移结节(图4G, H)。H&E分析显示,CDK16-OE导致肺组织严重结构损伤(图4G)。而CDK16-KD显著降低了4T1细胞的远端器官转移(图4I),而CDK16-OE过表达显著促进了EMT6细胞向多个器官的远端转移,这在体内和体外BLI数据中得到了证实(图4J)。总之,这些结果表明CDK16对TNBC转移至关重要。
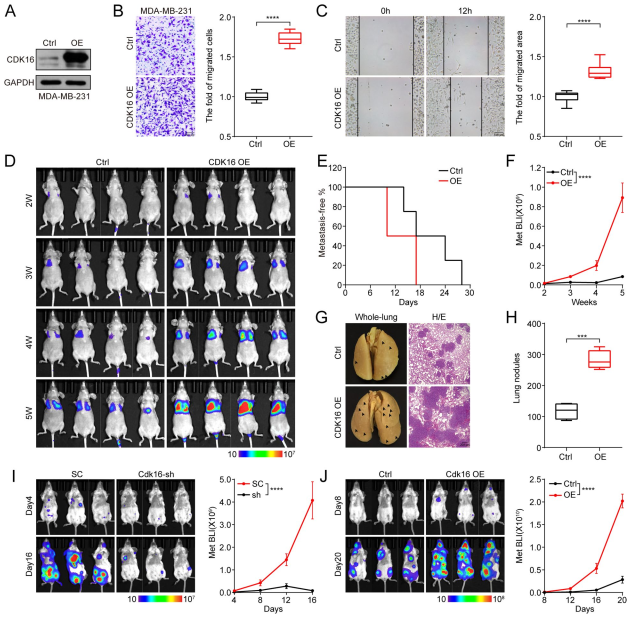
图4 CDK16促进TNBC细胞迁移和肿瘤转移
5. CDK16通过磷酸化PRC1和调节纺锤体形成来调控细胞增殖
为了研究CDK16参与TNBC进展的分子机制,通过RNA测序分析了CDK16-KD MDA-MB-231细胞和对照细胞的转录组。先前文献报道CDK16与纺锤体有关,同GO分析一样。因此检测有丝分裂过程中的纺锤体形成,观察到CDK16-KD MDA-MB-231细胞中有明显的纺锤体形成缺陷(图5A)。免疫印迹分析显示,T481位点(CDK依赖的主要磷酸化位点)的PRC1磷酸化随着细胞周期过程中CDK16蛋白的丰度而波动(图5B),并且在MDA-MB-231细胞中,CDK16敲除后PRC1的磷酸化水平明显降低(图5C)。此外,在CDK16敲除后,PRC1靶向基因的表达显著改变:细胞周期相关基因下调,凋亡相关基因上调(图5D)。PRC1的亚细胞定位决定了其在细胞增殖中的作用,通过免疫染色(图5E)和免疫印迹分析(图5F),进一步观察到PRC1在CDK16-KD细胞中明显的核滞留。
MDA-MB-231细胞的2D增殖分析显示,磷酸化模拟的PRC1T481D突变体显著拯救了受抑制的细胞增殖,而磷酸化缺失的PRC1T481A突变体则没有这种拯救作用(图5G, H)。提示CDK16对TNBC细胞增殖的调控作用是通过磷酸化PRC1实现的。综上所述,这些结果表明CDK16通过磷酸化PRC1来发挥其在TNBC中的功能。

图5 CDK16通过磷酸化PRC1和调节纺锤体形成来调控细胞增殖
6. CDK16药理抑制可抑制TNBC的肿瘤生长和转移
与TNBC细胞系相比,细胞系MCF-7和T47D对Reb(CDK16抑制剂)敏感性较低(图6A)。免疫印迹分析显示,Reb处理降低了T481位点的PRC1磷酸化,并导致PRC1的核保留(图6B, C)。Reb治疗显著抑制肿瘤生长,从单个肿瘤体积、平均肿瘤体积、肿瘤重量和肿瘤大小可以看出(图6D-G)。在PDO模型中,Reb存在时肿瘤类器官的大小和数量均显著减少,但Abe (CDK4/6抑制剂,作为对照)不存在(图6H, I)。Ki67和cleaved caspase-3的免疫染色评估显示只有Reb诱导细胞凋亡和抑制细胞增殖(图6J)。在PDX模型中,也观察到Reb具有显著的抗肿瘤效率 (图6K-N)。Reb能有效抑制MDA-MB-231肿瘤细胞的肺转移(图6O,6P)。综上所述,药理抑制CDK16可有效抑制TNBC的肿瘤生长和转移,CDK16可作为治疗TNBC的一个有希望的靶点。
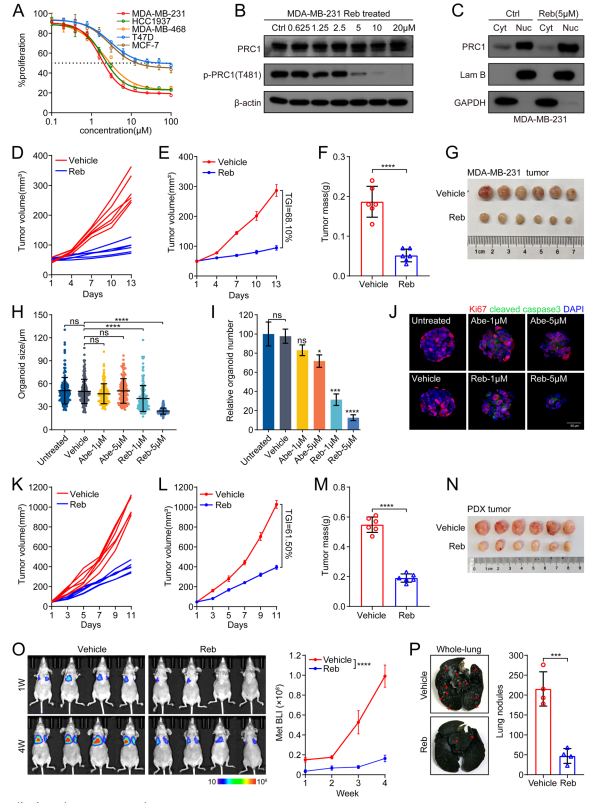
图6 CDK16药理抑制作用对TNBC肿瘤生长和转移的抑制作用
7. CDK16抑制参与多种癌症相关信号通路
Reb治疗后的MDA-MB-231细胞进行了转录组分析。GSEA分析显示,在Reb处理的细胞中,有丝分裂纺锤体组织的基因标记(图7A)和G2/M检查点(图7B)下调。Rb-E2F基因标记也受到了Reb治疗(图7C)或CDK16敲除(图7D)的影响。热图显示,Rb-E2F途径的靶基因在Reb处理(图7E)或CDK16敲除(图7F)后下调。免疫印迹分析证实,在Reb治疗(图7G)或CDK16敲除(图7H)后,Rb磷酸化显著降低。此外,通过qPCR分析,Reb治疗(图7I)或CDK16敲除(图7J)后,受Rb-E2F信号直接调节的基因表达显著下调。总之,这些结果表明CDK16通过磷酸化Rb来调节Rb-E2F信号。综上所述,这些数据支持CDK16抑制参与多种癌症相关信号通路,这可能有助于CDK16与PRC1共同调控TNBC进展。
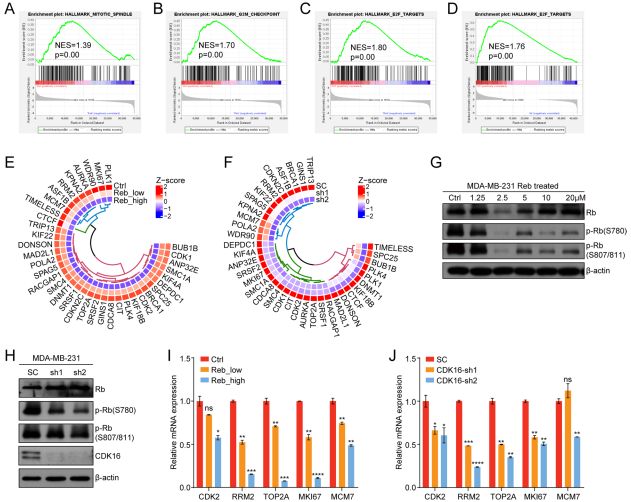
图7 CDK16抑制参与多种癌症相关信号通路
结论
CDK16在乳腺癌,尤其是TNBC中高表达,其高表达与不良预后相关,促进TNBC的恶性活动。机制上,CDK16通过磷酸化PRC1和调节有丝分裂期间纺锤体的形成发挥致癌作用。有趣的是,CDK16抑制也抑制Rb磷酸化和Rb-E2F信号。总之,该研究为非典型CDK在癌症中的作用提供了新的见解,并强调CDK16是TNBC一个有希望的治疗靶点。
参考文献
Li X, Li J, Xu L, Wei W, Cheng A, Zhang L, Zhang M, Wu G, Cai C. CDK16 promotes the progression and metastasis of triple-negative breast cancer by phosphorylating PRC1. J Exp Clin Cancer Res. 2022;41(1):149. doi: 10.1186/s13046-022-02362-w.






