lncRNA NEAT1通过调节miR-362-3p/MIOX轴促进肝细胞癌铁死亡
lncRNA NEAT1参与调节细胞周期、增殖、凋亡和肿瘤细胞的迁移。然而,NEAT1在调节肿瘤中铁死亡中的功能和分子机制尚不清楚。在这里,我们发现铁死亡诱导剂erastin和RSL3通过促进p53与NEAT1启动子的结合来增加NEAT1的表达。诱导NEAT1通过竞争性结合miR-362-3p促进MIOX的表达。MIOX增加了ROS的产生,降低了细胞内NADPH和GSH的水平,导致erastin和RSL3诱导的铁死亡增强。重要的是,NEAT1的过表达通过增强体外和体内的铁死亡,提高了erastin和RSL3的抗肿瘤活性。总的来说,NEAT1通过调节miR-362-3p和MIOX在铁死亡中发挥了新的、不可或缺的作用。考虑到HCC患者对化疗和免疫治疗不敏感的临床发现,对于NEAT1高表达的HCC患者,诱导铁死亡可能是一种有希望的治疗策略。本文于2022年3月发表于Cell Death and Differentiation(IF=15.828)上。
技术路线

结果
1)铁死亡诱导NEAT1表达依赖于p53
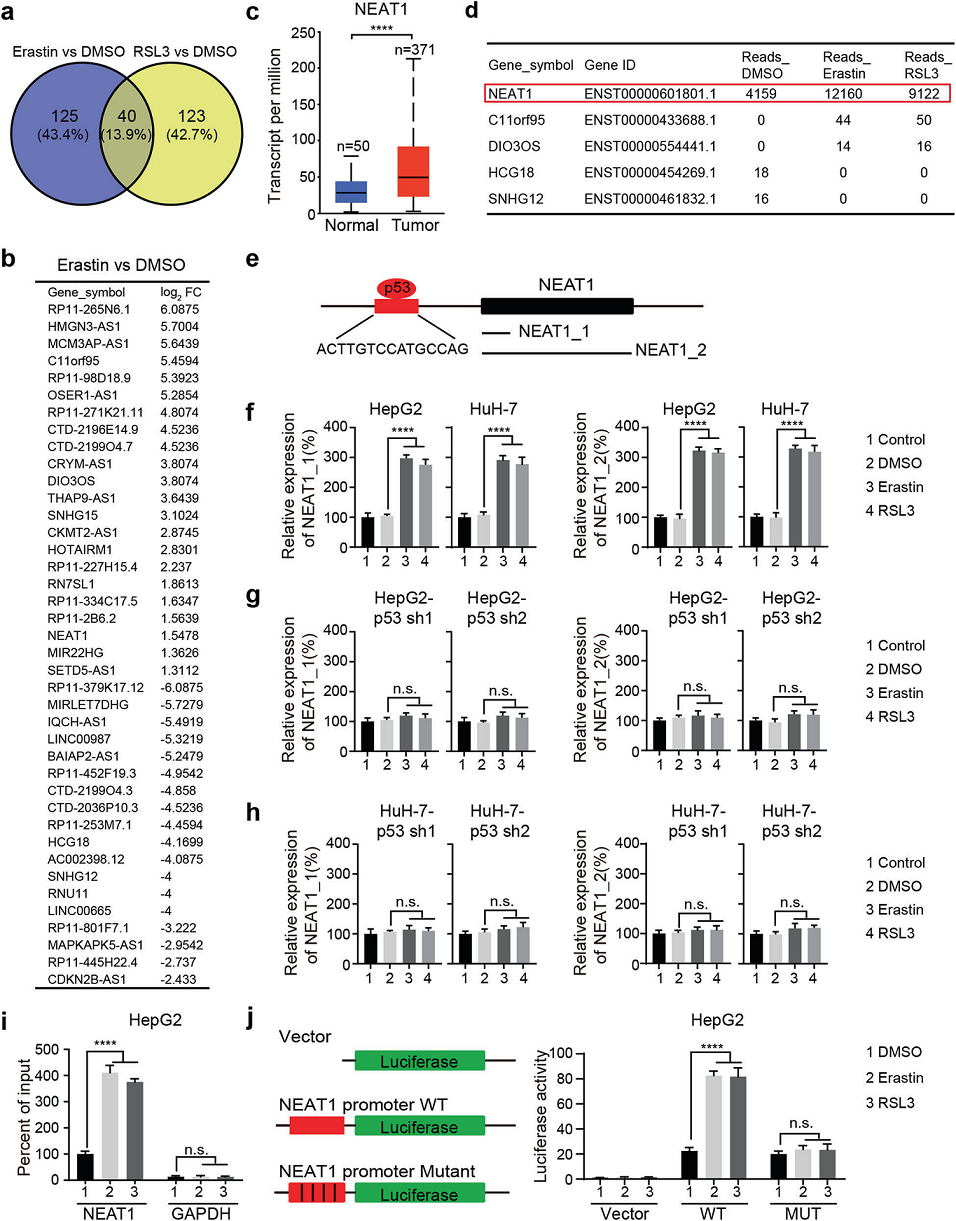
为了鉴定与铁死亡有关的lncRNAs,用铁死亡诱导剂处理肝癌细胞系HepG2,用RNA-Seq进行转录组分析。如图所示,在erastin和RSL3处理后,40个lncRNAs导致两种处理的基因表达发生显著变化,以及分别受erastin或RSL3影响的125或123个lncRNAs(图1a、b)。我们根据差异表达基因列表挖掘了UALCAN数据库,发现了五种有趣的lncRNAs(NEAT1、C11orf95、DIO3OS、HCG18、SNHG12),它们在HCC中的表达与正常组织相比显著(图1c)。其中,NEAT1的表达显著高于其他lncRNAs(图1d)。因此,我们进一步研究NEAT1在铁死亡中的作用和机制。
NEAT1有两种亚型,NEAT1_1在大多数人体组织中组成性表达,而NEAT1_2的表达是组织特异性的。然而,NEAT1的生物学功能主要来源于NEAT1_2亚型。为了检测两种亚型的表达,我们设计了引物来产生两个扩增子,引物1检测到NEAT1_1和NEAT1_2的表达,引物2仅检测到NEAT1_2(图1e)。如图1f所示,在erastin和RSL3处理的HCC细胞中,这两种转录物均上调,表明NEAT1_1和NEAT1_2的表达在铁死亡中被诱导。另外,我们发现,p53的缺失消除了HepG2和HuH-7细胞中NEAT1的上调(图1g,h),表明erastin和RSL3诱导的NEAT1表达是由p53介导的。为了进一步测试p53是否直接调节NEAT1的转录,我们使用JASPAR程序分析了NEAT1的启动子区域,并发现了一个p53的结合序列。然后,我们进行ChIP分析,发现erastin和RSL3处理促进了p53与NEAT1启动子区域的结合(图1i)。此外,我们观察到在erastin或RSL3处理NEAT1-WT启动子后,启动子活性增加(图1j)。综上所述,在铁死亡诱导条件下,p53直接结合NEAT1的启动子并促进NEAT1的表达。
2)NEAT1促进erastin和RSL3诱导的铁死亡
为了研究NEAT1是否调节铁死亡,我们构建了两个NEAT1特异性shRNA。NEAT1 shRNA 1同时敲除NEAT1_1和NEAT1_2,而NEAT1 shRNA 2仅敲除NEAT1_2,而不影响NEAT1_1的表达(图2a、b)。接下来,我们建立了稳定表达两种不同NEAT1特异性shRNA的HepG2和HuH-7细胞系,并用erastin或RSL3处理它们。如图2c所示,在HepG2或HuH-7细胞中敲除NEAT1亚型或单独敲除NEAT1_2可显著抑制erastin和RSL3诱导的细胞死亡。NEAT1敲除显著抑制MDA、脂质ROS和Fe2+的积累(图2d、e、f)。总的来说,NEAT1促进erastin和RSL3诱导的肝癌细胞铁死亡。

3)NEAT1通过调节MIOX的表达来调节铁死亡
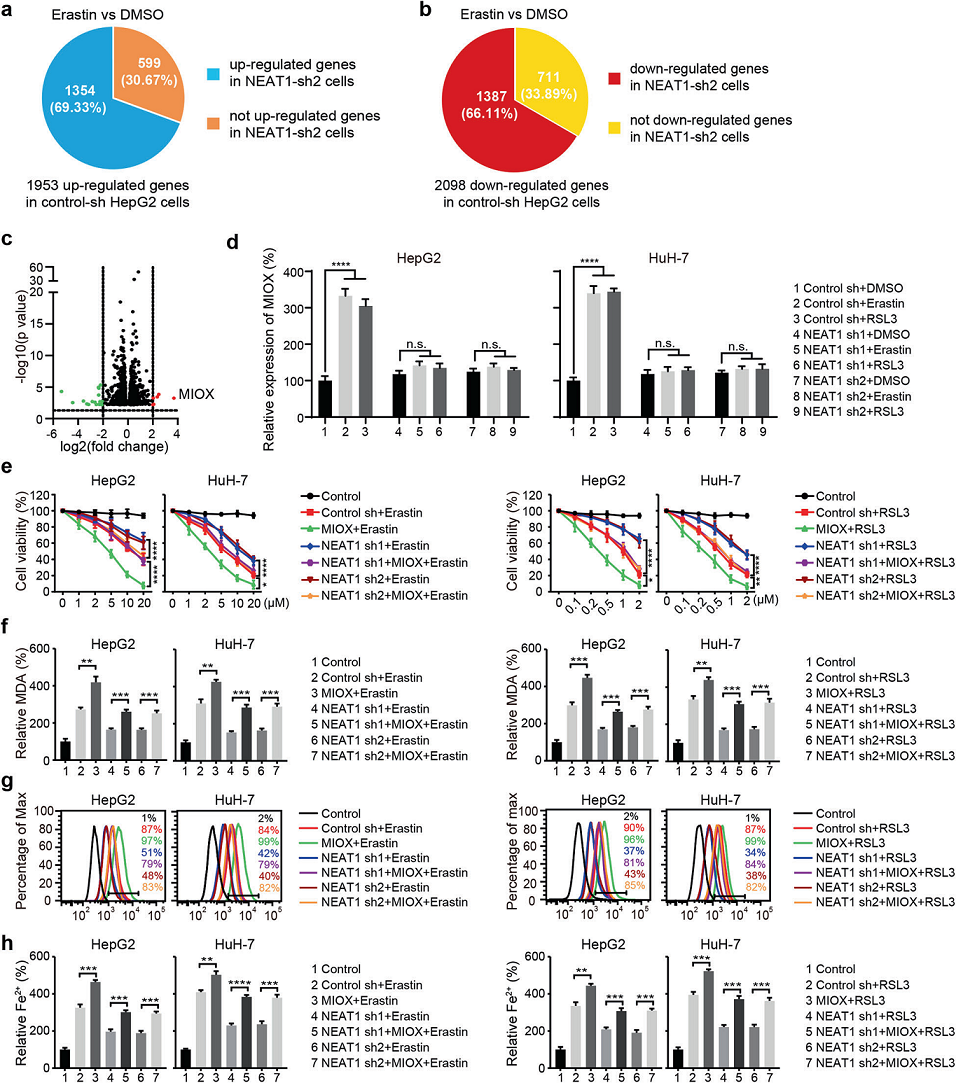
为了进一步阐明NEAT1在铁死亡中的作用机制,我们通过比较敲除NEAT1导致的基因表达差异来寻找NEAT1靶基因。如图3a和b所示,在转染shRNA对照的HepG2细胞中,经erastin处理后,有1953个上调基因和2098个下调基因。然而,在转染NEAT1 shRNA的HepG2细胞中,599个上调基因和711个下调基因对erastin无反应,表明这些基因在铁死亡中的修饰表达依赖于NEAT1(图3a,b)。此外,我们鉴定了6个上调基因和15个下调基因,它们具有更显著的修饰(图3c),并发现在erastin处理后,MIOX是上调最高的基因。同时,qRT-PCR检测表明,erastin和RSL3均不能诱导NEAT1敲除细胞中MIOX的上调,这进一步证实了铁死亡中MIOX表达的诱导依赖于NEAT1(图3d)。MIOX过表达拯救了由NEAT1缺乏抑制的erastin和RSL3诱导的铁死亡(图3e)。MIOX过表达增加NEAT1敲除细胞内MDA、脂质ROS和Fe2+水平(图3f-h)。总之,这些结果表明NEAT1通过调节MIOX的表达促进erastin和RSL3诱导的铁死亡。
4)MIOX通过调节Fe2+、GSH和NADPH促进铁死亡
先前的一项研究表明,MIOX过表达可通过调节铁积累、GSH活性和NADPH水平,加重顺铂诱导的急性肾损伤。为了测试这种机制在erastin和RSL3诱导的HCC细胞铁死亡中是否保守,我们在HCC细胞中过表达MIOX,并发现MIOX促进erastin和RSL3诱导的细胞死亡(图4a)。相反,敲低MIOX可抑制erastin和RSL3诱导的细胞死亡(图4e)。我们进一步检测了细胞内的Fe2+水平。如图4b所示,经过erastin和RSL3处理后,MIOX过表达的细胞内铁浓度显著升高。在用erastin治疗后,MIOX的过表达进一步降低了HepG2和HuH-7细胞中的GSH水平(图4c)。同样,NADPH有助于消除脂质ROS,并调节细胞对铁死亡的敏感性,在MIOX过表达的细胞中,NADPH也会降低(图4d)。相反,在HepG2和HuH-7细胞中,耗尽MIOX抑制了erastin诱导的HepG2和HuH-7细胞中Fe2+的积累、NADPH的降低和GSH的降低(图4f-h)。总之,MIOX通过调节细胞内的Fe2+、GSH和NADPH水平促进铁死亡(图4i)。

5)MiR-362-3p参与NEAT1对MIOX的调节
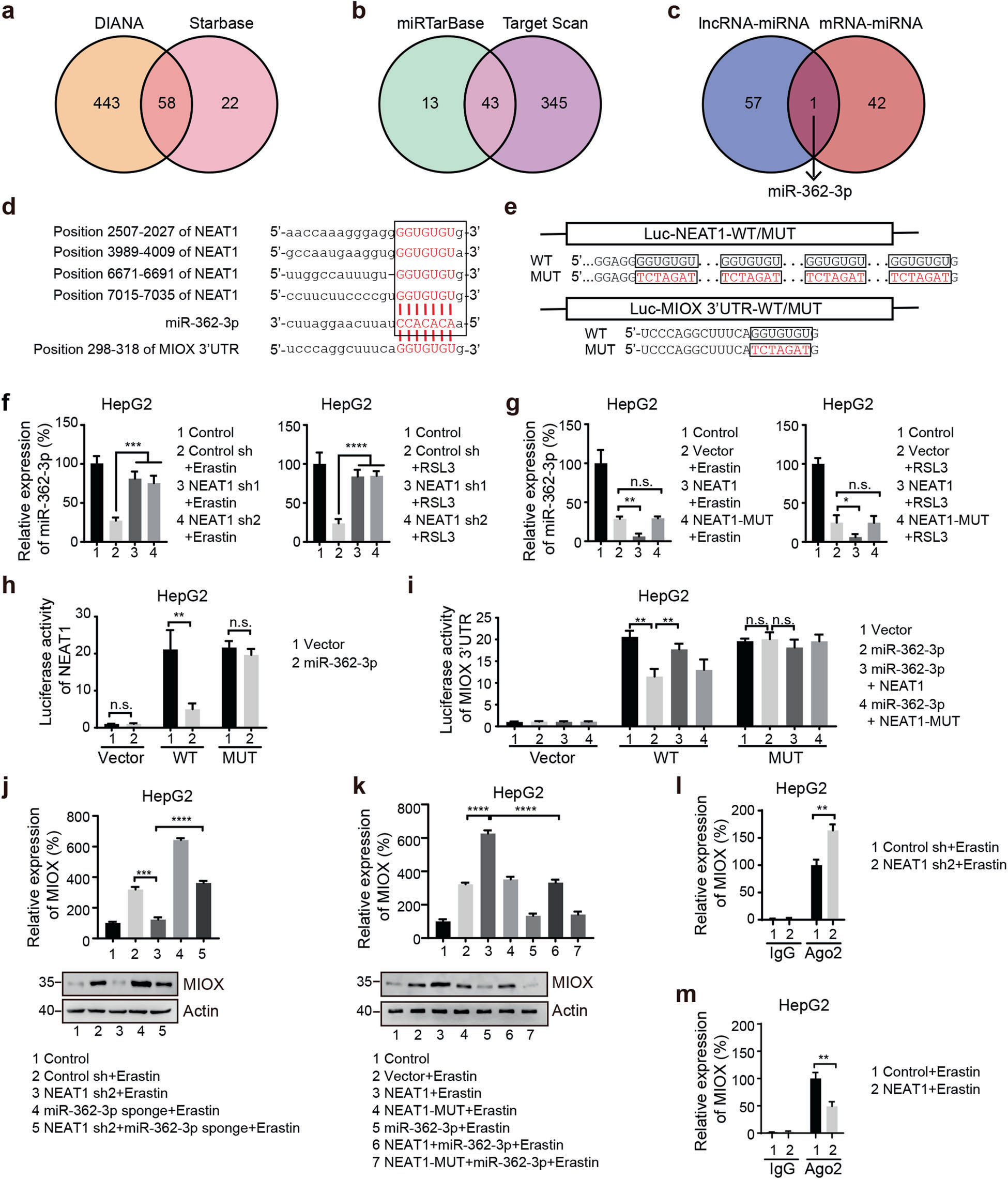
越来越多的证据表明,lncRNAs通过与miRNAs(如ceRNA)结合来调节靶基因。为了确定NEAT1在铁死亡期间是否作为ceRNA发挥作用,我们使用预测工具,使用starbase v2.0和DIANA-LncBase V2,在NEAT1中找到58个潜在的miRNA结合位点(图5a)。由于MIOX被证明是铁死亡中NEAT1的靶点,我们随后使用miRTarBase和targetscan在MIOX中寻找潜在的miRNA结合位点,两个数据库中都存在43个潜在的MIOX结合miRNA(图5b)。通过比较两种方法预测的miRNA,我们发现miR-362-3p是唯一重叠的miRNA(图5c),它可能通过NEAT1介导MIOX和铁死亡的调节。使用两种公开的生物信息学工具targetscan和starbase,我们发现NEAT1和MIOX的3′UTR包含假定的miR-362-3p结合位点(图5d)。接下来,我们进行荧光素酶活性测定(图5e)。如图5f 所示,在erastin或RSL3处理后,NEAT1的敲除增加了HepG2和HuH-7细胞中miR-362-3p的表达水平。相反,NEAT1的过表达降低了miR362-3p的表达水平(图5g)。miR-362-3p的过表达显著抑制野生型NEAT1的转录活性(图5h)。总之,这些结果表明NEAT1调节miR-362-3p。
为了确定MIOX是否是miR-362-3p的直接靶点,我们将miR-362-3p过表达载体与包含MIOX的3′UTR的报告载体共同转染。如图5i所示,miR-362-3p的过表达显著减弱了含有MIOX野生型3′UTR的报告载体的荧光素酶活性。相反,序列的突变阻断了miR-362-3p的抑制作用(图5i)。此外,我们发现miR-362-3p对MIOX 3’UTR活性的影响可以通过过表达的NEAT1部分恢复(图5i)。为了进一步证明miR-362-3p参与MIOX和NEAT1之间的交叉调节,我们评估了MIOX的表达。在erastin或RSL3处理的HepG2细胞中,NEAT1敲除抑制了MIOX的mRNA和蛋白质表达。相反,miR-362-3p的敲除显著增加了被NEAT1 shRNA抑制的MIOX的mRNA和蛋白质表达(图5j)。此外,野生型NEAT1的过表达增加了MIOX的mRNA和蛋白质表达。miR-362-3p的过表达显著抑制NEAT1诱导的MIOX的mRNA和蛋白质表达(图5k)。miRNA以Ago2依赖的方式抑制mRNA的翻译和降解。为了测试MIOX和miR-362-3p之间的相互作用是否受到NEAT1的影响,对NEAT1过表达或敲除的HepG2细胞进行RIP实验。如图5l所示,被Ago2-miR-362-3p复合物拉下的MIOX mRNA水平在NEAT1缺失的HepG2细胞中显著富集,而过表达NEAT1则显著降低MIOX mRNA水平(图5m)。总之,这些结果表明NEAT1通过miR-362-3p积极调节MIOX表达。
6)MiR-362-3p通过调节MIOX抑制铁死亡
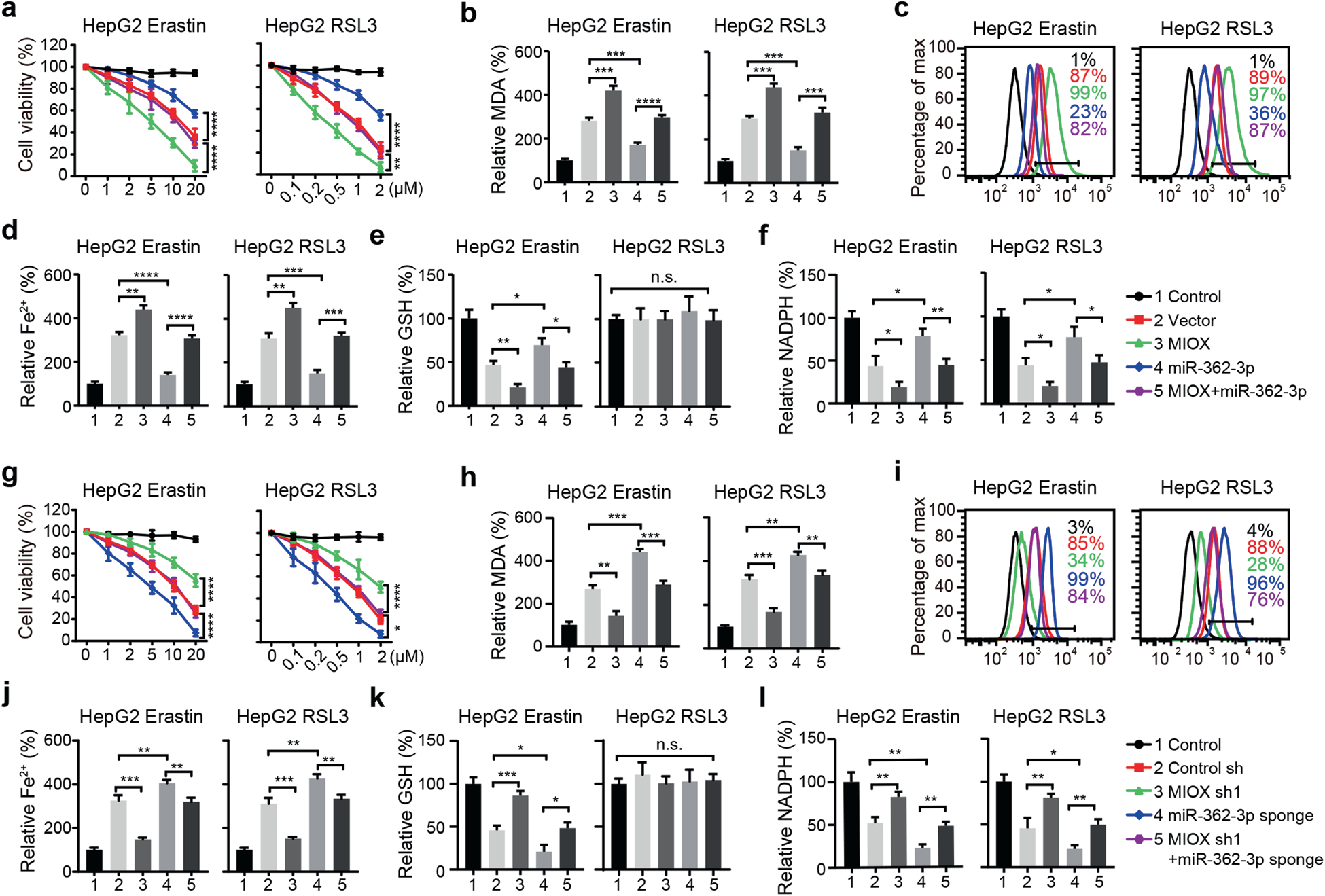
为了分析miR-362-3p是否通过对MIOX的影响来调节铁死亡,我们通过过表达MIOX进行了拯救实验。转染miR-362-3p的HepG2细胞显著抑制erastin和RSL3诱导的细胞死亡,并降低MIOX的促进作用(图6a)。同时,过表达MIOX后,MDA、脂质ROS和Fe2+的积累也部分恢复(图6b-d)。此外,MIOX的过表达抑制了由miR-362-3p诱导的GSH和NADPH的细胞内水平(图6e,f)。转染miR-362-3p海绵的HepG2细胞显著促进了erastin-和RSL3-诱导的细胞死亡和相关的铁死亡,包括脂质ROS产生、铁积累、NADPH抑制和erastin诱导的GSH缺失(图6g-l)。MIOX的下调抑制了由miR-362-3p海绵促进的erastin-和RSL3诱导的铁死亡(图6g-l)。这些结果表明miR-362-3p通过调节MIOX的表达来调节铁死亡。
7)NEAT1过表达促进erastin或RSL3在体内外诱导的铁死亡
我们通过慢病毒载体在HepG2和HuH-7细胞中稳定地过表达NEAT1,用erastin或RSL3处理细胞,然后通过集落形成测定其对细胞活力的影响。我们发现NEAT1高表达水平的细胞对erastin和RSL3诱导的铁死亡细胞死亡更敏感(图7a )。进一步探讨NEAT1表达水平对erastin或RSL3体内抗癌活性的影响。将NEAT1稳定过表达的HepG2和HuH-7细胞皮下注射到NU/NU裸鼠体内。NEAT1表达增加的肿瘤的大小明显小于使用相同药物治疗的对照组(图7b、c),并且表现出MDA水平升高和erastin诱导的GSH水平降低(图7d、e)。此外,在NEAT1过表达细胞中用erastin或RSL3处理后,4-HNE的染色显著增加(图7f)。同样地,在NEAT1过表达细胞中,MIOX表达显著升高。ISH染色证实,erastin或RSL3处理后,NEAT1过表达细胞中miR-362-3p的表达降低(图7f)。总之, NEAT1调节了erastin和RSL3在HCC细胞中的抗肿瘤活性。
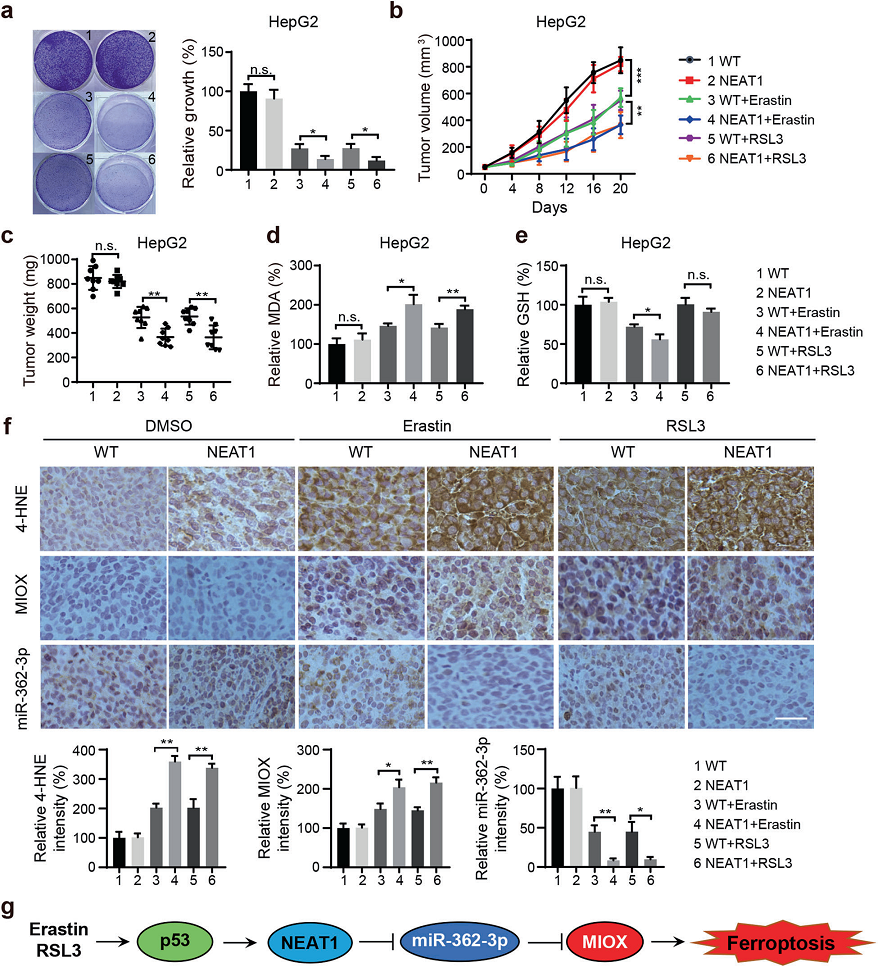
结论:我们的研究结果概述了NEAT1在铁死亡中的关键作用及其调节机制,表明对于高表达NEAT1的肿瘤患者,诱导铁死亡可能是一种有前途的治疗策略。
参考文献:
Zhang Y, Luo M, Cui X, O'Connell D, Yang Y. Long noncoding RNA NEAT1 promotes ferroptosis by modulating the miR-362-3p/MIOX axis as a ceRNA. Cell Death Differ. 2022 Mar 25. doi: 10.1038/s41418-022-00970-9. Epub ahead of print. PMID: 35338333.






