exoASO-STAT6介导的肿瘤相关巨噬细胞基因重编程导致有效的单药抗肿瘤活性
M2表型的免疫抑制肿瘤相关巨噬细胞(TAM)可破坏癌症检查点免疫治疗的有效性。将TAM重新编程为促炎性M1表型是诱导抗肿瘤免疫的一种新方法。目前有研究报道了一种独特的基于外泌体的方法,通过选择性地将靶向STAT6的反义寡核苷酸(ASO)传递给TAMs,将TAMs重新编程为促炎性M1表型。这种新的工程化外泌体exoASO-STAT6在肝脏中表现出最大的生物分布和STAT6沉默活性,并对其他组织中的影响最小。该研究与2022年2月发表在《Science Advances》,IF:14.136。
技术路线:
1.设计外泌体介导ASO传递给巨噬细胞
作者假设,具有这些特性的外泌体(对M2巨噬细胞具有趋向性)可能会优先向TAMs传递ASO,并在TME中优先有效地调节巨噬细胞中的基因表达。为了验证这一假设,开发了一种装载靶向STAT6转录因子的ASO外泌体(图1A)。从HEK293细胞中可重复地纯化外泌体[野生型(WT)或过表达的PTGFRN(PTGFRN++外泌体)],且WT和PTGFRN++外泌体均能有效地将STAT6 ASO装载在表面,并且在外泌体ASO-STAT6的生物物理性质、效力和药效作用方面没有观察到差异(图1B-D)。此外,添加疏水性胆固醇标签和连接子可实现有效的外泌体加载,从而使每个外泌体在WT或PTGFRN++外泌体上的加载量大于2000个拷贝(图1D)。
为了确定外源ASO在体内的细胞取向性,使用Cy5标记的exoASO-STAT6或freeASO在CT26结肠癌荷瘤小鼠中的生物分布。瘤内给药后,与freeASO组相比,exoASO-STAT6组在所有分析的组织中始终显示Cy5信号升高(图1E);在血液单核细胞中,与游离ASO相比,外泌ASO组增强了11倍。在CT26皮下肿瘤中,外泌体也能更有效地将ASO传递给髓系细胞。这些数据表明,外泌体可增强ASO在肝脏、外周血、骨髓和TME中的巨噬细胞、单核细胞和MDSCs的传递。
通过比较各组织中与ASO相关的主要细胞群的荧光强度,可以清楚地发现,肝脏Kupffer细胞显示的ASO信号明显高于其他任何亚群 (图1F)。这一观察结果与使用89zr标记的PTGFRN++外泌体进行组织/器官生物分布研究的结果一致,该研究显示,95%的静脉注射剂量定位于肝脏,而只有4.6和0.6%分别积累于脾脏和股骨(图1G)。此外,静脉给药时,exoASO-STAT6在小鼠的肝脏中有效诱导了STAT6敲除,而在脾脏中未观察到STAT6表达的变化(图1H和I)。等量的游离STAT6 ASO在肝脏中只导致38%的STAT6敲除,这表明外泌体介导的传递增强了ASO的效力,并使其优先传递给巨噬细胞。
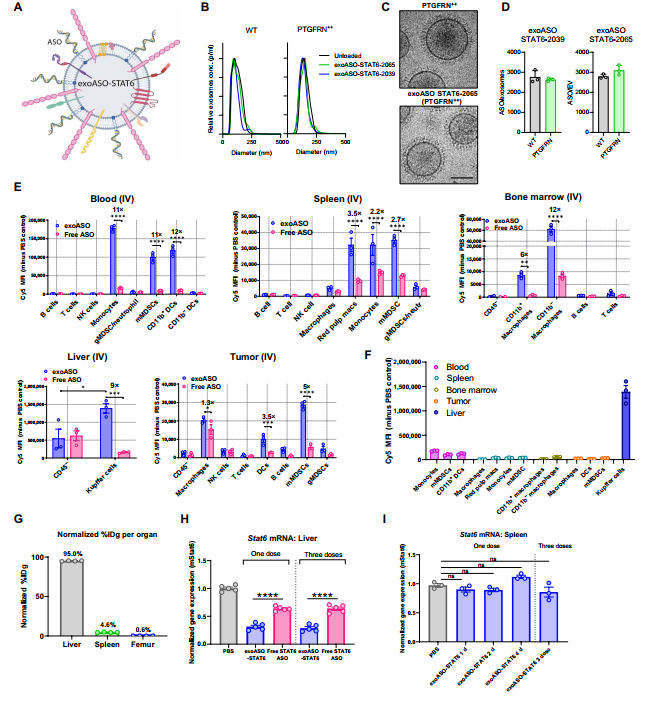
图1 外泌体介导的ASOs在体内优先传递到髓系细胞
2.免疫抑制M2巨噬细胞体外有效重编程为促炎M1巨噬细胞
M2-极化的MDMs分别使用exoASO- stat6、装载对照exoASO (exoASO- scramble)的外泌体或所示的游离ASO处理。exoASO-STAT6处理(48小时)以剂量依赖的方式降低了STAT6 mRNA的表达(图2A),并且在沉默STAT6 mRNA表达方面比游离ASO的作用大约强两倍(图2A)。此外,96小时后也观察到STAT6蛋白的剂量依赖性减少,exoASO-STAT6比游离ASO更有效(约75%减少比45%减少)(图2B)。鉴于M2巨噬细胞对exoASO的摄取更为优越,并通过吞噬作用和清道夫受体介导的机制进行介导(图S1G、H),比较了在存在吞噬和清除受体抑制剂的情况下,研究exoASO-STAT6和游离STAT6 ASO对STAT6 mRNA的沉默。与摄取过程中观察到的效果一致(图S1H),岩藻多糖(Fucoidin)和poly(I)处理部分降低了exoASO-STAT6的效力,而细胞松弛素D(Cytochalasin D)处理显著降低了exoASO-STAT6的效力(IC50)(图2C)。在游离STAT6 ASO治疗组中,抑制剂治疗后STAT6 mRNA沉默无明显变化(图2C)。这些结果显示了巨噬细胞吸收机制中游离ASO和外泌ASO之间的重要区别,这可能是这两种化合物的效力差异的基础。
为了研究exoASO-STAT6降低STAT6的表达是否足以诱导M2到M1重编程,测量了经exoASO-STAT6 NanoString分析处理的人M2极化巨噬细胞的基因表达变化。exoASO-STAT6处理导致M2基因[如CD206、CD163、转化生长因子(TGFB1)、CSF1R和CEBPB]显著减少,并伴随促炎基因如IL12B、IL1B和一氧化氮合酶2 (NOS2)的增加(图2D和E)。此外,STAT6通路基因[如IL4R、STAT6、MRC1(甘甜受体C-Type 1)和MAFB (MAF BZIP转录因子B)]也显著减少(图2D)。与对照exoASO处理的巨噬细胞相比,exoASO- stat6处理显著诱导了M1巨噬细胞基因标记,并使M2巨噬细胞基因标记减少了5倍 (图2F)。游离STAT6 ASO处理导致巨噬细胞重编程,但与剂量匹配的exoASO-STAT6相比,重编程程度较低(图2F)。然后用LPS处理24小时后,分析M2极化的MDMs中细胞因子的产生。与对照组相比,exoASO-STAT6诱导多种M1细胞因子肿瘤坏死因子(TNF-)、IL-23、IL-12和IL-1,M2趋化因子(CCL17)降低 (图2G)。与游离STAT6 ASO组相比,ASO-STAT6处理组M1细胞因子的诱导和M2细胞因子的减少更为明显(图2G)。这些数据证实exoASO-STAT6使抑制性M2巨噬细胞倾向于促炎症表型M1。
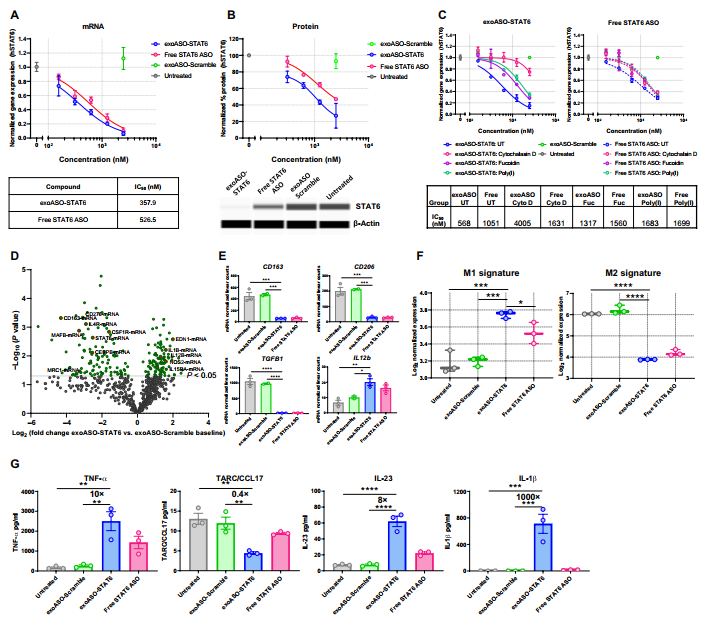
图2 exoASO持续降低STAT6表达导致M2巨噬细胞重编程
3. exoASO-STAT6诱导CT26肿瘤模型在瘤内给药后有效的单剂抗肿瘤活性
接着研究了瘤内模型中exoASO-STAT6的有效性。使用exoASO-STAT6治疗的10只小鼠中有6只观察到完全的肿瘤缓解(CRs)(图3 A和B)。Anti-CSF1R单药治疗不能抑制肿瘤生长,且anti-PD-1治疗导致肿瘤适度的生长抑制,但肿瘤生长速度没有显著降低,没有观察到CRs。Anti-PD-1与exoASO-STAT6联合使用在抗肿瘤疗效上没有显示出任何相加或协同效应(图3A、B)。exoASO-STAT6单药和联合治疗分别显著延长了42天和39天的生存期 (图3 C)。接下来,评估了CT26模型中exoASO-STAT6的剂量反应。在使用exoASO-STAT6治疗后,观察到注射的肿瘤体积呈剂量依赖性下降(图3D)。在原发肿瘤细胞接种后的第42天,对初始肿瘤有CR的动物从反面侧面接种CT26细胞发现,从原发肿瘤获得CR的小鼠均排斥二次CT26细胞的生长。相反,在naïve小鼠中观察到均匀的肿瘤生长(图3E)。另外,耗尽CD4+ T细胞只能部分抑制exoASO-STAT6对肿瘤生长的影响(图3F和G)。相反,anti-cd8抗体治疗组没有观察到CR,肿瘤生长速度与对照组相当(图3G)。这些数据表明CD8+ T细胞在介导ASO-STAT6抗肿瘤免疫中发挥了关键作用。该研究首次证明了巨噬细胞靶向治疗对肿瘤生长有显著抑制作用,当作为单一药物进行评估时,可导致肿瘤完全缓解。
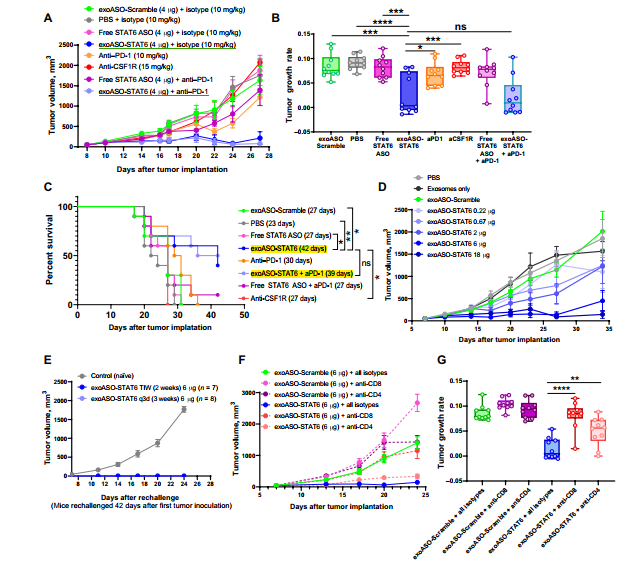
图3 exoASO-STAT6治疗结果CD8+T细胞依赖性单一疗法对CT26的疗效
4. exoASO-STAT6对CT26肿瘤模型中TME的有效重构
在CT26肿瘤模型中研究exoASO-STAT6治疗的药效学效应。如图4A所示,CT26荷瘤小鼠分别接受三种肿瘤内剂量的exoASO-STAT6或对照治疗。用exoASO-STAT6处理可诱导STAT6 mRNA减少约50%,而用游离STAT6-ASO处理后仅观察到17%的敲除(图4B)。此外,exoASO-STAT6使M2基因Arg1的表达减少了56%,而游离STAT6 ASO介导的Arg1表达减少20%(图4B)。
为了更详细地评估STAT6敲低对TME髓系室的影响,使用NanoString平台进行了基因表达分析。与对照组相比,exoASO-STAT6处理组中与M2巨噬细胞表型相关的基因下调高达80%。类似地,在exoASO-STAT6组中观察到M1相关基因(如Nos2)的双倍增加,表明exoASO-STAT6治疗后TAM的体内重新编程是有效的(图4C-E)。等效剂量的游离STAT6 ASO治疗并没有导致M2或M1相关基因的变化,这表明需要外泌体介导的体内传递来诱导TAM的有效重编程。
接下来,评估了exoASO-STAT6治疗对肿瘤免疫浸润成分的影响。如图4A所述,在用exoASO-STAT6或对照exoASO进行肿瘤内治疗后,对CT26肿瘤进行免疫表型分析,以评估TME免疫细胞的整体变化。消化肿瘤的细胞荧光分析显示,与对照组相比,exoASO-STAT6组的免疫浸润显著增加了两倍(图4F)。通过exoASO-STAT6, M2标记CD206在F4/80+ TAMs中的表达降低了60%(图4F),这支持了基因表达分析的结果(图4E)。观察到CD4室中的T调节蛋白比例显著降低,免疫浸润中的Treg频率降低3.3倍(图4F)。
通过单细胞RNA测序评估肿瘤浸润细胞的基因表达,证实exoASO-STAT6导致肿瘤中单核细胞/巨噬细胞群发生显著变化(图4G和H),并发现CT26肿瘤中有六个单核细胞/巨噬细胞群体具有不同的基因表达谱(图4G)。与对照exoASO-STAT6处理相比,Clusters c3和c6显示exoASO-STAT6诱导的STAT6表达显著降低(图4H)。Clusters c3和c5,在对exoASO-STAT6的反应中扩展(图4G)。在exoASO-STAT6处理组中,M1标记Nos2的水平显著增加(图4I)。相反,通过exoASO-STAT6处理,Clusters c1和c6减少(图4G)。Clusters c6由表达高水平Cd163和Retnla(Fizz1)的细胞代表,该群体主要与M2极化巨噬细胞相关(图4I)。Clusters c1由高水平的Cd206、Trem2和补体亚单位C1q的亚组分表示,补体亚单位C1q是由M2重编程细胞因子(如IL-4)诱导的先天性炎症的重要介质。综上所述,在接受exoASO-STAT6治疗的CT26肿瘤中,巨噬细胞和其他浸润性免疫细胞发生了深刻的变化,导致TME向免疫激活和抗肿瘤免疫的重塑。
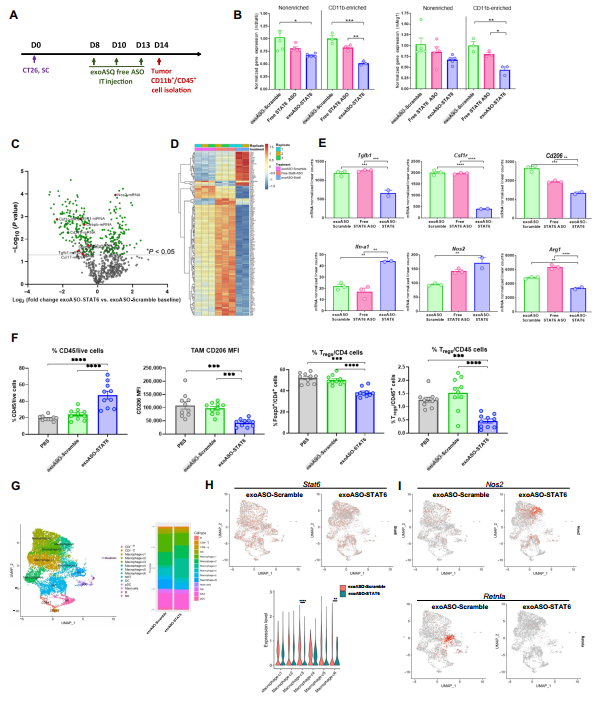
图4 exoASO-STAT6对TAMs的有效重编程可导致TME重构
5.在肝细胞癌模型中,全身给予exoASO-STAT6可导致有效的单药抗肿瘤反应
为了评估系统剂量的exoASO-STAT6对HCC的抗肿瘤疗效,使用Hepa1-6原位模型(图5A)。ExoASO-STAT6治疗导致62%的肿瘤负担减少,对照组经ExoASO处理的动物没有显示出任何可测量的肿瘤负担减轻(图5B)。组织学切片中对肿瘤细胞的定量分析也显示,与单纯外泌体对照组相比,外泌体STAT6处理组的肿瘤负担显著降低(71%)(图5C)。HE肝切片和组织病理学评分显示,exoASO-STAT6治疗的小鼠肿瘤岛明显变小,有明显的免疫浸润与肿瘤区域共定位(图5C)。
通过PCR评估exoASO-STAT6处理对全肝组织中STAT6表达的影响。结果显示,与外泌体处理组相比,exoASO-STAT6降低了34%的Stat6 mRNA水平,表明有效的靶基因敲除(图5D)。由于STAT6蛋白在肿瘤细胞和巨噬细胞中都有表达,专门分析了肿瘤区域内IBA1+巨噬细胞中STAT6的表达:在exoASO-STAT6处理组中,STAT6阳性TAMs的百分比明显低于对照组(图5J)。为了探究exoASO-STAT6在该模型中具有显著的抗肿瘤活性的作用机制,研究结束时对全肝组织进行了基因表达分析。通过NanoString评估泛癌基因面板的表达。与外泌体和对照外泌体相比,几种与抗肿瘤T细胞应答相关的基因在exoASO-STAT6组中均上调[如CD3e、CD8、ICOS、CD80和CD86](图5E和F)。相反,M2基因Cd276、Myc和Ccl17的表达降低。途径和细胞类型分析证实,诱导了有效的抗肿瘤免疫反应 (图5 G)。肝切片免疫组化证实TME的改变。结果显示,在exoASO-STAT6组中,巨噬细胞浸润增加,M1巨噬细胞标记物诱导型iNOS表达增加 (图5H)。此外,ASO优先与INOS阴性巨噬细胞共定位,证实了与M1相比,exoASO-STAT6也表现出对M2巨噬细胞的选择性趋向性(图5I)。最后,观察到升高CD8+ T细胞浸润和显著减少Treg浸润 (图5J)。
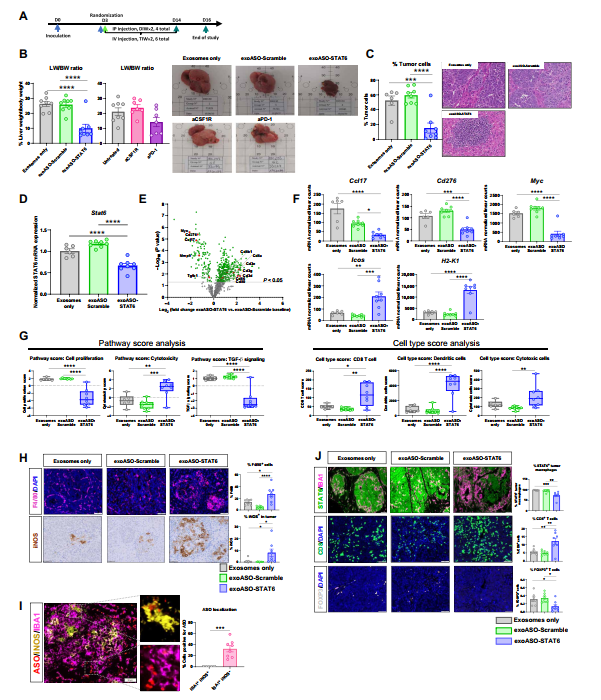
图5 全身应用exoASO-STAT6可产生有效的单药抗肿瘤反应
6.在HCC中,巨噬细胞STAT6信号与疾病预后不良相关
根据人类M2巨噬细胞中exoASO-STAT6诱导的基因表达变化生成了STAT6信号(图2D),确定了由exoASO-STAT6治疗调节的前40个基因,并从TCGA数据库中分析了这组基因在HCC肿瘤中的表达。从40个基因列表中确定了10个基因的子集,这些基因在HCC肿瘤中一致表达(图6A)。根据基因表达模式,富含免疫细胞的肿瘤和富含巨噬细胞/缺乏CD8 T细胞的肿瘤中均存在富含STAT6信号的肿瘤(图6B)。在免疫细胞浸润的肿瘤中,STAT6信号在具有高巨噬细胞、B细胞和Treg标记物的肿瘤中富集,并且在具有高TIS的肿瘤的子集中富集(图6B)。STAT6基因列表也在排除CD8的肿瘤子集中表达,与较高水平的巨噬细胞基因一致(图6B)。STAT6信号的高表达与HCC中较差的生存率相关(图6C)。总之,这些结果表明,在HCC中的巨噬细胞中有一个靶向STAT6通路的临床机会,CD8富集和CD8贫乏的肿瘤患者都可以受益于exoASO-STAT6治疗。

图6 巨噬细胞STAT6信号与疾病预后不良相关
基于CT26和Hepa1-6肿瘤模型的结果,在这里,作者提出了一个模型来描述通过exoASO-STAT6对TAM进行基因重编程介导的抗肿瘤活性(图7)。表达STAT6的TAM通过促进Treg的募集和抑制CD8细胞毒性T细胞等机制,是产生原瘤免疫抑制性TME的决定因素。exoASO在免疫抑制性TAM中敲除STAT6的能力导致有效的M1表型重编程,从而促进细胞毒性免疫反应和抗肿瘤TME的诱导。因此,exoASO-STAT6治疗不同于其他巨噬细胞靶向治疗,因为它诱导功能失调的TAM被抗肿瘤TAM替代,而不是造成整个巨噬细胞群的有害消耗。
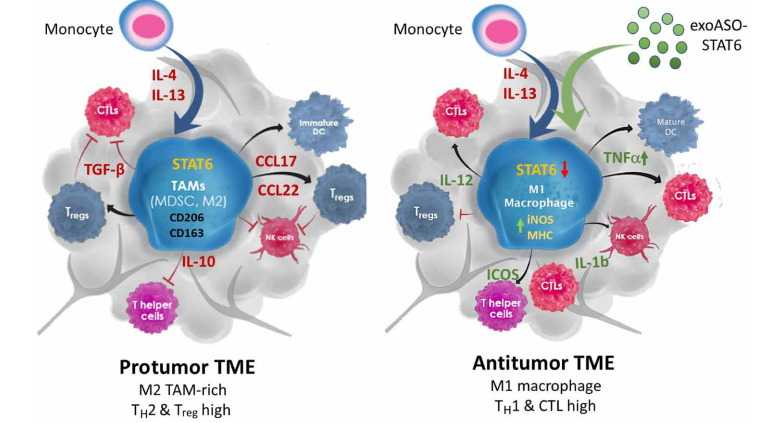
图7 exoASO-STAT6介导TAMs基因重编程的抗肿瘤活性模型
结论:
这项研究首次描述了一种工程外泌体治疗候选药物,提供靶向控制巨噬细胞表型的转录因子的ASO (exoASO-STAT6)。外泌体介导的传递可显著增强ASO抑制TAMs中STAT6表达的能力,并诱导TAMs有效地重编程为M1表型。因此, exoASO-STAT6治疗触发了TME的有效重构,使其达到促炎、抗肿瘤状态,并产生CD8 T细胞介导的反应。exoASO-STAT6的效力和特异性使其具有强大的单药抗肿瘤活性,这使这种新治疗方法有别于其他巨噬细胞靶向治疗,并突出了其临床潜力。






