新组学“空间代谢组”用于鉴定新的胃癌肿瘤特异性亚型
目前的胃癌分子分类系统包括基因组、分子和形态学特征。目前还缺乏基于组织代谢组学的胃癌分类方法。本研究通过空间代谢组确定了基于不同代谢特征的胃癌3种肿瘤特异性亚型,并确定其临床病理和分子特征。本研究于2022年4月发表在《Clinical Cancer Research》IF:12.531期刊上。
技术路线:

主要实验结果:
1、基于代谢组谱鉴定胃癌患者亚型
本研究的流程如图1所示。使用immuno-guided空间代谢组学,在总共362例患者样本中,347例可以用肿瘤区域标记,339例可以用基质区域标记。可注释的病例构成了本研究计算的基础。为了确定肿瘤和间质区是否具有显著不同的代谢组成,对肿瘤和间质区进行了特异性无监督K均值聚类分析。共确定并选择了9278个离子特征。

图1 本研究的流程图
矩阵热图和累积分布函数(CDF)图用来确定K cluster的最佳数量。肿瘤特异性和间质特异性数据的最佳聚类数均设置为3,根据共识指数,这导致CDF差异的增加较小(图2A和2B)。通过对肿瘤和基质特异性数据集应用一致性聚类,得到和矩阵对应的热图(图2C和2D)。所选块在热图中几乎是不连贯的,表明可以在肿瘤特异性光谱上区分这三个簇。这三个聚类也具有相对清晰的分离,并且表现出出明确定义的三块结构。清晰的边界进一步验证了肿瘤和基质特异性数据集的稳定和稳健的聚类。这两个数据集随后都由无监督 K-means 处理质心聚类。在 347 个肿瘤区域中,161 个被分配到亚型 T1 (46%)、55 至 T2 (16%) 和 131 至 T3 (38%)。此外,在 339 个基质区域中,125 个被分配到亚型S1 (37%),50 到 S2 亚型 (15%),164 到 S3 亚型 (48%)。
为了估计 MALDI-IMS 数据在不参考聚类的情况下区分胃癌亚型和验证亚型分配的能力,使用基于 t 分布随机邻域嵌入的方法评估了分子亚型之间的差异。结果表明,肿瘤特异性亚型和基质特异性亚型都被清楚地分开,表明它们可以很容易地根据代谢物水平进行区分(图2E和2F)。
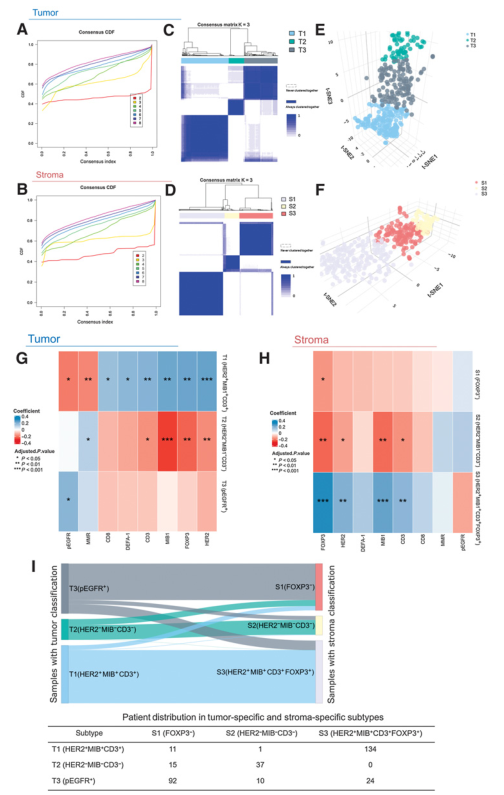
2、肿瘤和基质特异性亚型和分子特征的相关性
为了探索肿瘤和基质特异性亚型的差异,研究了它们与分子特征的蛋白质表达的关联,包括 DNA MMR、HER2、pEGFR、MIB1、CD3、CD8、FOXP3 和DEFA-1、HER2 ISH 状态和 EBV阳性情况。分子特征和患者亚型之间的所有关联如图2G-2H所示。在胃癌肿瘤的3个亚型中,T1亚型和pEGFR和MMR呈显著负相关,和其余分子呈显著正相关,特别是和HER2的相关性最大;T2亚型和CD3、MIB1、FOXP3 和HER2呈显著负相关,和MMR呈显著正相关;T3亚型则只和pEGFR正相关。因此,肿瘤特异性亚型可命名为T1 (HER2+MIB+CD3+),T2(HER2+ MIB+CD3+),T3(pEGFR+)。
而在3种基质亚型中,S1亚型则只和FOXP3负相关;S2亚型和FOXP3、HER2、MIB1和CD3呈显著负相关;S3亚型则和S2亚型完全相反,FOXP3、HER2、MIB1和CD3呈显著正相关。因此,基质特异性亚型可命名为S1(FOXP3 – ),S2(HER2 – MIB – CD3 – ),S3(HER2+MIB+CD3+FOXP3+ )。
此外,图2I展示了肿瘤特异性亚型和间质特异性亚型的患者分布。在T1和S3,T3和S1,T2和S2之间观察到亚型分布相似性。

图2 G-I肿瘤和基质特异性亚型鉴定及其与分子特征的关联
3、肿瘤特异性亚型与患者预后的关系
随后比较了肿瘤和基质特异性亚型的潜在预后差别。结果显示T1亚型预后好于T2(图3B),其它几种肿瘤亚型的预后之间则无差别(图3A,C,D)。在基质特异性亚型中,3种亚型的预后相互之间均无差别(图3E-H)。
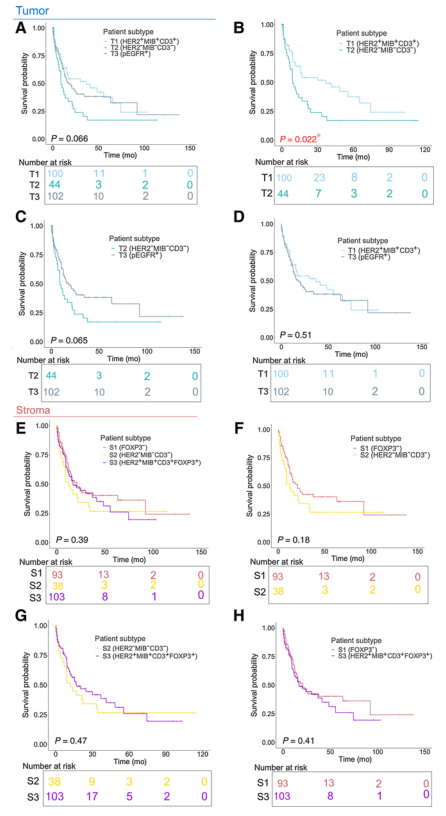
图3代谢患者亚型及其预后
4、具有不同代谢物和相关代谢途径的胃癌患者亚型
为了更深入地了解肿瘤和基质特异性亚型之间潜在的代谢差异,对 277 种带注释的代谢物进行了差异分析,并确定了每种肿瘤和基质特异性亚型的显着富集代谢物。每种肿瘤亚型的富集代谢物通过热图可视化,如图 4A 所示。图 4B-D分别展示了肿瘤的不同亚型特异性途径模式。T1亚型有45个显著上调的代谢途径,其中13个与碳水化合物代谢有关,10个与氨基酸代谢有关(图4B)。T2亚型有17个显著上调的代谢途径,其中7个与碳水化合物代谢有关,4个与氨基酸代谢有关(图4B)。T3亚型中只发现生物素代谢和胞质 DNA 传感途径的富集(图4C)。图 4E显示了从每个肿瘤和基质亚型特异性途径中选择的一种代表性代谢物的空间分布。上述结果表明,肿瘤和基质特异性亚型富含多种代谢物和代谢途径。
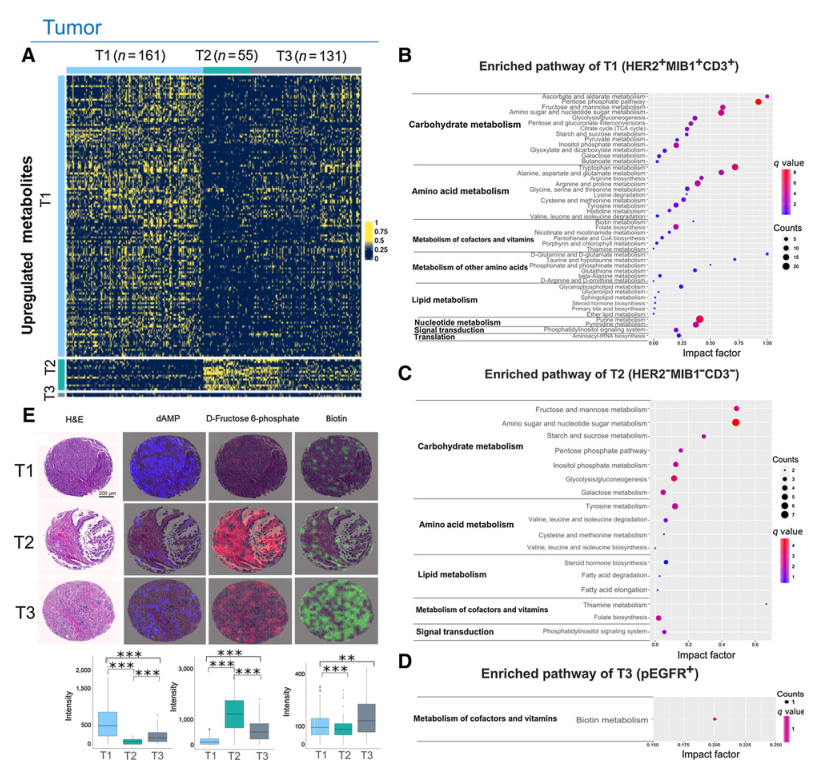
图4肿瘤亚型特异性代谢物特征及通路富集
5、T1 (HER2+MIB+CD3+)和T2(HER2+ MIB+CD3+)亚型与曲妥珠单抗治疗效率有关
在作者此前的研究中,发现胃癌对曲妥珠单抗治疗的反应与代谢分类有关(图5A和B)。该代谢组学分类器是通过应用空间代谢组学和机器学习建立的。 代谢组学分类器可以将诊断为 HER2 阳性胃癌的患者分层为曲妥珠单抗敏感和曲妥珠单抗耐药,从而预测这些患者对曲妥珠单抗的反应。该研究中的 HER2 阳性肿瘤患者被用作独立的验证队列(VARIANZ 队列),代谢组学分类器用于预测 T1 和 T2 亚型中的曲妥珠单抗反应,因为它们与 HER2 蛋白表达相关。如图5C和D所示,在本研究队列中,代谢组学分类器可以明显区分T1和T2亚型。在VARIANZ 队列中,曲妥珠治疗的患者分为T1和T2亚型与其对曲妥珠的响应显著相关(图5E)。曲妥珠阳性患者的比例在T1亚型中显著高于T2亚型(图5F)。此外,T1亚型患者采用曲妥珠治疗的预后显著高于T2亚型(图5G)。这些结果表明T1和T2亚型与曲妥珠单抗治疗效率有关。
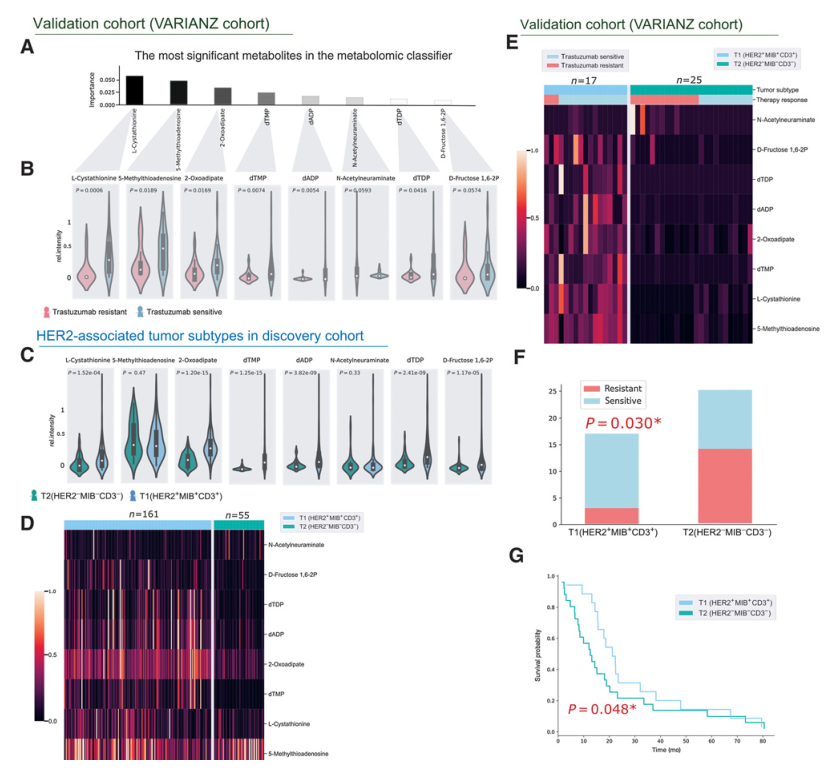
图5曲妥珠单抗治疗反应相关的HER2相关肿瘤特异性亚型T1(HER2+MIB+CD3+)和T2 (HER2-MIB-CD3-)
总之,本研究基于空间代谢组将胃癌肿瘤和基质特异性亚型各分为3类,各个类型的特征如图6所示。
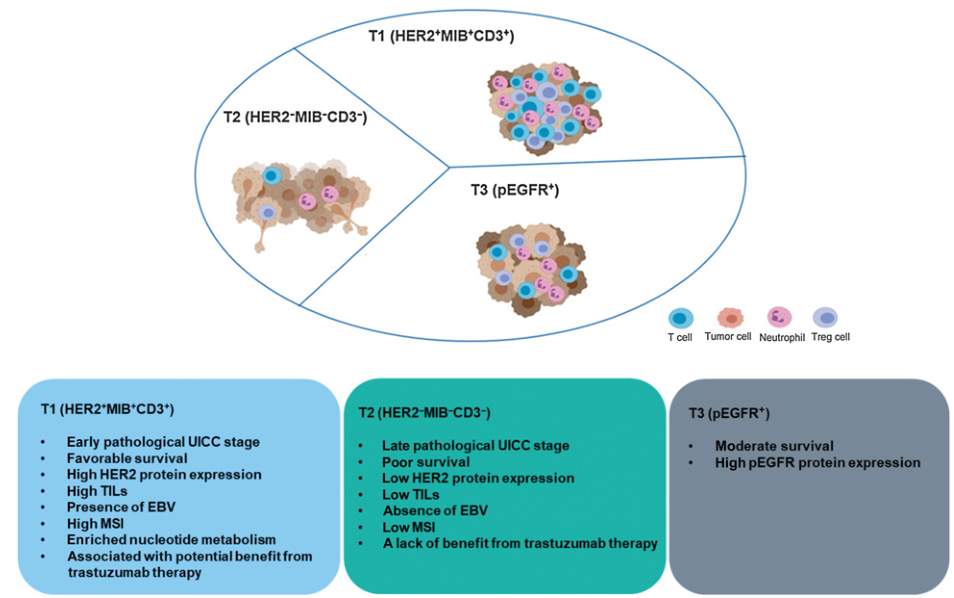
图6三种肿瘤特异性胃癌患者亚型的临床病理及分子特征总结
参考文献:
Wang Jun., Kunzke Thomas., Prade Verena M., Shen Jian., Buck Achim., Feuchtinger Annette., Haffner Ivonne., Luber Birgit., Liu Drolaiz H W., Langer Rupert., Lordick Florian., Sun Na., Walch Axel.(2022). Spatial metabolomics identifies distinct tumor-specific subtypes in gastric cancer patients. Clin Cancer Res, undefined(undefined), undefined. doi:10.1158/1078-0432.CCR-21-4383






