香烟烟雾促进结直肠癌的奥秘
吸烟是结直肠癌(CRC)的主要危险因素。我们的目的是研究吸烟是否通过改变肠道微生物群和相关代谢物促进CRC。与无烟对照组小鼠相比,暴露于香烟烟雾的小鼠肿瘤发生率和细胞增殖显著增加。在烟雾暴露的小鼠中观察到肠道微生物失调,细菌种类的丰度存在显著差异,包括Eggerthella lenta的富集,Parabacteroides distasonis 和Lactobacillus spp的耗竭。代谢组学分析显示,烟雾暴露小鼠结肠中的胆汁酸代谢产物增加,尤其是牛去氧胆酸(TDCA)。我们发现,在烟雾暴露的小鼠中,E.lenta与TDCA的相关性最大。此外,烟雾暴露小鼠表现出MAPK/ERK信号(TDCA的下游靶点)增强和肠道屏障功能受损。用暴露于烟雾的小鼠(GF-AOMS)的粪便移植的无菌小鼠增加了结肠细胞的增殖。同样,GF-AOMS显示结肠上皮中E. lenta和TDCA的丰度增加,MAPK/ERK途径激活,肠道屏障受损。总之,香烟烟雾引起的肠道微生物群失调在结肠癌中起致癌作用。烟雾诱导的肠道微生物群失调改变了肠道代谢物并损害了肠道屏障功能,这激活了结肠上皮中的MAPK/ERK信号。本文于2022年4月发表于“Gut”(IF=23.059)上。
技术路线

结果
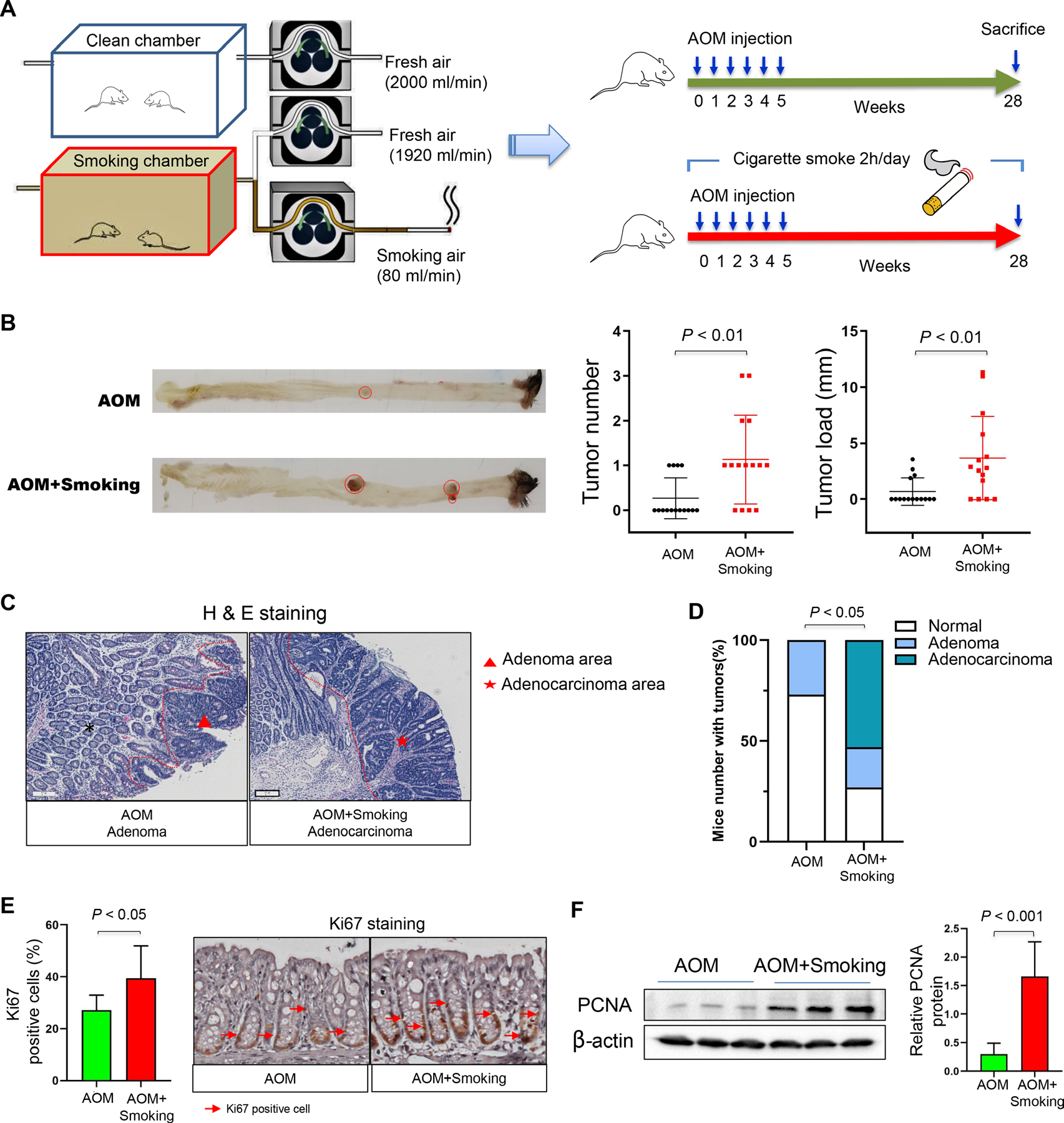
1)香烟烟雾促进小鼠结直肠肿瘤的发生
为了研究吸烟对结直肠肿瘤发生的影响,我们将AOM处理的C57BL/6小鼠暴露于清洁的空气或香烟烟雾中(图1A)。吸烟小鼠的结肠肿瘤数量和肿瘤大小均显著大于无烟对照小鼠(图1B)。显微镜组织学检查证实存在结肠腺瘤和腺癌(图1C)。暴露于香烟烟雾显著增加结肠肿瘤的发病率(图1D)。与无烟对照小鼠相比,暴露于香烟烟雾的小鼠结肠上皮细胞的增殖增加,表现为Ki-67阳性细胞的数量显著增加(图1E),细胞增殖蛋白标记物增殖细胞核抗原(PCNA)的表达水平更高(图1F)。
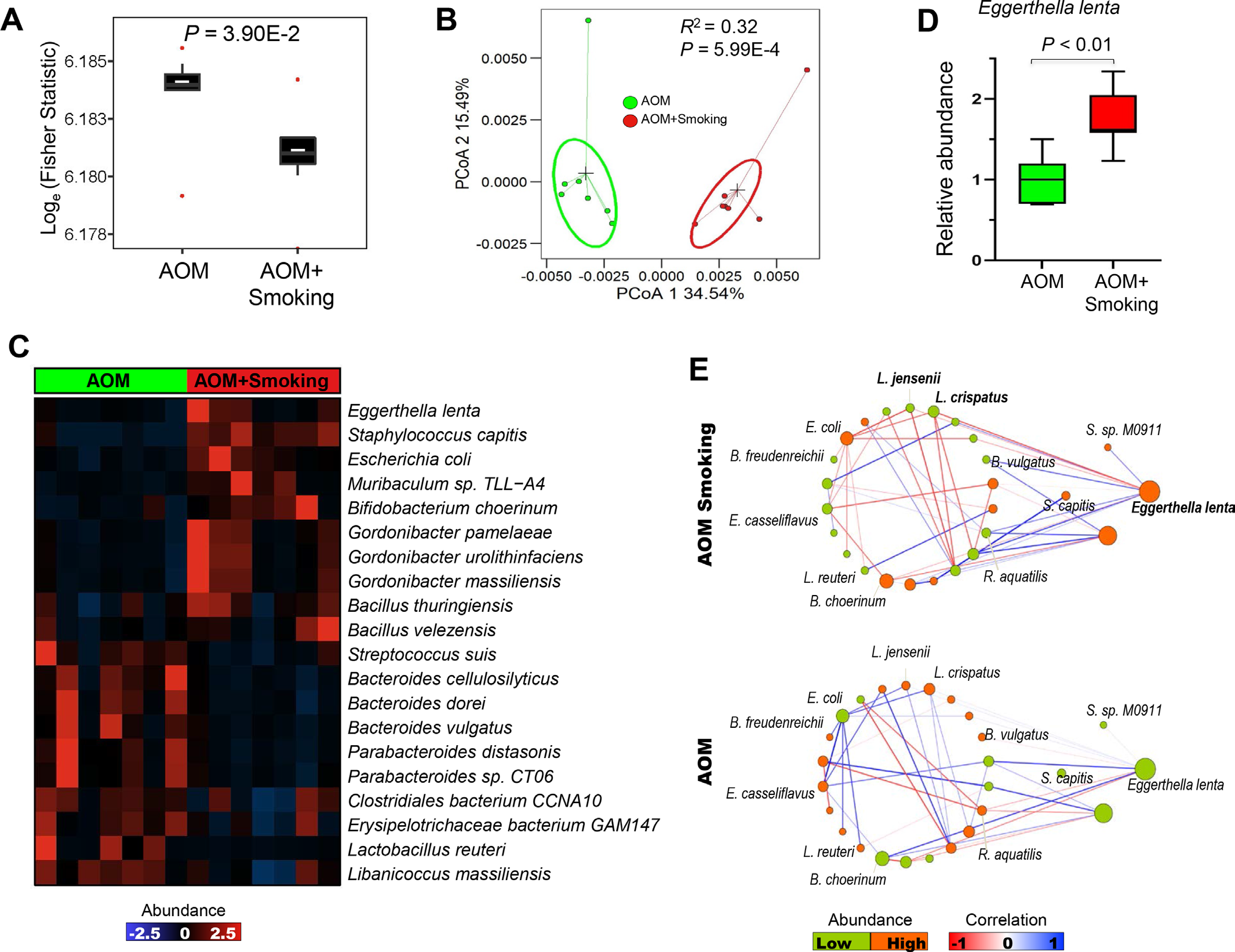
2)香烟烟雾调节小鼠肠道微生物群
我们对粪便样本进行鸟枪宏基因组测序分析,以确定香烟烟雾暴露引起的肠道微生物群的潜在变化。我们观察到,与无烟对照组小鼠相比,吸烟组小鼠的α多样性显著降低(图2A)。PCoA分析显示,烟雾暴露小鼠的肠道菌群聚类明显不同于无烟对照组小鼠(图2B)。香烟烟雾暴露小鼠中有20种细菌显著改变(图2C)。其中,E.lenta和Staphylococcus capitis富集,而肠道有益细菌(包括Lactobacillus reuteri、Parabacteroides distasonis和Bacteroides dorei)则被耗尽。我们通过定量PCR证实,暴露于香烟烟雾的小鼠中有更高丰度的E. lenta(图2D)。微生物之间的相互作用可能有助于疾病的进展。我们调查了烟雾暴露小鼠和无烟对照组小鼠之间具有不同丰度的细菌相互作用的生态网络(图2E)。我们观察到,在烟雾暴露的小鼠和无烟对照小鼠之间,细菌之间的共发生和共排除相互作用存在显著差异。我们观察到E. lenta与两种益生菌:Lactobacillus jensenii 和 Lactobacillus crispatus之间存在共排相关性(图2D),这表明在暴露于香烟烟雾的小鼠中,富集的E. lenta与耗尽的有益菌具有拮抗关联。
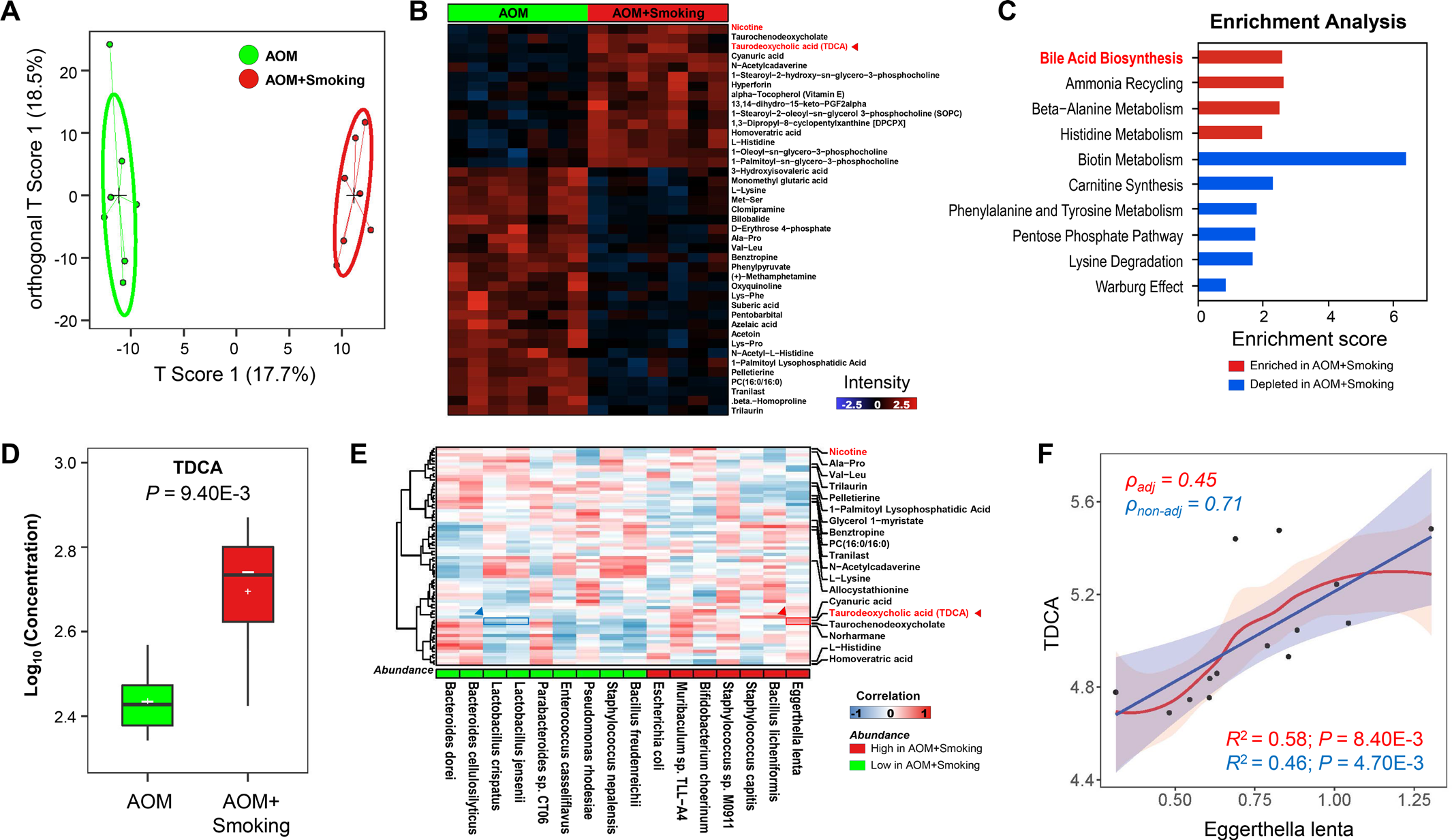
3)香烟烟雾改变粪便中肠道微生物群相关代谢物
我们通过对小鼠粪便进行液相色谱-质谱(MS)/质谱分析,测定烟雾暴露后粪便代谢物的变化。正交偏最小二乘判别分析表明,吸烟小鼠的粪便代谢特征与无烟小鼠有显著差异(图3A)。与无烟对照组小鼠相比,香烟烟雾暴露小鼠的粪便中有41种代谢物发生了改变(图3B)。改变的代谢物在不同的代谢信号通路中富集或减少(图3C)。与无烟小鼠相比,吸烟小鼠的胆汁酸生物合成是最丰富的途径。TDCA是已知的致癌原。烟雾暴露小鼠的TDCA丰度显著增加(图3B)。靶向MS进一步证实吸烟小鼠粪便TDCA升高(图3D)。为了确定微生物群与代谢物的潜在关联,我们通过部分Spearman相关分析了细菌与代谢物之间的相关性。我们观察到E. lenta与TDCA呈最显著正相关,而L. jensenii 和 L. crispatus与TDCA呈负相关(图3E)。我们进一步证实,E. lenta的丰度与粪便中TDCA的浓度呈正相关(图3F)。因此,肠道微生物失调和代谢物改变可能共同促进结肠肿瘤的发生。
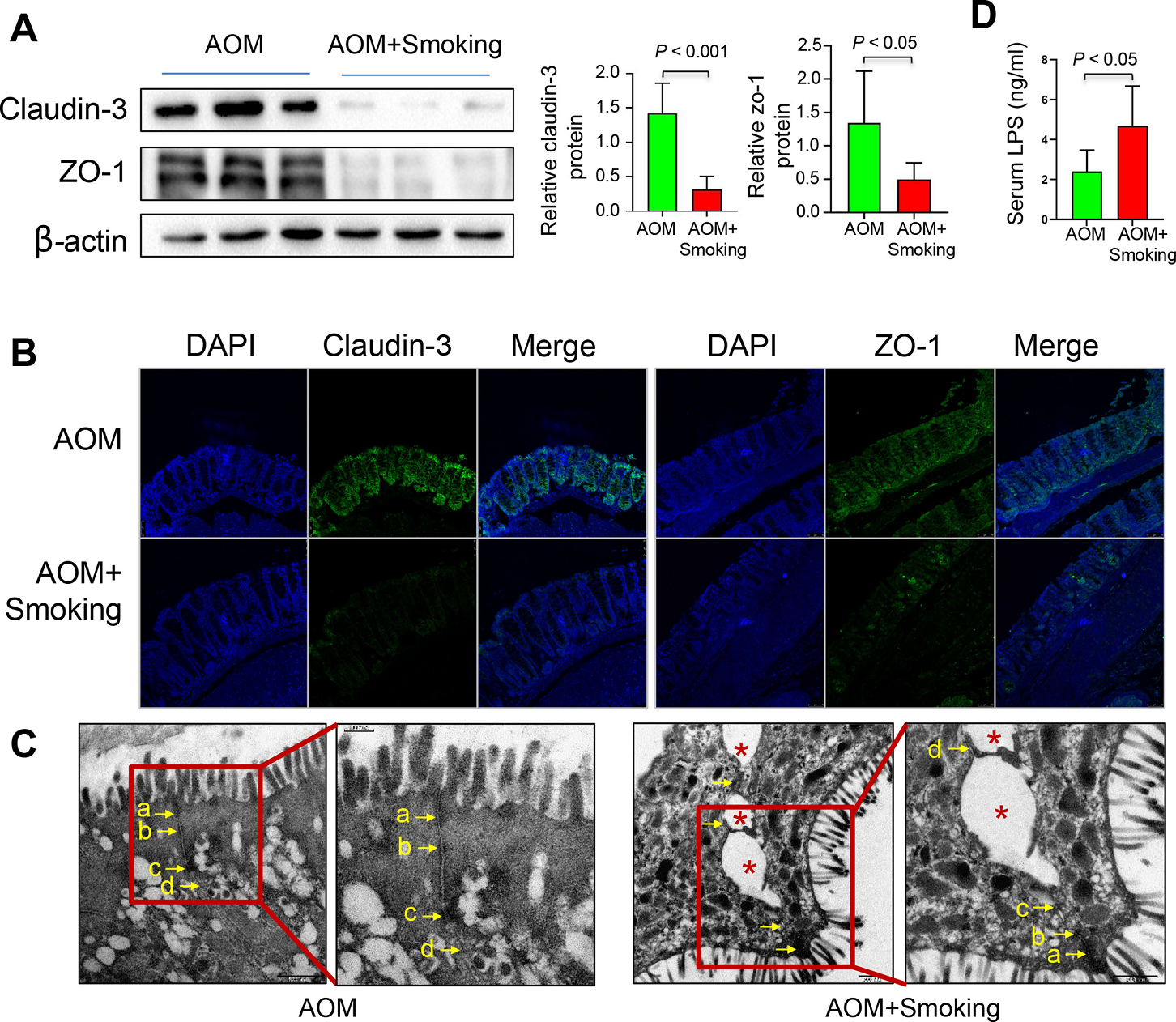
4)香烟烟雾损害肠道屏障功能
为了研究吸烟对肠道屏障功能的影响,我们分析了结肠紧密连接蛋白claudin-3和ZO-1的表达水平以及血清脂多糖(LPS)的水平。通过western blot(图4A)和免疫荧光染色(图4B),香烟烟雾显著降低了claudin-3和ZO-1的水平。通过电子显微镜检查进一步证实受损的紧密连接(图4C)。同时,我们发现,与无烟小鼠相比,吸烟小鼠的血清LPS水平显著升高(图4D)。这些结果共同表明,吸烟导致肠道屏障功能受损。
5)香烟烟雾增强结肠上皮中致癌MAPK/ERK通路和促炎途径
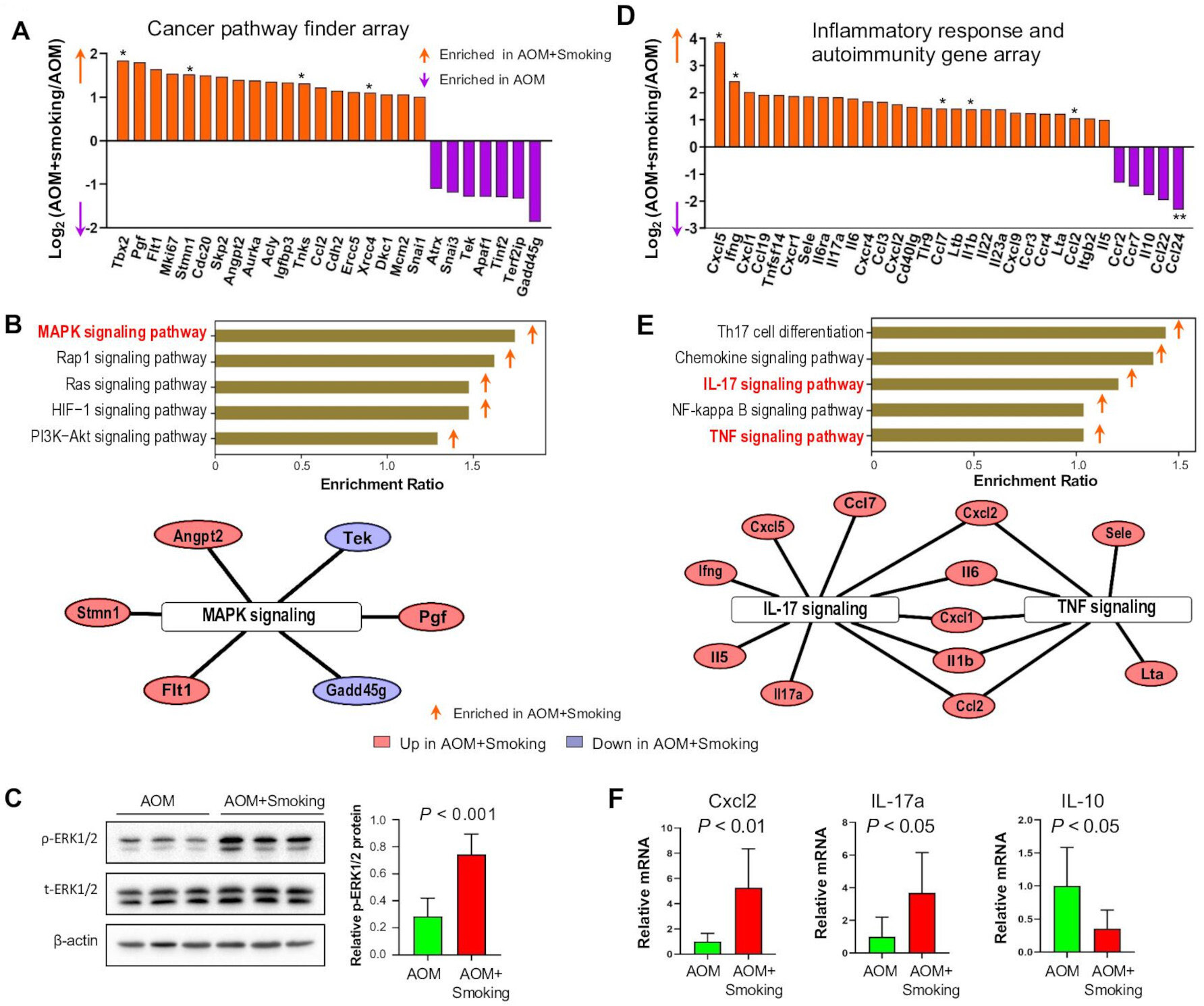
为了获得吸烟致瘤效应的分子见解,我们利用PCR阵列分析了结肠上皮中癌症相关基因的表达。与无烟对照小鼠相比,我们在烟雾暴露小鼠中观察到19个上调基因和7个下调基因(图5A)。富集分析表明,MAPK信号通路是香烟烟雾激活的最主要通路(图5B)。先前的研究报道,TDCA可以激活MAPK途径的ERK亚家族。因此,我们评估了暴露于香烟烟雾的小鼠结肠上皮中MAPK/ERK的激活情况。吸烟激活MAPK/ERK信号通过磷酸化ERK1/2水平的升高得到证实(图5C)。这些发现表明,香烟烟雾诱导ERK1/2磷酸化,激活MAPK/ERK信号通路,促进结肠肿瘤的发生。
肠道细菌失调与炎症密切相关。因此,我们利用小鼠炎症反应和自身免疫PCR阵列分析了促炎基因的表达。与无烟对照组小鼠相比,我们在香烟烟雾暴露小鼠中观察到27个上调基因和5个下调基因(图5D)。香烟烟雾可诱导包括IL-17信号和TNF信号通路的改变(图5E)。RT-PCR证实,与无烟对照小鼠相比,烟雾暴露小鼠的促炎性Il-17a、Cxcl2表达增加,抗炎性Il-10表达减少(图5F)。这些发现表明,吸烟促进结肠肿瘤发生中的炎症。
6)粪便微生物群移植影响无菌小鼠肠道微生物群
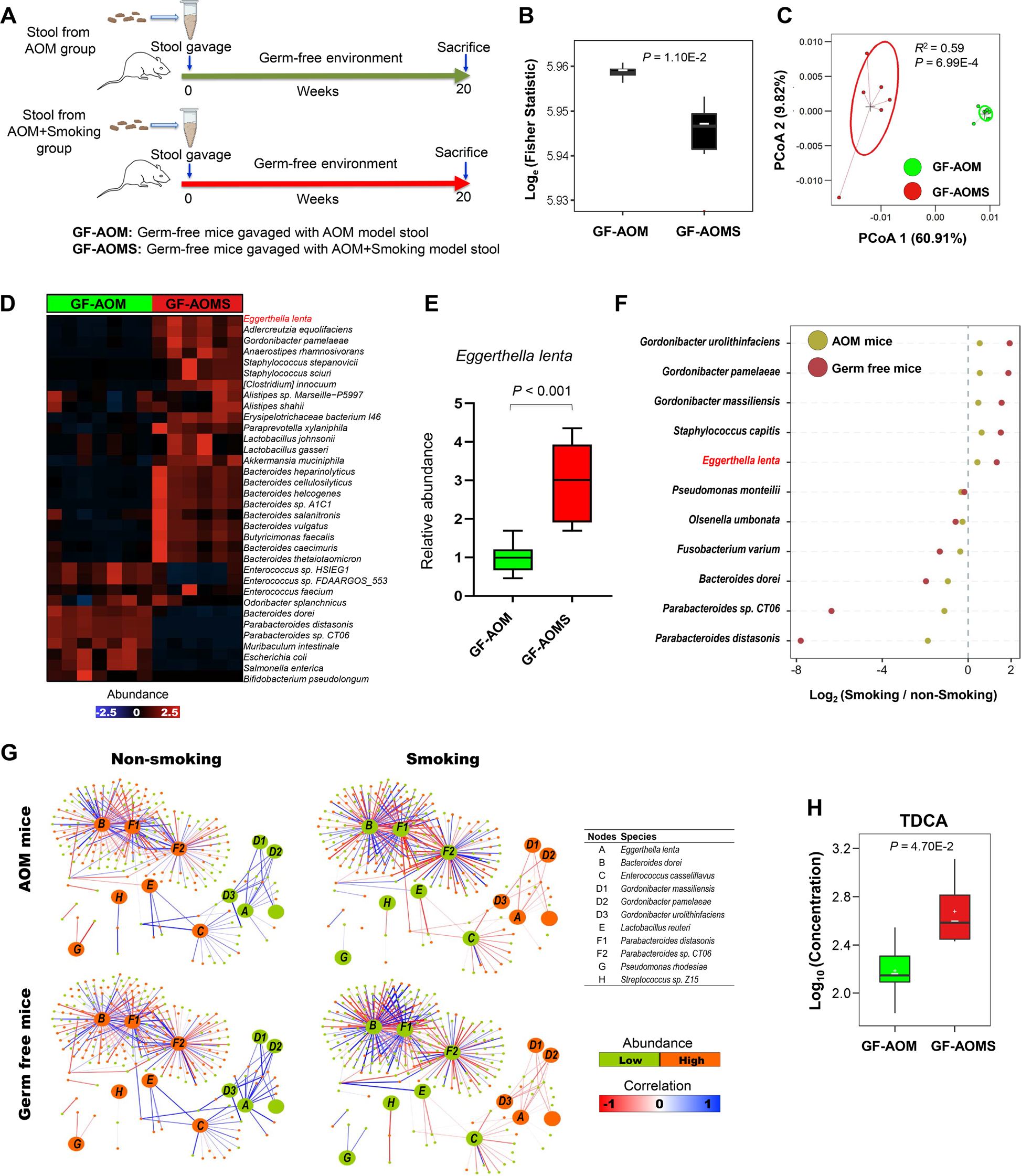
为了证实香烟烟雾改变的肠道微生物群对结肠肿瘤发生的直接作用,我们在无菌小鼠中进行了粪便微生物群移植。无菌小鼠灌胃暴露于香烟烟雾或无烟常规小鼠的粪便。20周后采集小鼠并进行检查(图6A)。我们进行了鸟枪宏基因组测序分析。与传统的AOM小鼠模型相似,与用无烟小鼠(GF-AOM)粪便灌胃的无菌小鼠相比,用香烟烟雾暴露小鼠(GF-AOMS)粪便灌胃的无菌小鼠的α多样性显著降低(图6B)。β多样性分析显示,这两组无菌小鼠的肠道微生物群明显分离(图6C)。进一步的分析显示34种差异丰富的细菌(图6D)。在GF-AOMS小鼠中,E. lenta的丰度显著增加,P. distasonis显著降低。我们通过定量PCR证实,GF-AOMS组中的E. lenta丰度显著高于GF-AOM组(图6E)。我们进一步测试了两种小鼠模型(无菌小鼠和常规AOM小鼠)之间微生物群变化的一致性。我们发现,烟雾暴露AOM小鼠中丰度增加的细菌在GF-AOMS小鼠中持续增加,而烟雾暴露AOM小鼠中丰度减少的细菌在GF-AOMS小鼠中持续减少(图6F)。重要的是,我们观察到在烟雾暴露的AOM小鼠和GF-AOMS小鼠中,E. lenta丰度增加,而P. distasonis丰度降低。相关分析表明,与供体小鼠相比,无菌小鼠粪便移植后,生态网络模块保持不变(图6G)。此外,与GF-AOM小鼠相比,GF-AOMS小鼠的粪便TDCA水平也显著升高(图6H)。
7)香烟烟雾改变的微生物群增加了无菌小鼠的结肠细胞增殖,损害了肠道屏障功能,并增强了MAPK/ERK和促炎基因的表达
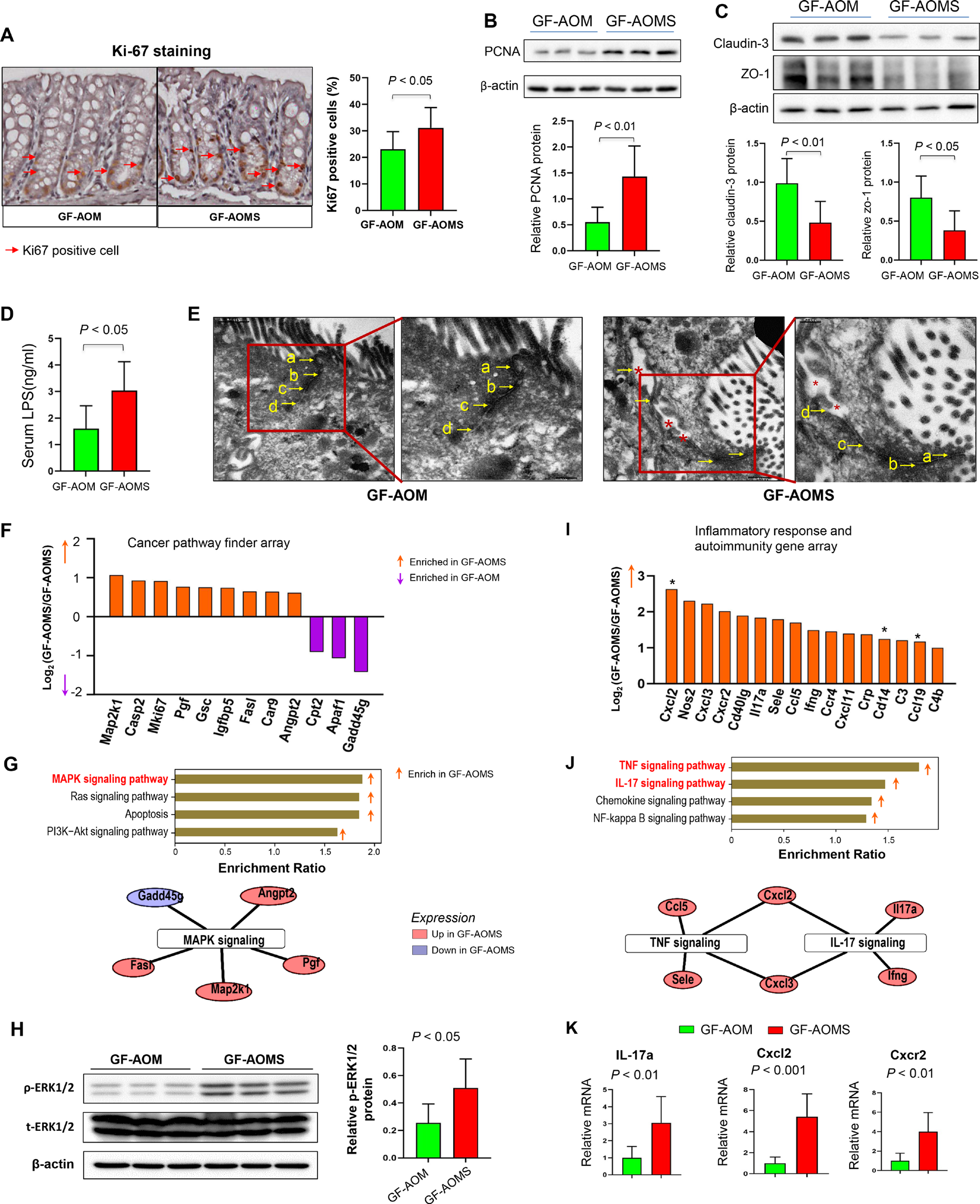
与GF-AOM小鼠相比,GF-AOMS小鼠的结肠上皮细胞增殖增加,表现为Ki-67阳性细胞比例更高(图7A)和PCNA表达水平更高(图7B)。接下来,我们研究了香烟烟雾改变的微生物群是否会影响无菌小鼠的肠道屏障功能。我们观察到GF-AOMS小鼠中claudin-3和ZO-1的表达降低,血清LPS水平升高(图7C,D)。电子显微镜检查也证实了GF-AOMS小鼠的肠道屏障功能受损(图7E)。为了证实香烟烟雾改变的微生物群促进结肠细胞增殖的分子机制,我们在粪便灌胃无菌小鼠的结肠上皮上进行了癌症通路检测阵列。与GF-AOM小鼠相比,我们在GF-AOMS小鼠中发现了9个上调基因和3个下调基因(图7F)。这些差异表达基因主要富集在MAPK/ERK信号通路中。与GF-AOM小鼠相比,GF-AOMS小鼠磷酸化ERK1/2蛋白表达升高,证实了MAPK/ERK信号的激活(图7G和H)。使用炎症反应和自身免疫PCR阵列,我们发现与GF-AOM小鼠相比,GF-AOM小鼠中有16个促炎基因上调(图7I),并且这些基因也主要富集在TNF和IL-17信号通路中(图7J)。定量RT-PCR证实,与GF-AOM小鼠相比,GF-AOMS小鼠中TNF和IL-17通路中的关键促炎基因上调,包括IL-17a和Cxcl2以及Cxcr2(图7K)。
结论:这项研究首次证明,吸烟通过诱导肠道微生物群失调促进结肠肿瘤的发生。烟雾诱导的肠道微生物群失调可增加结肠TDCA水平,进而激活结肠上皮中的MAPK/ERK、IL-17和TNF信号通路。此外,肠道微生物群失调引起的肠道屏障功能障碍可能进一步促进TDCA激活MAPK/ERK信号通路。
参考文献:
Bai X, Wei H, Liu W, Coker OO, Gou H, Liu C, Zhao L, Li C, Zhou Y, Wang G, Kang W, Ng EK, Yu J. Cigarette smoke promotes colorectal cancer through modulation of gut microbiota and related metabolites. Gut. 2022 Apr 6:gutjnl-2021-325021. doi: 10.1136/gutjnl-2021-325021.






