METTL3调控肌肉的维持和生长
骨骼肌的生长是机体健康的基础。基因表达波动对肌肉稳态和对环境损害的响应至关重要。但是目前,对于调节这种波动同时影响肌肉蛋白质组的转录后机制知之甚少。本文报道了在超载诱导应激后骨骼肌肥厚性生长的mRNA m6A动态的全基因组分析。本研究于2022年1月发表在《Nature Communications》IF:14.919期刊上。
技术路线:

主要实验结果:
1、m6A增加和重塑伴随着骨骼肌肥厚
为确定m6A在骨骼肌肥厚中的作用,作者首先评估了机械过载小鼠中RNA上的m6A修饰水平,发现相比于对照小鼠,过载肌肉组织的整体m6A水平增加(图1a-b),且这种增加源于METTL3的表达增加(图1c-d),表明成年肥厚肌生长期间METTL3-m6A轴整体增强。为深入鉴定肌肉过载后m6A修饰的mRNA,进行了meRIP-seq(图1e)。虽然转录组上的一组核心m6A峰不受肥大刺激的影响,但分析显示,在1674个mRNA上,过载肌肉中m6A的重塑在870个新转录本上获得了1704个m6A峰,并且有804个mRNA 在适应过载刺激时丧失了1591个m6A峰(图1f, g)。对转录本上m6A位置的分析还发现,这种修饰在mRNA终止密码子附近富集,在基线和过载条件下,其密度和频率略有差异(图1h, i)。对m6A修饰的肌肉转录组的GO分析进一步强调了m6A修饰mRNA编码转录调控因子的稳定存在,而最丰富的一类超载响应转录本是由参与磷酸化依赖细胞信号转导调控的蛋白编码的(图1j, k)。这些数据暗示了m6A依赖的转录后基因调控、转录和翻译后通路之间的相互作用。总之,这些结果表明,增加的METTL3表达和m6A丰度标志着骨骼肌的肥厚反应,在超负荷诱导肥厚过程中,m6A靶向转录组重塑影响特定的酶促肌肉过程。
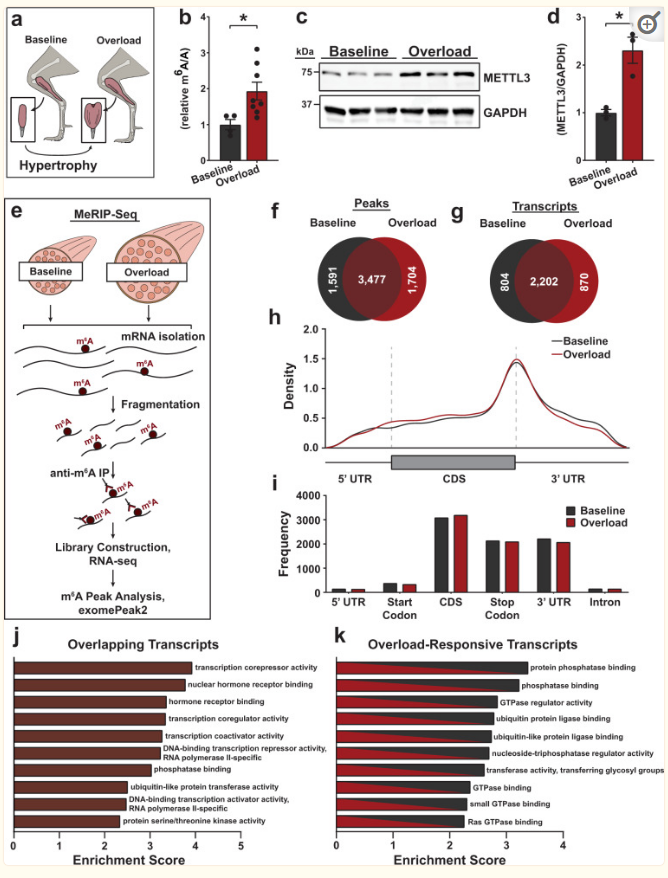
图1 METTL3和m6A重构伴随着肌肉生长
2、METTL3是适应肥厚肌肉压力所必须的
为确定METTL3在成人骨骼肌中的作用以及控制其水平的后果,建立了一个肌纤维特异性METTL3功能缺失小鼠模型(METTL3肌肉敲除,M3-mKO)(图2a)。METTL3缺失效率表现为肌肉中METTL3的mRNA水平和蛋白水平均显著下降(图2b,c)。这种短期敲除策略不影响小鼠的体重、心脏重量和骨骼肌重量(图2d-h)。为确定METTL3是否对成年骨骼肌肥大有必要,对M3-mKO小鼠和同窝小鼠进行了肌肉超负荷试验。在超载14天后,M3-mKO小鼠的跖肌重量未能增加到与WT对照组相同的程度(图2i)。肌肉细胞大小分析进一步表明,M3-mKO小鼠中,过度负荷引起的肌纤维横截面增加被消除(图2j, k)。因此,在骨骼肌对机械负荷的肥厚反应中,METTL3对肌细胞生长至关重要。

3、增强METTL3通路有利于骨骼肌的生长
证明METTL3对肌肉肥大的必要性引出了一个问题,即增加骨骼肌中METTL3的表达是否足以增强对肌肉超负荷的肥厚反应。为此,构建METTL3过表达质粒(M3-OE)和对照质粒(Ctrl),电转至小鼠跖肌,随后对小鼠进行肌肉过载刺激(图3a)。METTL3过表达后小鼠跖肌中METTL3的表达显著增加(图3b),m6A水平显著增加(图3c)。令人惊讶的是,METTL3过表达后小鼠跖肌的重量和肌纤维横截面显著增加(图3d-f)。然后,测试了覆盖METTL3通路是否足以在出生后发育期间增强骨骼肌生长。为此,将编码小鼠METTL3或对照病毒载体的腺相关病毒(AAV)注射到出生后第3天的小鼠中(图3g)。8周后检测发现,AAV-METTL3组小鼠的METTL3表达,跖肌的重量和肌纤维横截面显著增加(图3h-j),提示METTL3可驱动肥厚响应。最后,探究METTL3是否可以在没有肥厚触发器的情况下驱动肌肉质量的自发增加。为此,向5个月大的小鼠胫骨前肌注射AAV-METTL3或对照病毒载体(图3k)。结果显示胫骨前肌METTL3有效过表达,较高的METTL3含量伴随着胫骨前肌重量的增加和肌纤维大小的显著增加(图3l-n)。

图3 METTL3在骨骼肌中是促肥厚的
4、METTL3对于骨骼肌的维持和功能是必须的
保持健康的肌肉量对于预防老年人和其它慢性疾病群体的发病率和死亡率至关重要。为评估METTL3通路的失调是否足以导致肌肉萎缩,进行了一个慢性缺失实验,将成人肌肉中的METTL3敲除8个月(图4a)。虽然METTL3敲除对身体或心脏重量没有显著影响(图4b, c),但METTL3的慢性长期缺失导致所有分析的骨骼肌质量下降(图4d-h)。通过量化胫骨前肌、足底肌和比目鱼肌的横断肌纤维面积,在细胞水平上证实观察到的肌肉萎缩(图4i-l)。为了确定METTL3缺失8个月后观察到的肌肉损耗的功能后果,进行了体内肌肉扭矩测量,结果显示METTL3缺失小鼠的跖屈强直性肌肉力下降(图4m),并且METTL3缺失小鼠在跑步机代谢试验中进一步表现出跑步性能缺陷和最大耗氧量降低(图4n, o)。总之,这些数据表明,随着时间的推移,METTL3对于维持肌肉质量和功能是必要的。
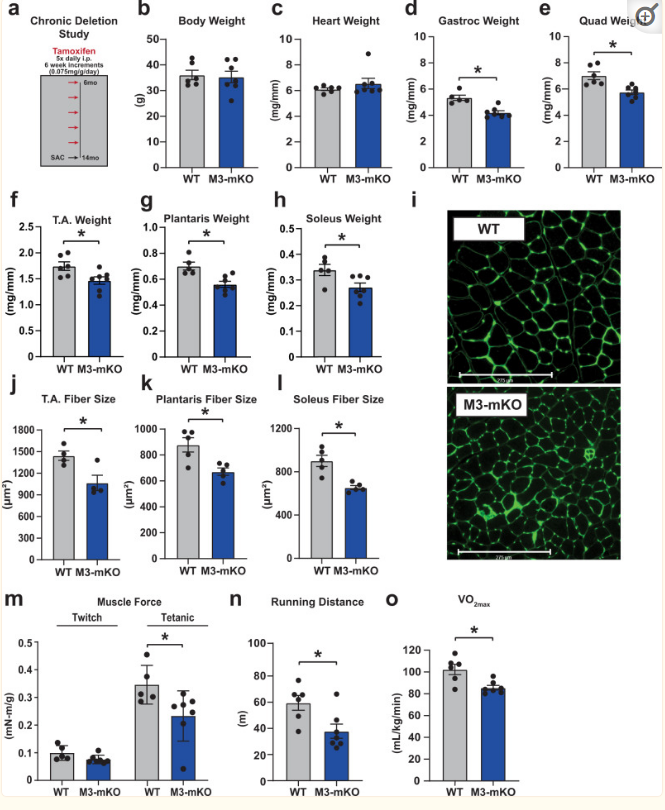
图4 METTL3的慢性缺失会导致肌肉萎缩
5、肌肉m6A-RNA翻译的METTL3依赖调节可调控肥厚基因调节
mRNA上m6A的形成可以通过改变修饰后mRNA的翻译能力来影响基因的转录后表达。为了从机制上理解METTL3如何调节肌肉大小,在骨骼肌动蛋白启动子的控制下,将M3-mKO小鼠和野生型对照小鼠与含有RPL22的HA标签的小鼠杂交,从而分离肌纤维特异性核糖体(图5a)。首先验证HA-RPL22的表达(图5b)。使用HA抗体对从总肌肉提取物中提取的肌纤维核糖体进行免疫沉淀,分析核糖体相关转录本,然后对“拉下”mRNA进行测序,作为肌纤维特异性“翻译体”的代表,与总归一化mRNA对比(图5c)。核糖体相关 mRNAs 的生物信息学交叉分析,来自对照肌肉有或没有 METTL3,与之前由 meRIP-seq 鉴定的所有对照 m6A mRNAs 重叠分析显示,约39% 的mRNAs经历 METTL3 依赖性差异翻译,因而直接靶向METTL3 通路(图5d)。特别是,在557份差异翻译转录本中(453份富集于WT,加上104份富集于mKO),216份含有m6A(178份富集于WT,加上38份富集于mKO)。对这些重叠转录本的GO分析显示,TGF-β超家族受体是最丰富的(图5e)。在这类基因中,激活素2型A受体(Acvr2a)是METTL3 KOs肌肉中翻译增加的典型转录本(图5f)。结果证实,Acvr2a上的m6A修饰是METTL3依赖的(图5g),肌肉中METTL3的缺失导致Acvr2a mRNA翻译量增加(图5h)和Acvr2a蛋白合成量增加(图5i)。含YTH结构域家族(YTHDF)的RNA结合蛋白是m6A修饰转录的关键调控因子。YTHDF2可以特异性结合Acvr2a mRNA(图5j)。YTHDF2有利于相互作用转录本的衰减,表明依赖于METTL3的m6A甲基化可能影响Acvr2a的稳定性。事实上,METTL3降低了Acvr2a mRNA的稳定性(图5k)。
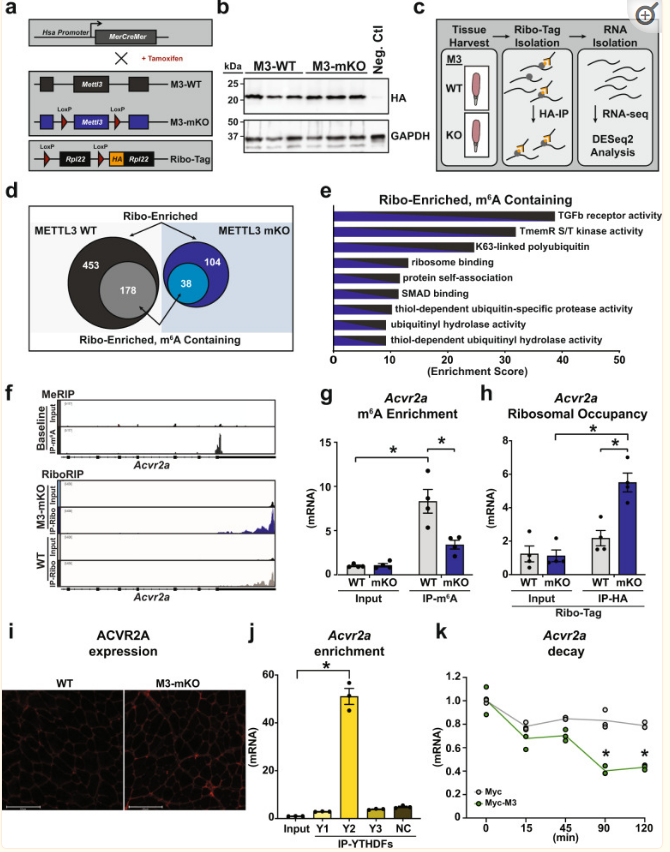
6、METTL3通过调控Activin受体的m6A影响TGF-β超家族信号转导
在肌肉超负荷时,m6A对Acvr2a mRNA的修饰进一步增加(图6a),表明在应激适应过程中,METTL3对该通路的作用增强。Activin受体激活通过细胞内SMAD3磷酸化发挥抗肥厚作用。因此,探究了这种翻译后修饰,发现METTL3缺陷小鼠在超负荷的肌肉中有异常的SMAD3磷酸化(图6b)。在METTL3缺陷的肌肉中,抗肥厚性SMAD3的转录靶点,如Murf1和Mafbx的表达增加(图6c, d)。因此,METTL3形成的m6A通过调控Activin受体mRNA翻译影响TGF-β超家族信号转导。
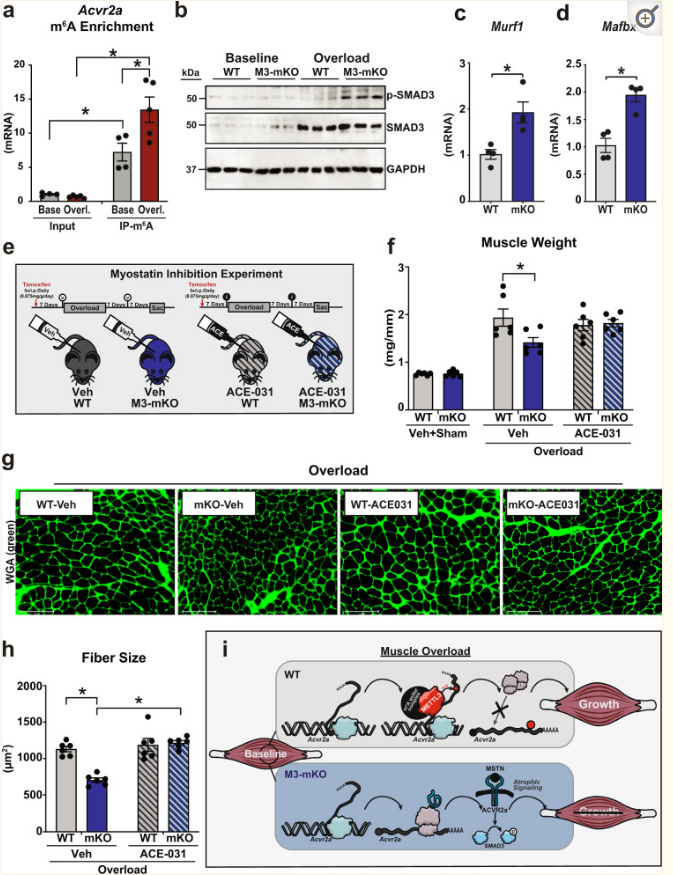
图6 METTL3通过调控Activin受体的m6A影响TGF-β超家族信号转导
METTL3 介导的 m6A 修饰对 TGF-β 超家族受体的影响突出了 METTL3 作为肌生长抑制素途径的转录后调节剂的作用。为了证明Activin受体生物学和 METTL3 依赖性肌肉质量调节之间的因果关系,施用了ACE-031,一种Activin受体配体的抑制剂(即肌肉抑制素,因为这种蛋白质是骨骼肌中这些受体的主要配体)(图7e)。联合给药肌生长抑制素抑制剂完全拯救了M3-mKO小鼠在14天的肌肉过载后观察到的受损的肥大生长,在器官水平上通过足底重量和肌纤维水平上通过横截面积评估(图7f-h)。
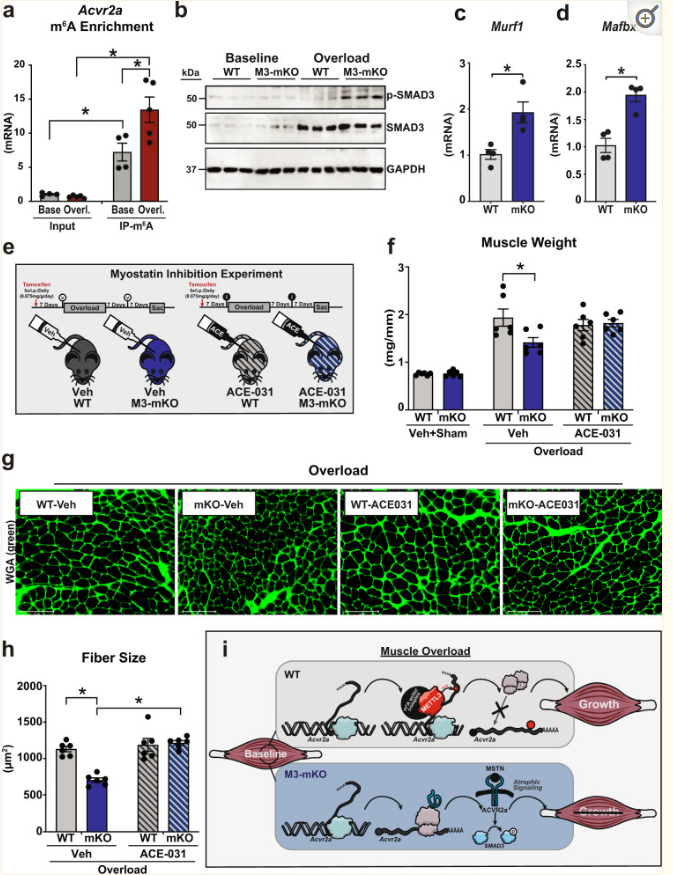
图7 METTL3-mKO小鼠的肥大缺陷被肌生长抑制素抑制剂拯救
总之,本研究表明,METTL3通过微调激活素受体翻译影响成人骨骼肌维持、肥厚性生长和功能来调节肌肉生长(图7i)。
参考文献:
Petrosino Jennifer M., Hinger Scott A., Golubeva Volha A., Barajas Juan M., Dorn Lisa E., Iyer Chitra C., Sun Hui-Lung., Arnold W David., He Chuan., Accornero Federica.(2022). The mA methyltransferase METTL3 regulates muscle maintenance and growth in mice. Nat Commun, 13(1), 168. doi:10.1038/s41467-021-27848-7






