17分生信-免疫来源的lncRNA signature
长链非编码RNA (lncRNAs)最近被认为与结直肠癌(CRC)的免疫修饰有关。然而,与免疫相关的lncRNAs的临床意义在很大程度上仍未被探索。目前,有研究构建一个免疫来源的lncRNA signature(IRLS)来改善个体结直肠癌患者的临床结果,该研究于2022年12月发表在《Nature communications》,IF:17.694。
技术路线:

主要研究结果:
1. 免疫浸润共识簇的开发和验证
该研究的总体设计如图1所示。根据单样本基因集富集分析(ssGSEA)评估的28个免疫细胞浸润,进行了共识聚类分析,其中所有CRC样本最初被分为k (k = 2.9)个聚类。一致性得分矩阵和模糊聚类(PAC)统计量的累积分布函数(CDF)曲线表明,当k = 2时,得到最优数量(图1A、B)。两个共识簇(C1和C2)显示了免疫浸润的显著差异,C2的总体浸润度明显高于C1(图1C、D)。因此,将C1定义为免疫冷肿瘤,C2定义为免疫热肿瘤。为了确保分析算法不影响两个共识聚类,使用TIMER、quanTIseq、MCP-counter、xCell、EPIC和ESTIMATE等6种算法来验证ssGSEA结果的稳定性和稳定性(图1E)。
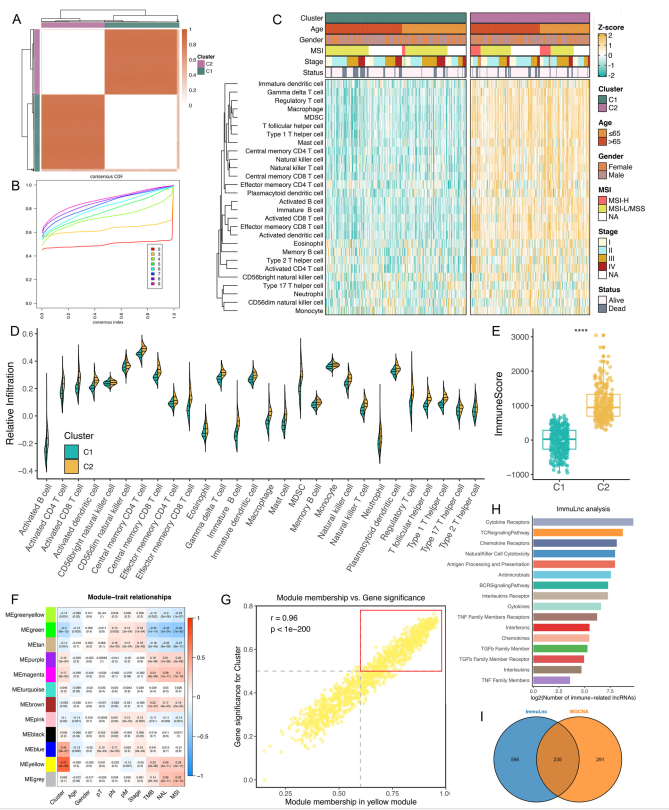
图1两种算法识别免疫相关lncRNA
2. 鉴定来自免疫浸润模式的lncRNA模块
加权相关网络分析(WGCNA)过程中,将软阈值β设为9(no scale R2 R2 = 0.910),然后,12个模块被识别,以不同的颜色表示。在模块-性状关系中,黄色模块与免疫簇之间的相关性最高(图1F)。在黄色模块中,基因显著性(GS)与模块隶属度(MM)的相关系数达到0.96,说明lncRNA模块构建质量较优(图1G)。为了鉴定来自黄色模块内免疫浸润模式的hub lncRNA, 526个lncRNAs GS > 0.5和MM > 0.6被认为是hub免疫相关lncRNA (图1 G)。
3. 免疫相关lncRNA产生于ImmLnc途径
ImmLnc系统地从lncRNA和基因表达谱中推断出免疫相关通路活性的候选lncRNA调控因子。一种假设是,如果一个特定的lncRNA在免疫调节中发挥关键作用,那么其相关基因应该富集在免疫相关通路的顶部或底部。通过ImmLnc管道,鉴定出了791个与免疫相关的lncRNA (补充数据1)。大量的lncRNA与细胞因子受体、TCR信号通路、趋化因子受体、自然杀伤细胞的细胞毒性以及抗原加工递呈通路相关(图1H)。将WGCNA结果进行交集,共提取出235个重叠lncRNA进行后续分析(图1I)。
4.综合构建一种共识特征
基于235个免疫相关lncRNA的表达谱,单因素Cox分析鉴定出43个预后相关lncRNA。对这43个lncRNA进行了基于机器学习的整合程序,以形成一致的免疫相关lncRNA特征(IRLS)。在TCGA-CRC数据集中,通过LOOCV框架拟合了101种预测模型,并进一步计算了所有验证数据集中每个模型的C-index(图2A)。最优模型是Lasso和stepwise Cox (direction = both)的组合,平均c指数最高(0.696),该组合模型在所有验证数据集中c指数领先(图2A)。在Lasso回归中,当基于LOOCV框架的偏似然偏差达到最小值时获得最佳λ(图2B)。对Lasso系数不为零的30个lncRNA进行了stepwise Cox比例风险回归,最终确定了16个lncRNA (图2C)。
接下来,通过Cox模型中16个lncRNA的回归系数加权,计算每个患者的风险评分(图2C)。所有患者根据调查包确定的最佳临界值被分为高危组和低危组。如图2D-J所示,在TCGA-CRC训练数据集和6个验证数据集中,相对于低风险组,高危组患者的总生存期(OS)明显较低(均P < 0.05)。合并所有样本的元队列也显示出同样的趋势(P < 0.05)(图2K)。
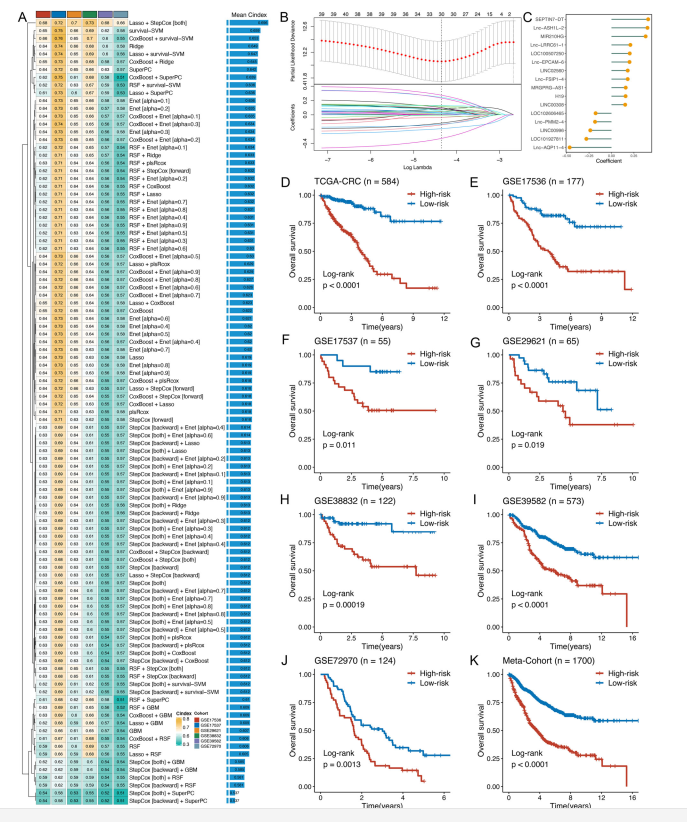
图2通过基于机器学习的集成程序开发并验证了一个共识IRLS
5. IRLS模型的评估
ROC分析测定了IRLS的鉴别度 (图3A,B)。比较IRLS与其他临床和分子变量在预测预后方面的表现。如图3C所示,IRLS的准确性明显优于年龄等其他变量:性别、T、N、M、TMB;NAL;microsatellite state;ACT;TP53、KRAS或BRAF突变(P < 0.05,除GSE29621中IRLS与AJCC期比较外)。这些结果推测出IRLS和AJCC分期的结合可能会进一步提高该模型的预测能力。
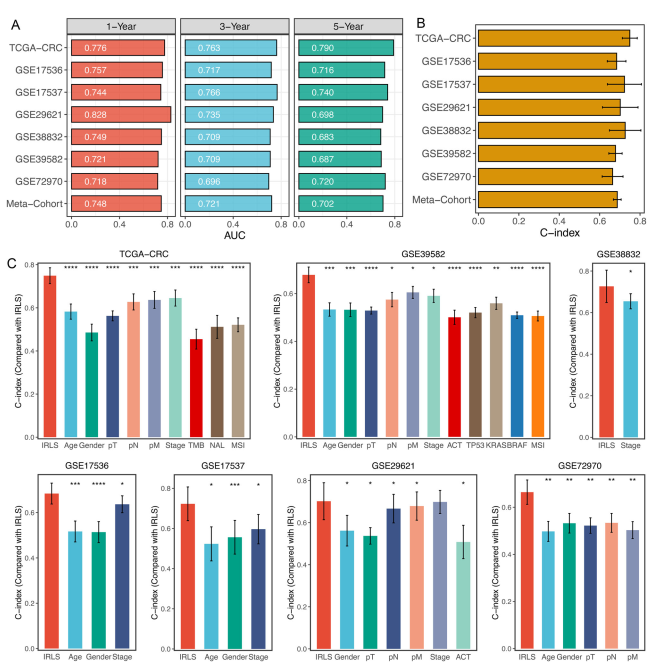
图3 IRLS模型的评估
6. 基于基因表达的CRC预后标志的比较
为了比较IRLS与其他预后特征的性能,作者全面检索了已发布的预后特征。由于GPL570注释的验证数据集中严重缺乏miRNA信息,miRNA签名被排除。最终,纳入了109个signatures (包括mRNA和lncRNA signatures)。这些signatures与各种生物学过程相关,如免疫应答、自噬、ferroptosis、干性、上皮间充质转化、toll样受体信号转导、缺氧、糖酵解、脂肪生成、维生素D、表观遗传学、n6 -甲基腺苷、衰老、WNT和药物敏感性。在所有数据集上对每个signatures进行单变量Cox回归,观察到在所有队列中只有作者的模型与预后显著相关(图4A),这证明了IRLS的稳定性。此外,将IRLS的c指数与其他signature进行比较:IRLS在每个数据集上的表现都优于几乎所有模型(图4B)。大多数模型在自己的训练数据集和少数外部数据集(如Chen-Gene, Dai-FIG)中表现良好,但在其他数据集中表现较弱(图4B)。这可能是由于过拟合所得模型的泛化性较差所致。我们的signature通过两种机器学习算法进行了降维,因此具有更好的外推潜力。
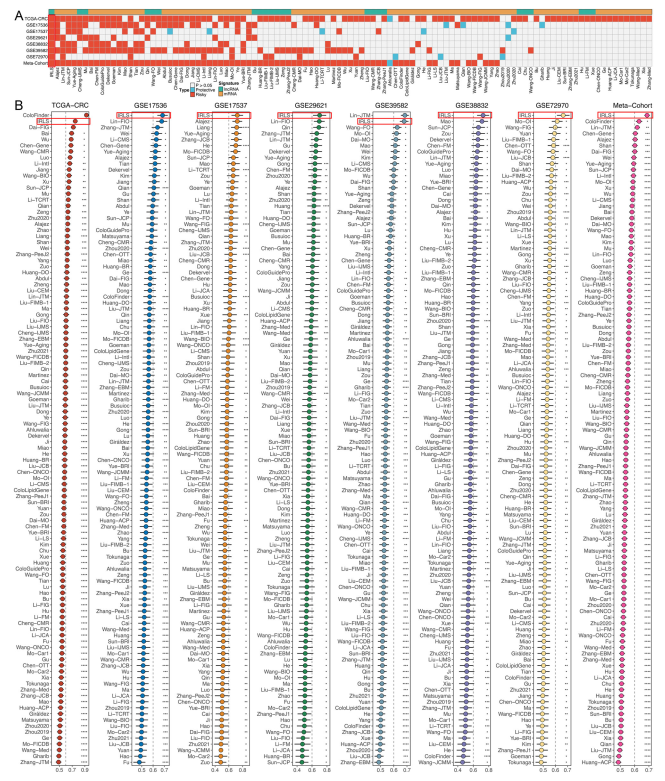
图4 CRC中基于基因表达的预后标志比较
7. 在临床内部队列中验证
为了进一步验证IRLS模型在临床中的性能,下一步通过qRT-PCR分析评估了232例CRC患者的临床队列中这些lncRNAs的表达。Kaplan-Meier分析一致表明,高IRLS患者的OS和RFS显著较差(P < 0.0001)(图5A, B)。在对混杂变量(包括年龄、性别、T分期、N分期、M分期、AJCC分期、microsatellite state、化疗、ICI治疗)进行控制后,IRLS模型对OS而非RFS仍具有统计学意义(图5C、D),这与上述结果一致。ROC分析显示IRLS具有更高的准确性:预测1、3和5年OS的AUC分别为0.840、0.776和0.818(图5E)。同样,c指数达到0.765 (95% CI = 0.691 0.839)。此外,比较了IRLS与其他临床特征的预测优势,观察到IRLS保持最佳性能(图5F)。总之,一项临床内部队列研究的结果支持我们的发现,验证并证实了IRLS模型是相当稳健的,可以作为CRC预后的独立预测因素。
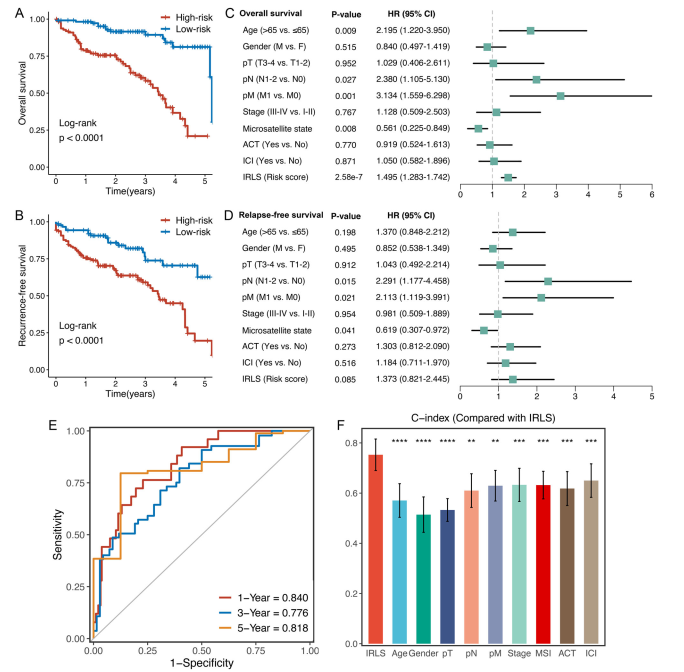
图5临床内部队列验证
8. 基于氟尿嘧啶的ACT和贝伐珠单抗受益的预测价值
越来越多的证据表明,lncRNAs与基于氟尿嘧啶的ACT和贝伐珠单抗的敏感性和耐药性有关。在此,进一步评估了IRLS对量化基于氟尿嘧啶的ACT和贝伐珠单抗疗效的预测价值。作者发现,在GSE19860、GSE28702、GSE45404、GSE69657和GSE72970中,有应答者的IRLS评分明显高于无应答者(P均< 0.05)(图6A-E)。应答者在GSE62080中有更高的IRLS趋势,但这并不显著(图6F),这可能与样本量小有关(n = 21)。ROC分析显示,IRLS可以准确预测基于氟尿嘧啶的ACT的疗效,其AUC值较高的有GSE19860(0.843)、GSE28702(0.778)、GSE45404(0.693)、GSE69657(0.765)、GSE72970(0.709)和GSE62080(0.722)(图6G-L)。同样,应答组的IRLS也更高(图6M),RLS也可以明显区分氟尿嘧啶ACT的应答者和无应答者(AUC = 0.854)(图6N)。
与单独使用基于氟尿嘧啶的ACT相比,对贝伐珠单抗敏感的患者在GSE19860 (P = 0.075)、GSE19862 (P = 0.112)和GSE72970 (P = 0.011)中表现出较低的IRLS水平(图6O-Q)。在三个独立数据集中,预测贝伐珠单抗疗效的IRLS的AUC分别为0.771、0.694和0.781(图6R-T)。这表明IRLS在贝伐珠单抗中也有良好的表现。综合来看,IRLS高的患者往往对氟尿嘧啶ACT敏感,对贝伐珠单抗耐药,而IRLS低的患者往往对贝伐珠单抗敏感,对氟尿嘧啶ACT耐药。
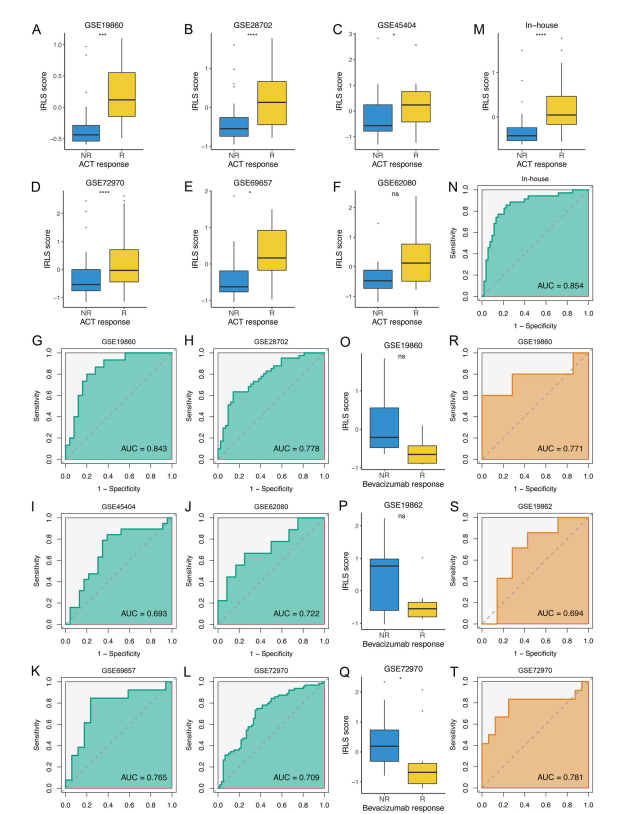
图6基于氟尿嘧啶的ACT和贝伐珠单抗疗效的预测价值
9. IRLS对ICI治疗的意义
细胞浸润分析显示,在TCGA-CRC和Meta-GEO队列中,IRLS与免疫浸润丰度呈显著负相关(图7A、B)。同样,IRLS和CD8A散点图在队列(r = 0.674,图7D)中显示出负相关。为了进一步验证CD8A蛋白在IRLS不同水平的表达,对石蜡切片进行了免疫组化。免疫组化图像和评分显示,低危组CD8A表达显著增高(图7E, F)。这表明低IRLS的患者可能拥有更多的ICI治疗后备资源。此外,IRLS也与TCGA-CRC中PD-L1的表达呈负相关(r = 0.612,图7G)和队列(r = 0.548,图7H)。在蛋白质水平上也发现了这一一致的发现(图7I, J)。IRLS能够准确预测TCGC-CRC中dMMR/M SI-H表型(AUC = 0.883)、Meta-GEO (AUC = 0.778)和内部队列(AUC = 0.794)(图7K M),这表明IRLS是microsatellite state评估的良好替代。ROC分析显示,IRLS也能明显区分派姆单抗的应答者和无应答者(AUC = 0.897),且明显优于PDL1 (AUC = 0.686, P<0.001)和CD8A (AUC = 0.725, P <0.01)表达(图7N)。
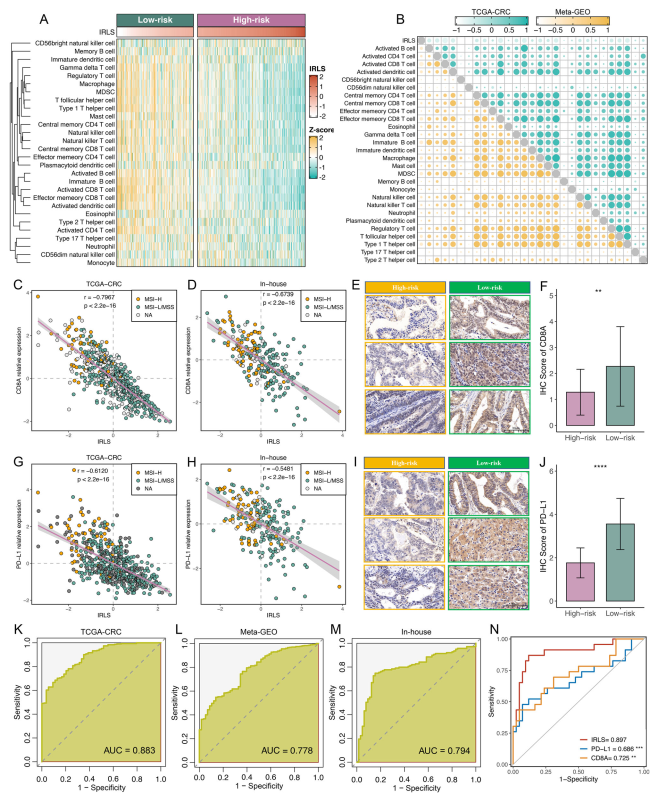
图7 IRLS对ICI治疗的意义
结论:
基于大量生物信息学和机器学习算法,作者开发了一个稳定而强大的signature,用于评估基于氟尿嘧啶的ACT、贝伐珠单抗和派姆单抗的预后、复发和益处。该IRLS模型是一个有前景的工具,可以优化单个CRC患者的决策和监测方案。
参考文献:
Liu Z, Liu L, Weng S, Guo C, Dang Q, Xu H, Wang L, Lu T, Zhang Y, Sun Z, Han X. Machine learning-based integration develops an immune-derived lncRNA signature for improving outcomes in colorectal cancer. Nat Commun. 2022;13(1):816. doi: 10.1038/s41467-022-28421-6






