CircVAPA通过调控miR - 3773p和miR - 4943p /IGF1R/AKT轴促进小细胞肺癌进展
小细胞肺癌(SCLC)是一种具有高度侵袭性和致命性的肺癌亚型,尽管化疗取得了显著进展,但SCLC患者几乎在一年内复发,预后相当差,5年生存率低于7%。多项证据表明,circRNAs (circRNAs)在各种人类癌症中发挥致癌或抑制肿瘤的作用。然而,circRNA在小细胞肺癌(SCLC)中的生物学功能仍不明确。为了阐明circRNA在SCLC肿瘤发生中的功能,对SCLC组织和SCLC患者血清中差异表达的circRNAs进行生物信息学分析。
1、 circVAPA在SCLC中的鉴定
基于之前已报道的SCLC中CircRNA表达模式和以及118名正常人和SCLC患者RNA-seq数据分析,发现circVAPA是一种显著上调的circRNA(Fig. 1A)。分析circVAPA在肺癌细胞系和人原发性SCLC组织中的表达。发现与对照组相比,3对SCLC组织中内源性circVAPA显著升高(Fig. 1C)。同样,circVAPA在SCLC细胞系中的表达明显高于NSCLC细胞系(Fig.1D),提示circVAPA是SCLC中显著上调的circRNA,值得进一步研究。DMS273和H82细胞系中circVAPA表达水平最高,于是选择了SCLC细胞系DMS273和H82进行后续实验。circBase数据库显示CircVAPA从vamp相关蛋白A (VAPA)基因的2-4外显子反剪接而来,全长338个核苷酸(nt)。 VAPA基因外显子2-4的环状化通过头尾连接形成了circVAPA。用RT-PCR验证circVAPA的存在(Fig. 1E)。RT-qPCR检测RNase R外切酶,证实circVAPA耐消化(Fig. 1F, G), 符合circRNA的特征。为了进一步评价circVAPA的稳定性,放线菌素D(一种转录抑制剂)处理实验显示,在SCLC细胞中,circVAPA比VAPA mRNA更稳定(Fig. 1H, I)。以circVAPA后接位点为靶点的FISH检测和对细胞核和细胞质RNA的qPCR分析显示,在DMS273和H82细胞中,circVAPA均在细胞质中富集(Fig. 1J, K)。
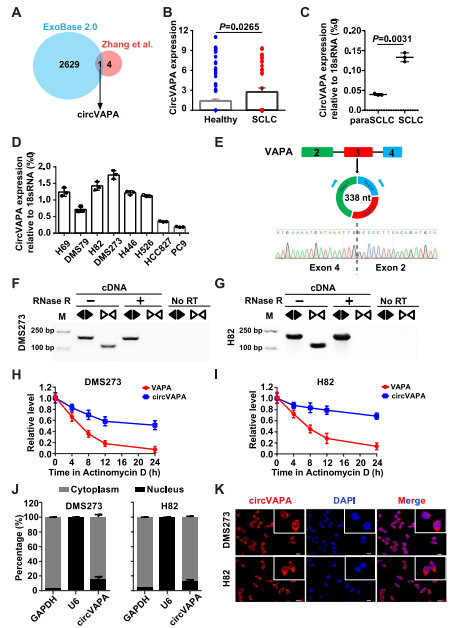
Fig1 circVAPA在SCLC中的鉴定
2、CircVAPA在体外促进SCLC进展
两个针对circVAPA后剪接位点的独立siRNA导致了SCLC细胞中circVAPA的有效沉默,而VAPA mRNA没有显著变化(Fig. 2A)。CTG荧光实验显示,circVAPA被任一siRNA敲低都会降低SCLC细胞的活力(Fig. 2B)。随后,siRNA介导的circVAPA抑制导致SCLC细胞集落形成减少(Fig. 2C)。流式细胞术分析显示,circVAPA耗尽导致SCLC细胞G0/G1周期阻滞,SCLC细胞凋亡比例增加(Fig 2D,E)。同时,WB检测的SCLC细胞中,circVAPA敲低后p21和cleaved PARP蛋白水平显著升高(Fig 2F).
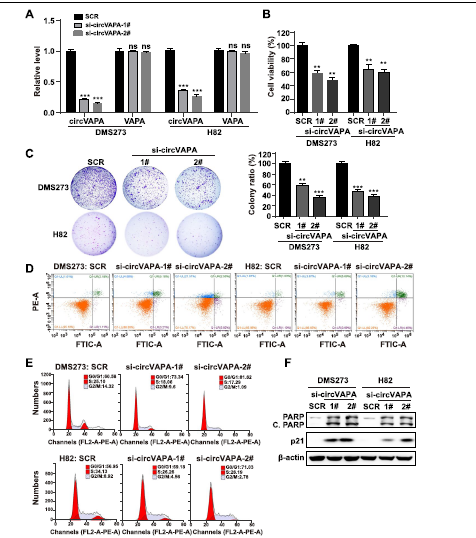
Fig 2 circVAPA干扰抑制SCLC细胞集落形成
3、CircVAPA在体外促进SCLC进展
此外,作者构建了过表达的circVAPA (OE-circVAPA)。如图3A所示,OE-circVAPA显著增加了circVAPA的表达,且没有改变SCLC细胞中VAPA mRNA水平的变化。与circVAPA沉默的效果相反,过表达circVAPA有助于SCLC细胞的细胞活力、集散形成和细胞周期进程的增加,凋亡细胞比例和p21和cleaved PARP蛋白水平的降低(Fig 3B-F)。总的来说,作者的结果得出的结论是,circVAPA促进了体外SCLC进展。
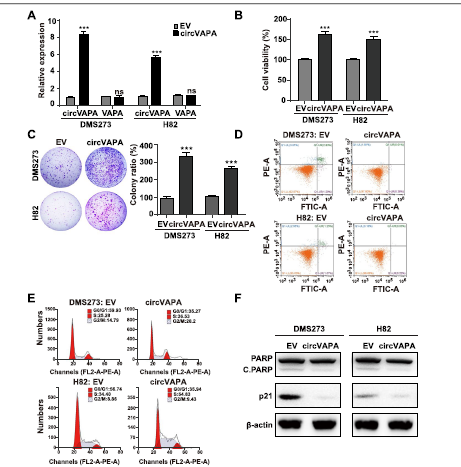
Fig 3 CircVAPA在体外促进SCLC进展
4、CircVAPA是miR - 3773p和miR - 4943p的海绵
采用Ago2 RNA免疫沉淀(RIP)验证circVAPA在DMS273细胞中的结合(Fig 4A)。RIP实验证实Ago2与circVAPA和circHIPK3(阳性对照)直接结合,而与EIciPAIP2(阴性对照)不结合(Fig 4B)。
然后作者使用了CircInteractome来预测circVAPA假定的miRNA结合位点。如图4C所示,circVAPA序列中预测了14个假定的miRNA结合位点,其中,miR-494-3p有两个潜在的结合位点。然后,合成了circVAPA连接位点反义的生物素标记的寡核苷酸探针,并进行RNA下拉实验,进一步证明miRNA-circVAPA可能存在相互作用(Fig. 4D)。与对照探针相比,反义探针能够有效且精确地捕获内源性circVAPA,并下拉的miR-377-3p和miR-494-3p,但没有其他12种预测miRNAs(Fig. 4E)。此外,Ago2 RIP的RT-qPCR分析表明,在DMS273细胞中,miR-377-3p或miR-494-3p与相应的mimic过表达后,circVAPA富集显著(Fig. 4F)。此外,作者构建了荧光素酶报告基因质粒,将circVAPA的线性序列或假设的miR-377-3p或miR-494-3p结合位点突变的序列融合到荧光素酶的3 ' UTR上。双荧光素酶报告基因实验验证了293T细胞中circVAPA与miR-377-3p/miR-494-3p的直接结合(Fig. 4G)。值得注意的是,circVAPA中两个假定的miR-494-3p结合位点对它们的相互作用都是必需的(Fig. 4G)。在siRNA介导的circVAPA敲低后,DMS273和H82细胞中miR-377-3p和miR-494-3p的表达水平显著升高,而circVAPA过表达导致miR-377-3p和miR-494-3p的水平下降(Fig.4)。
重要的是,作者证明了抑制miR-circVAPA衰竭细胞中的377-3p或miR-494-3p可以挽救circVAPA敲低对DMS273和H82细胞活力和集落形成的抑制作用(Fig. 4H, I)。相反,miR-377-3p或miR-494-3p过表达消除了circVAPA过表达对DMS273和H82细胞活力和集落形成的促进作用(Fig.4J, K)。这些结果表明,circVAPA在SCLC细胞中充当了miR-377-3p和miR-494-3p的分子海绵。377-3p或miR-494-3p过表达消除了circVAPA的促进作用。
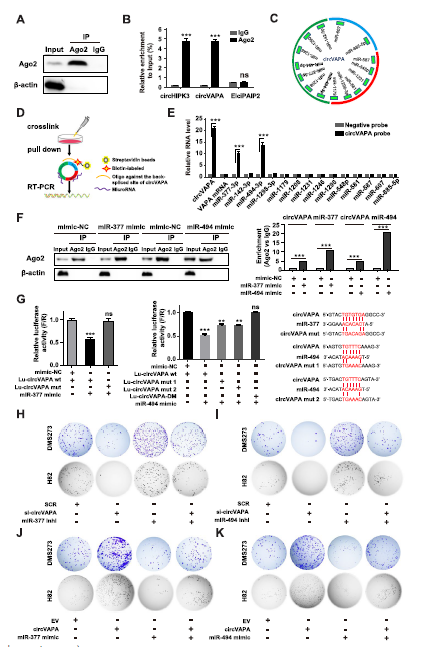
Fig4 CircVAPA是miR - 3773p和miR - 4943p的海绵
5、IGF1R是miR - 3773p和miR - 4943p的功能靶标
由于circVAPA可以作为ceRNA作用于miR-377-3p和miR-494-3p,作者开始确定miRNA的下游靶点。通过两个数据库对miR-377-3p和miR-494-3p的潜在靶点进行预测,发现miR-377-3p和miR-494-3p共享41个共同候选基因(Fig. 5A)。对数据集(GSE149507)和41个常见候选SCLC中显著上调的靶基因进行整合分析,最终聚焦于10个潜在靶基因。IGF1R是SCLC中不可或缺的角色,进一步证实发现它是miR-377-3p和miR-494-3p的唯一共同靶点,转染miR-377-3p/miR-494-3p模拟物和抑制剂。通过双荧光素酶报告基因实验,作者进一步揭示了miR-377-3p/miR-494-3p在分子水平与野生型IGF1R mRNA结合,但在293T细胞中miR-377-3p/miR-494-3p的假设结合位点未与携带突变的IGF1R mRNA结合(Fig. 5B, C)。值得注意的是,只有位点2挽救了miR-494-3p诱导的荧光素酶活性抑制作用(Fig.5C)。接下来,作者检测了miR-377-3p/miR-494-3p和IGF1R的表达,SCLC临床标本中发现miR-377-3p/miR-与paraSCLC相比,SCLC中494-3p均下调,而IGF1R mRNA则呈现相反趋势(Fig.5D, E)。
此外,沉默miR -377-3p/miR-494-3p及其相应的抑制剂在mRNA和蛋白水平上显著提高了DMS273和H82细胞中IGF1R的表达(Fig.5F, H和Fig.6A)。相反,miR-377-3p和miR-494-3p及其模拟物过表达显著降低了SCLC细胞中IGF1R的mRNA和蛋白水平(Fig.5G、I,Fig.6B)。这些结果表明,IGF1R是miR-377-3p和miR-494-3p的直接和功能靶点。
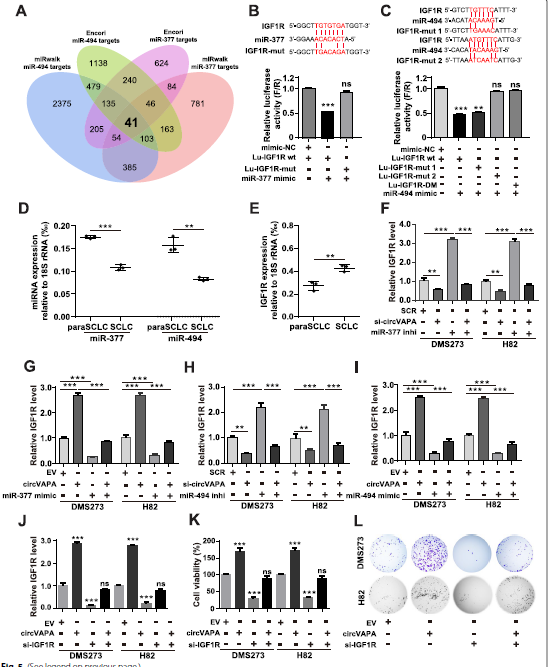
Fig 5 IGF1R是miR-377-3p和miR-494-3p的直接和功能靶点。
6、CircVAPA通过miR - 3773p & miR - 4943p /IGF1R/AKT轴促进SCLC细胞活力
为了检测circVAPA是否作为靶向miR-377-3p和miR-494-3p的ceRNA来调控IGF1R的表达水平,作者采用双荧光素酶报告基因实验来评估circVAPA与miR-377-3p和miR-494-3p以及IGF1R之间的相互作用。结果发现,异位circVAPA过表达逆转了miR-377-3p和miR-494-3p过表达对荧光素酶活性的抑制,表明在circVAPA作为ceRNA对抗miR-377-3p和miR-494-3p,解除对IGF1R表达的抑制(Fig. 6E)。
接下来探索circVAPA是否通过miR-377-3p和miR-494-3p/IGF1R轴调控PI3K/AKT信号通路,促进SCLC进展。首先,作者证明了S6核糖体蛋白(p-S6RP) ,miR-377-3p或miR-494-3p抑制剂可以挽救IGF1R及其下游靶点磷酸化AKT (p-AKT)和磷酸化的S6核糖体蛋白(p-S6RP) 的mRNA和蛋白水平的下降(Fig. 5F, H,Fig. 6A)。值得注意的是,根据作者之前报道的研究,在H82细胞中,p-AKT水平太低,无法通过western blot检测到。相反,circVAPA对IGF1R mRNA、IGF1R蛋白、p-AKT和p-S6RP蛋白表达的促进作用可以被miR-377-3p或miR-494-3p模拟物消除(Fig. 5G, I ,Fig. 6B)。重要的是,IGF1R已被证明是一个潜在的靶点,并抑制IGF1R在SCLC细胞中表达,表现出良好的抗肿瘤作用。通过siRNA或BMS-536924抑制IGF1R抑制剂,能恢复circvapa诱导的细胞活力、集散形成、IGF1R mRNA以及IGF1R、p-AKT和p-S6RP的蛋白水平(Fig. 5J-L, Fig. 6C, D)。 IHC染色显示,与paraSCLC相比,SCLC中IGF1R和p-AKT蛋白水平均上调(Fig. 6F, G)。综合这些结果表明,circVAPA通过隔离miR-377-3p和miR-494-3p激活IGF1R/AKT轴促进SCLC细胞活力和集合体形成。
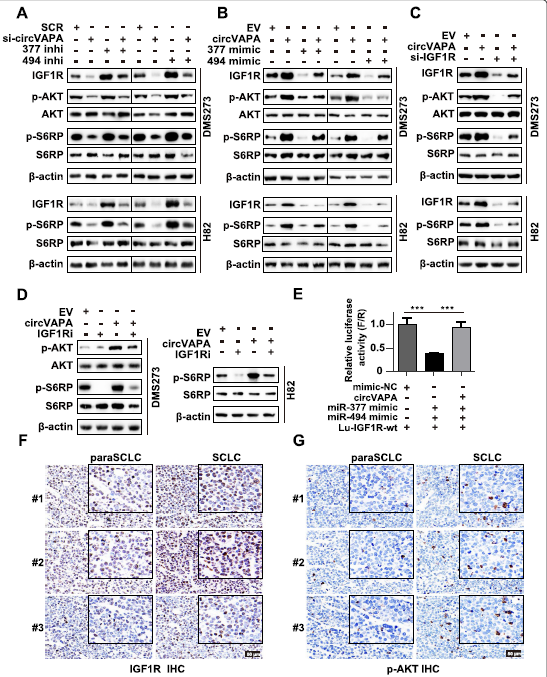
Fig6 CircVAPA通过miR - 3773p & miR - 4943p /IGF1R/AKT轴促进SCLC细胞活力
7、CircVAPA通过调控IGF1R在体内和体外促进SCLC增殖
BMS-536924,一种靶向IGF1R的小分子抑制剂,已被证实可以抑制IGF1R磷酸化并阻断IGF1R介导的AKT信号级联。添加BMS-536924可以减弱p-AKT和p-S6RP蛋白的表达,但这种对AKT信号级联的负调控在circVAPA过表达时减弱(Fig 6d)。此外,作者用慢病毒shRNA建立了DMS273稳定细胞系来沉默circVAPA。添加BMS-536924或抑制circVAPA的处理对AKT信号级联的降低显示出中等的影响,而两者的联合处理显示出最大的抑制效果(Fig. 7A)。为了支持WB结果,单独添加BMS-536924或沉默circVAPA对DMS273和H82的细胞活力和克隆形成有明显的阻断作用(Fig. 7B, C)。然而,联合使用BMS-536924处理和减少circVAPA对DMS273和H82的细胞活力和克隆形成有最大的抑制作用(Fig.7B, C)。
为了探讨circVAP在SCLC体内的生物学功能,然后作者进行皮下注射circVAPA敲除和对照DMS273细胞裸鼠,以研究circVAPA在体内的作用。与对照组相比,circVAPA稳定敲除的细胞形成的肿瘤体积、体积和重量都明显更小(Fig.7D-F)。免疫组化染色显示,与对照组相比,来自circVAPA稳定敲低的细胞的肿瘤中Ki67、IGF1R、p-AKT水平显著降低 (Fig.7G)。IGF1R抑制剂BMS-536924在体外表现出增强了circVAPA沉默引起的对细胞活力、集散形成、p-AKT和p-S6RP的抑制作用,以及体内肿瘤大小、体积和重量的抑制作用,表明BMS-536924和circVAPA损耗可能在SCLC治疗中实现潜在的协同作用(Fig.7A-G)。这些结果表明,在体内,circVAPA通过靶向IGF1R,促进SCLC增殖体内。

Fig7 CircVAPA通过调控IGF1R在体内和体外促进SCLC增殖
总之,本研究提出circVAPA/miR-377-3p和miR-494-3p/IGF1R/AKT轴可能是SCLC的一个有效治疗靶点,为SCLC进展的机制提供新的见解。






