空间代谢组——脂质组:16.2高分揭示二级保护动物洞穴鱼的脂质代谢进化
Sinocyclocheilus 是中国特有的稀有淡水硬骨鱼属,包括河栖的地表鱼和洞穴鱼。利用定量脂质组和空间质谱图像(MSI)相结合的方法,本文发现脂质分布和脂质代谢的神经区隔化与Sinocyclocheilus的进化有关。本研究于2022年4月发表在《Molecular Biology and Evolution》IF:16.240。
技术路线:

主要研究内容:
1、洞穴鱼脑内氧化磷酸化增加
2016年至2018年在云南省昆明市附近野外捕获Sinocyclocheilus (2020年被申报为国家二级保护动物)。在南盘江沿岸的一个洞穴中发现了洞穴鱼品种 S. anophthalmus,而在黄泥河沿岸发现了地表鱼品种S. anophthalmus(图1A)。利用之前发表的全脑转录组数据,使用GSEA来研究这两个物种之间KEGG通路的差异。GSEA显示洞穴鱼脑内花生四烯酸(ARA)代谢和氧化磷酸化较地表鱼明显增强(图1B)。然后分析了两个品种的整个脑的脂质组,PCA显示洞穴鱼和地表鱼的脑脂质组明显区分开(图1C)。主要脂类的聚类热图显示在地表鱼的大脑中复杂的糖鞘脂丰度显著升高(图1D)。为探究脂质相关性的整体改变,对洞穴鱼和地表鱼的全脑脂质组进行脂质相关性分析。如图1E所示,两个品种鱼的脂质关联发生明显改变。
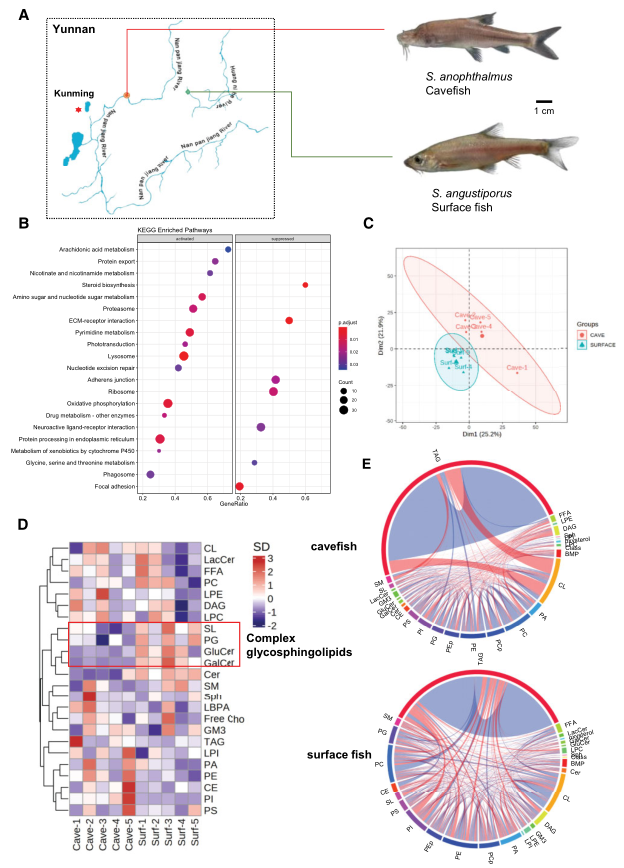
图1洞穴鱼和地表鱼全脑转录组和脂质组的变化
2、洞穴鱼和地表鱼的神经元表现出相反的DHA和ARA模式
脑切片根据其沿纵轴的位置分为四个主要脑区,即端脑(Tel)、视顶盖(TeO)、小脑(CC)和延髓(MO)。硬骨动物血清素能神经元主要分布在后脑中缝核和位于前脑的三个下丘脑核中,而哺乳动物中不存在下丘脑核(图2A)。定量脂质组揭示了地表鱼的整个大脑的四个区域中含有的ARAs膜磷脂都少于洞穴鱼(图2B-2C)。洞穴鱼中富集的ARAs膜磷脂和前面GSEA的结果,表明ARA代谢增强。相反,其他脂类表现出区域特异性变化,这只有在区域特异性脂质体组学中才变得明显。例如,洞穴鱼的TeO和CC中的酰基肉碱水平与地表鱼相比明显升高(图2C-2D)。有趣的是,与ARA相反,洞穴鱼的TeO和CC中的自由二十二碳六烯酸(DHA)水平比地表鱼显著降低(图2D)。与表面鱼相比,洞穴鱼的 TeO 和 CC 区域的主要 DHA 磷脂(包括 PC 38:6、PC 40:6 和 PE 40:6)也减少了。
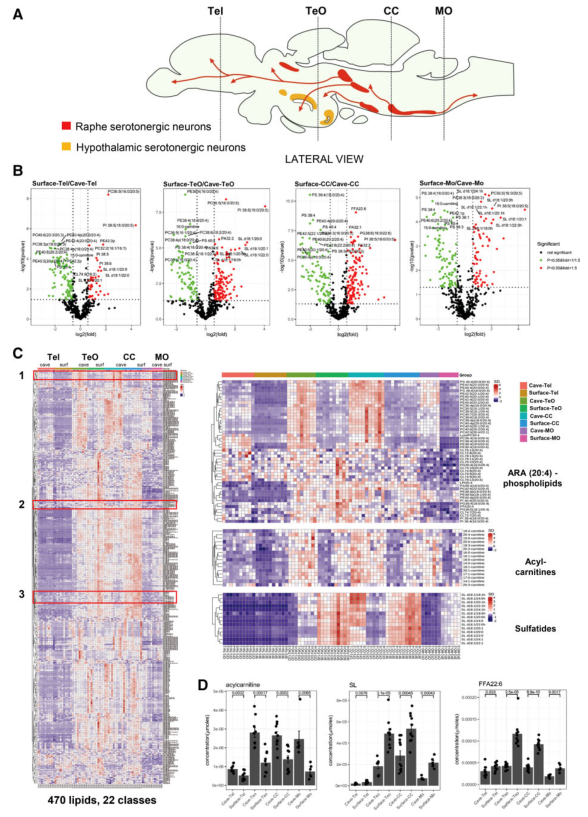
图2 洞穴鱼和地表鱼四个脑区脂质的区域特异性变化
定量脂质组学、MSI的脑切片说明 ARA 磷脂,例如 PC 36:4 和 PC 38:4(磷脂酰胆碱,PCs)在 TeO、CC 和 MO 地区的洞穴鱼切片中持续增加(图3)。另一方面,洞穴鱼体内的DHA磷脂,如PC 40:6、PC 38:6和PE 40:6,与地表鱼相比明显减少(图3)。事实上,敲除一个主要的助推超家族成员,Mfsd2a,被证明是DHA通过血脑屏障进入小鼠大脑的转运体,导致小脑中的浦kinje细胞大量丢失(图3)。因此,DHA可能对地表鱼的小脑功能至关重要,而这在洞穴鱼的进化中可能不那么重要了。相对于洞穴鱼,DHA -磷脂的富集延伸到地表鱼的眼睛和肝脏,在地表鱼中,DHA-PCs 的显着簇含量较高(图4)。至于 ARA 磷脂,它们在洞穴鱼中的富集位于退化视叶的脑室周围灰色区域(图3)。

图3洞穴鱼和地表鱼四个脑区脂质空间分布的质谱成像
ARA-相对于 DHA-磷脂的优先积累也在洞穴鱼的全眼和全肝样本中得到验证,相对于它们的表面栖息对应物(图4)。ARA包含的磷脂,包括磷脂酰丝氨酸PS 38:4(18:0_20:4)和磷脂酰肌醇PI36:4(16:0_20:4) 都是最显著不同的脂质,其在洞穴鱼眼(CE)中含量高于表面鱼眼(SE)(图4A)。在洞穴鱼的眼睛和肝脏中,与地表鱼相比,ARA-PC 簇明显富集(图4C)。

图4洞穴鱼和地表鱼全眼和全肝脂质的变化
3、穴居鱼的中缝血清素激活的神经元发生脱髓鞘
基于区域特异性脂质组学,注意到,相对于洞穴鱼,地表鱼的TeO、CC和MO区域的硫化物(SLs)显著升高(图2B-D)。MSI 显示,表层鱼 TeO中的 SL 富集(SL t42:1、SL t44:1)位于后结节,富含来自上中缝血清素能群体的神经元投射(图 3)。相比之下,相比之下,横穿下丘脑血清素能神经元的 TeO 切片的脑室周围下丘脑背侧区没有可观察到的 SL 信号,而是富含 DHA 磷脂(PE40:6、PC 40:6 和 PC 38:6)(图 3)。同样,在地表鱼相对于洞穴鱼的CC和MO切片的中间网状结构区域观察到 SL 富集(图 3),其中富含下缝血清素能神经元的投射。髓磷脂分布的免疫染色,即髓磷脂碱性蛋白的红色荧光信号与 MSI 数据一致。髓磷脂分布在空间上与SL信号重叠,对应于CC中下缝血清素能神经元和 TeO 上中缝血清素能神经元,但在含有下丘脑血清素能神经元的背侧脑室周围下丘脑中没有。然后,通过使用TEM对轴突髓鞘形成成像来验证基于脂质组学和免疫染色的观察结果(图 5)。作者选择后脑CC区域做TEM,因为该区域主要包含下中缝血清素能神经支配,而不是下丘脑血清素能神经支配。来自CC区域的代表性TEM图像显示,相对于洞穴鱼,在地表鱼视野中捕获的单个轴突周围有更多的髓鞘(图 5A),以及较大的轴突周围的髓鞘厚度更大(图 5B和5C)。因此,基于MSI、免疫染色和TEM图像检查髓鞘形成程度,相对于洞穴鱼,其似乎主要在地表鱼后脑区域的中缝血清素能神经元群体的髓鞘化程度更高。洞穴鱼的中缝血清素能神经元在其进化过程中可能经历了明显的脱髓鞘。免疫染色也显示,与地表鱼相比,洞穴鱼在 TeO 和 CC 区域具有更高水平的 5-HT 受体 4 (5-HTR4)(绿色荧光)(图5D)。这些研究结果表明,相对于表面鱼类,洞穴鱼在它们的中缝血清素能神经元中特别发生脱髓鞘,但在下丘脑血清素能神经元中没有。
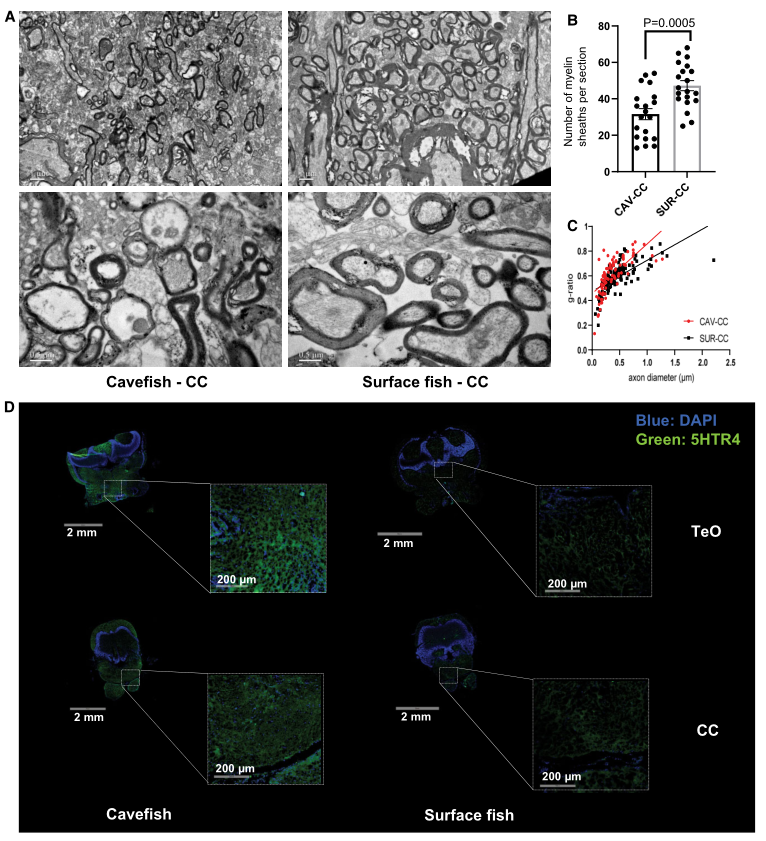
4、鱼类大脑和肝脏中环境特异性代谢适应的基因表达
对洞穴鱼的大脑、眼睛和肝脏与表面鱼类的脂质组学研究中,发现两种鱼类之间脂质代谢的四个本质差异,这可能与它们不同栖息地的不同选择压力有关。相对于地表鱼类,洞穴鱼表现出 1) 大脑中的氧化磷酸化增强; 2) DHA-磷脂在大脑、眼睛和肝脏中优先于ARA-磷脂的积累; 3) 脂肪(以储存 TAG 的形式)和缩醛磷脂 PC 在肝脏中的积累; (4) 后脑中缝血清素能神经元的选择性脱髓鞘作用。
为了阐明洞穴鱼和表面鱼之间差异脂质代谢的候选基因,检测了大脑和肝脏中几个在 DHA 生物合成、摄取和磷脂重塑、脂肪动员、线粒体和过氧化物酶体β-氧化以及 plamalogen 途径的基因表达。如图6的qRT-PCR 显示,在大脑中,DHA 生物合成途径的fads2的表达在地表鱼中显着高于洞穴鱼,但对于Sprecher途径上的其他基因(elovl2、elovl5 、mfsd2a和acox1)则不然。相比之下,虽然洞穴鱼和地表鱼的肝脏中 fads2 的水平没有显着差异,但与洞穴鱼相比,地表鱼肝脏中的 Sprecher 途径的其他基因(elovl2、elovl5 和 acox1)显着升高。 根据结果,地表鱼似乎通过 Δ4 去饱和酶途径增加大脑中的 DHA 生物合成,但依赖于 Sprecher 途径来增强肝脏中的 DHA 生物合成。 此外,介导DHA从体循环吸收到大脑的mfsd2a水平在洞穴鱼和水面鱼之间没有显着差异。因此,地表鱼可能保留了局部的 DHA 神经供应来维持关键的大脑功能,而不是依赖于从体循环中摄取 DHA。
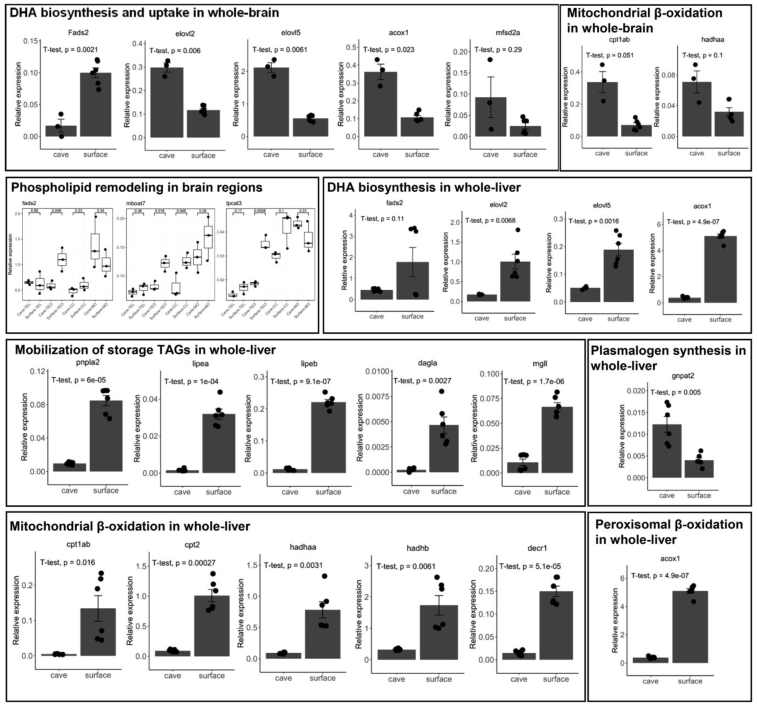
图6洞穴鱼和水面鱼对不同栖息地代谢适应的大脑和肝脏基因的mRNA表达
图7的示意图总结了洞穴鱼和地表鱼大脑和肝脏中主要的差异代谢途径,揭示了它们对不同环境的代谢适应。除了大脑,洞穴鱼肝脏中的DHA脂质也经历了类似的减少——肝脏是控制全身脂质代谢的关键器官。与大脑相比,洞穴鱼肝脏中 DHA 生物合成的减少是由于沿 Sprecher 通路的流动减弱所致(图 7)。这一观察表明,DHA 生物合成能力的丧失可能在大脑之外具有进化意义。

图7通过脂质组学和qRT-PCR,该示意图总结了洞穴鱼和地表鱼大脑和肝脏中主要的代谢途径,揭示了它们对不同环境的代谢适应
参考文献:
Lam Sin Man., Li Jie., Sun Huan., Mao Weining., Lu Zongmin., Zhao Qingshuo., Han Chao., Gong Xia., Jiang Binhua., Chua Gek Huey., Zhao Zhenwen., Meng Fanwei., Shui Guanghou.(2022). Quantitative Lipidomics and Spatial MS-Imaging Uncovered Neurological and Systemic Lipid Metabolic Pathways Underlying Troglomorphic Adaptations in Cave-Dwelling Fish. Mol Biol Evol, 39(4), undefined. doi:10.1093/molbev/msac050






