ALKBH5通过m6A-YTHDF2依赖性方式影响骨肉瘤的发展
m6A是最常见和最丰富的mRNA修饰,在许多生物过程中起着至关重要的作用。然而,作为一种关键的RNA去甲基酶,ALKBH5在人类骨肉瘤中的研究尚不充分。本研究旨在探讨ALKBH5介导的m6A修饰及其在骨肉瘤中的潜在机制。我们的数据表明,ALKBH5的低表达与骨肉瘤患者的总体生存率较差相关。通过ALKBH5上调降低人骨肉瘤细胞中m6A mRNA水平导致细胞增殖抑制、细胞凋亡和周期阻滞。我们发现STAT3的负调控因子SOCS3是ALKBH5介导的m6A修饰的下游靶点。而m6A修饰的SOCS3 mRNA被YTHDF2识别,促进SOCS3的衰变。从机制上讲,ALKBH5通过m6A-YTHDF2依赖性方式增加SOCS3表达,从而使STAT3途径失活。本文于2022年发表在 “eBioMedicine”(IF=11.205)上。
技术路线

结果
1)ALKBH5在骨肉瘤中的表达及其与患者生存的关系
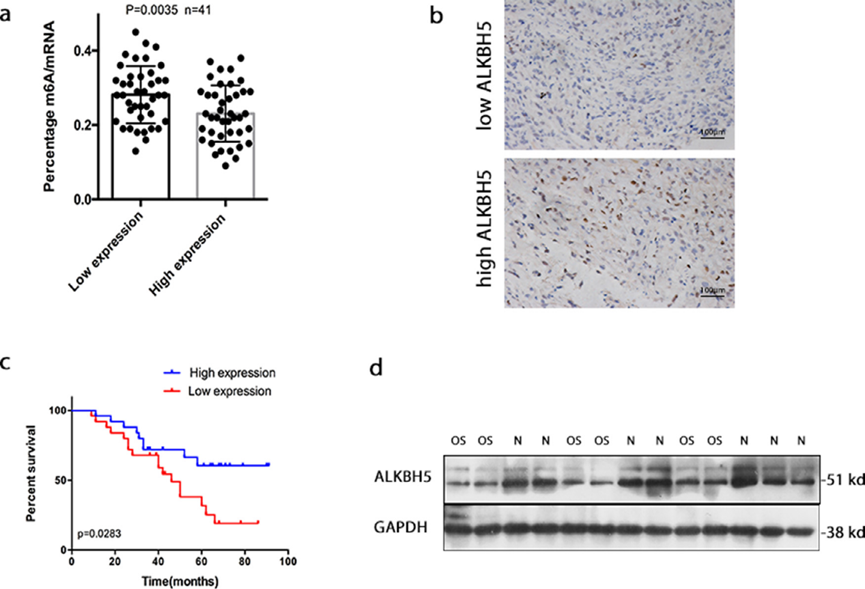
我们的数据验证了ALKBH5与人类OS(骨肉瘤)总生存率之间的负相关。根据ALKBH5 mRNA相对表达的中位数,OS组分为高表达组和低表达组。所有患者术前均未接受抗肿瘤治疗。如图1a所示,与低ALKBH5组相比,高ALKBH5肿瘤组织的m6A总甲基化水平较低。通过免疫组织化学染色进一步评估ALKBH5的表达水平。图1b显示了ALKBH5染色的代表性高表达或低表达图像。我们研究了ALKBH5表达与骨肉瘤患者预后之间的相关性。Kaplan-Meier生存分析表明,低ALKBH5表达患者的总生存时间明显短于高ALKBH5表达患者(图1c)。此外,对取自正常骨和骨肉瘤组织的15个样本进行了western bolt分析。在两种组织中均检测到ALKBH5的表达,但与正常骨相比,骨肉瘤中的表达显著降低(图1d)。
2)ALKBH5介导的m6A甲基化减少抑制骨肉瘤细胞生长并促进细胞凋亡
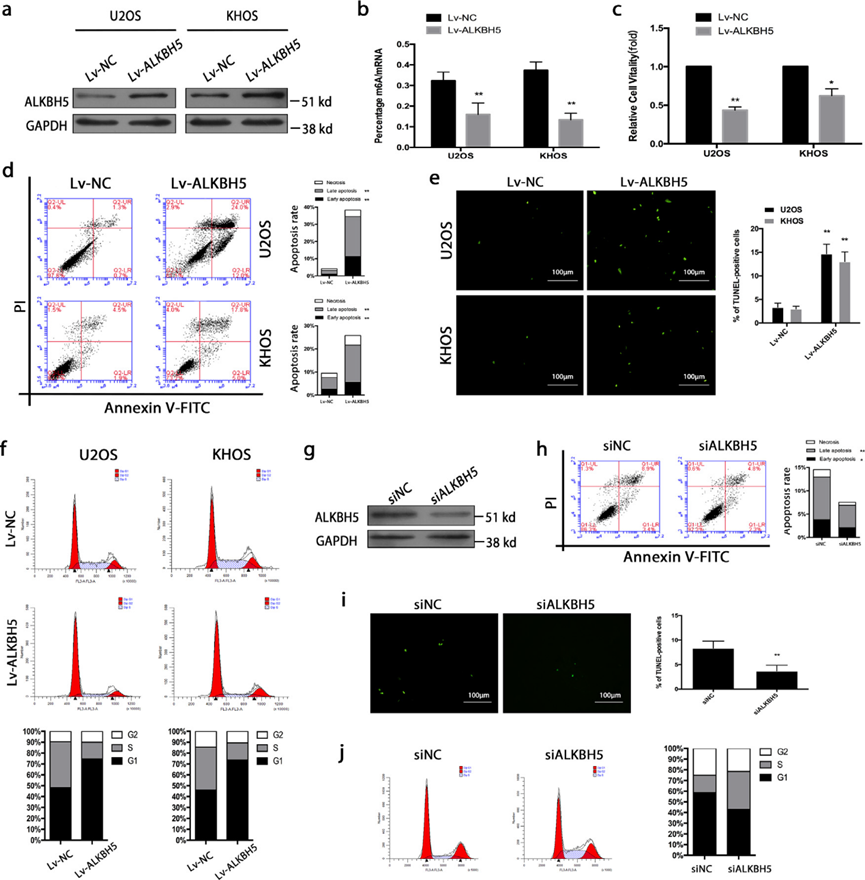
为了探索ALKBH5介导的U2OS和KHOS细胞系中m6A甲基化的影响,我们使用慢病毒转染上调ALKBH5,并且通过western blot证实ALKBH5过表达(图2a)。ALKBH5上调细胞表现出m6A mRNA甲基化减少(图2b)。在功能上,ALKBH5的过表达抑制细胞增殖,诱导细胞周期阻滞并促进细胞凋亡。通过CKK-8测定观察到细胞活力降低(图2c)。流式细胞术在这两种细胞系中观察到大量凋亡(图2d)。进行TUNEL染色以确认诱导细胞凋亡(图2e)。我们的细胞周期分析表明,骨肉瘤细胞大多在G0/G1期停滞,这意味着在过表达ALKBH5后分裂的肿瘤细胞数量减少(图2f)。为了更好地了解ALKBH5在骨肉瘤中的作用,我们还对KHOS细胞系进行了敲除实验。使用SiRNA下调ALKBH5,并通过western blot证实ALKBH5下调(图2g)。进行流式细胞术(图2h)和TUNEL(图2i)分析,确认由ALKBH5下调引起的细胞凋亡减少。细胞周期分析(图2j)表明,在敲除ALKBH5后,分裂的肿瘤细胞数量增加。
3)RNA测序鉴定骨肉瘤甲基化改变的转录本
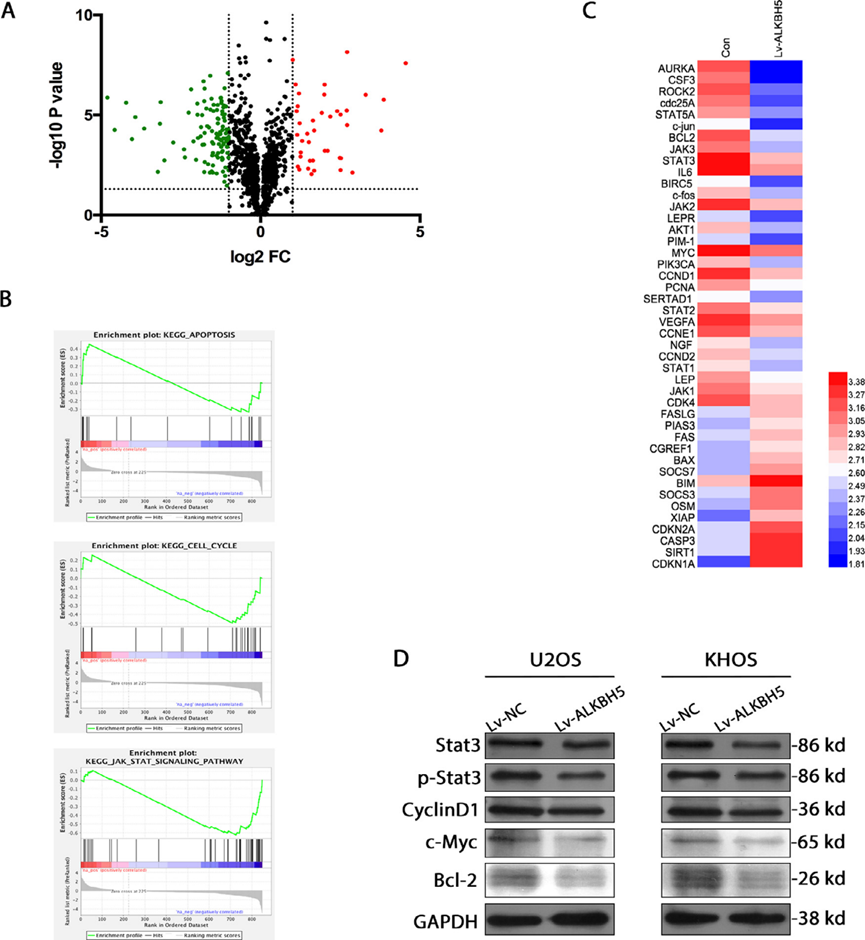
我们对ALKBH5过表达的KHOS细胞进行了RNA测序,结果表明,相对于conrtols,转录物的表达发生了改变(图3a)。基因集富集分析表明,差异表达基因与细胞增殖、细胞周期和凋亡密切相关。我们还发现,骨肉瘤细胞系中m6A甲基化的降低显著改变了STAT3信号通路(图3b,c)。我们接下来通过研究STAT3的磷酸化状态来确定骨肉瘤细胞中m6A甲基化的减少是否影响STAT3信号。与对照细胞系相比,ALKBH5过表达细胞系显示STAT3的磷酸化水平降低(图3d)。为了弄清楚STAT3磷酸化的这些变化是否刺激STAT3信号传导,我们评估了STAT3下游靶点的表达水平。与对照组相比,CyclinD1、c-Myc和bcl-2在细胞中的活性降低。这些结果表明,减少m6A甲基化可使STAT3途径失活。
4)m6A甲基化调节STAT3激活调节因子的表达
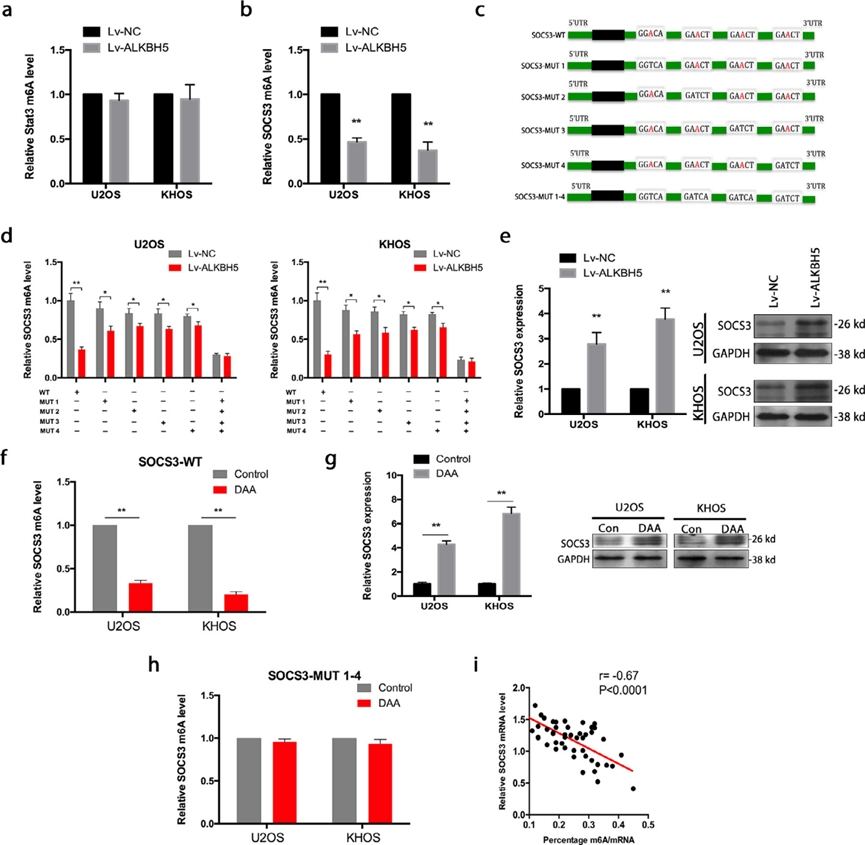
在ALKBH5过表达后,STAT3 m6A修饰没有明显影响(图4a),这表明STAT3可能不是骨肉瘤中ALKBH5的直接靶点。为了确定STAT3调控m6A甲基化的潜在机制,我们检测了STAT3的负调节因子SOCS3。我们在U2OS和KHOS细胞中过表达ALKBH5。在ALKBH5过表达后,SOCS3 m6A修饰减少(图4b)。通过分析已发布的m6A序列数据集(GSE37005),我们发现SOCS3 mRNA 3’ UTR具有高度富集和特异的m6A峰,并在RMBase v2.0中识别出SOCS3-3’UTR的四个m6A位点。我们在SOCS3中的四个假定m6A位点(A到T)进行突变,表示为SOCS3MUT:SOCS3-MUT1、SOCS3-MUT2、SOCS3-MUT3、SOCS3-MUT4(仅包含一个潜在m6A位点)和SOCS3-MUT1-4(包含所有四个潜在m6A位点)(图4c)。然后,我们使用MeRIP-qPCR检测了SOCS3-WT和SOCS3 MUT中的m6A修饰水平。与ALKBH5的对照载体相比,ALKBH5减少了骨肉瘤细胞中SOCS3-WT、SOCS3-MUT1、SOCS3-MUT2、SOCS3-MUT3和SOCS3-MUT4的m6A修饰。然而,由于m6A位点突变的存在,与SOCS3-WT相比,SOCS3 MUT(仅包含一个潜在m6A位点)中m6A修饰的减少程度受到抑制。在ALKBH5过表达的U2OS和KHOS细胞中,SOCS3-MUT1-4的m6A修饰(包含所有四个潜在的m6A位点突变)没有减少(图4d)。基于RT-qPCR,当ALKBH5在U2OS和KHOS细胞中过表达时,SOCS3表达升高(图4e)。此外,我们发现,当用3-脱氮腺苷(DAA)处理时,骨肉瘤细胞的SOCS3 m6A修饰水平降低(图4f)。同时,SOCS3表达显著增强(图4g)。但在SOCS3-MUT1-4中未检测到DAA引起的m6A修饰减少(图4h)。我们还检测到骨肉瘤组织中m6A甲基化和SOCS3表达之间存在线性相关性(图4i)。DAA是一种非选择性药物,可以全局改变转录物的甲基化。该甲基化抑制剂用于验证ALKBH5介导的m6A对SOCS3 mRNA稳定性的影响。
5)ALKBH5的过表达通过m6A-YTHDF2依赖机制增强SOCS3 mRNA的稳定性
我们推测SOCS3转录物是YTHDF2的靶点。为了检测YTHDF2是否直接结合SOCS3 mRNA的m6A修饰位点,进行了双荧光素酶报告实验。如图5a所示,敲低YTHDF2增加了携带SOCS3野生型3’ UTR片段的报告者的荧光素酶活性,而当m6A位点发生突变时,这些变化被消除。在骨肉瘤的生物信息学分析中,观察到YTHDF2和SOCS3之间呈负相关(图5b)。与上述假设一致,在骨肉瘤细胞中抑制YTHDF2可提高SOCS3的表达,其程度与ALKBH5的过表达相似(图5c)。通过western blot证实了YTHDF2敲除效率(图5c)。我们还敲除了三个YTHDF同源序列(YTHDF1、YTHDF2、YTHDF3),以确定三个YTHDF蛋白是否共同作用以增强m6A修饰的SOCS3的降解。有趣的是,三次敲除后,SOCS3表达显著增加。然而,与单独下调YTHDF2相比,当这三者同时下调时,可以看到少量增加。在本研究中,与单独敲除YTHDF2相比,三重敲除并没有显示出显著更大的效果。接下来,我们进行RNA下拉分析以证明YTHDF2结合骨肉瘤细胞中的SOCS3全长转录物(图5d)。此外,我们检测了ALKBH5过表达或YTHDF2抑制的骨肉瘤细胞和对照细胞中的RNA衰减率。骨肉瘤细胞中ALKBH5过表达和YTHDF2抑制后,SOCS3 mRNA半衰期显著增加(图5e)。为了证实YTHDF2参与ALKBH5对SOCS3的调节,我们在YTHDF2缺失的细胞中调节了ALKBH5的表达,并检测了SOCS3 RNA的衰减率(图5f)。我们进一步探讨了ALKBH5、YTHDF2和SOCS3之间的临床相关性。结果表明,SOCS3表达与ALKBH5呈正相关。然而,在人骨肉瘤组织中,YTHDF2表达与SOCS3呈负相关(图5g,h)。我们的研究表明,ALKBH5的过表达通过m6A-YTHDF2依赖机制增强SOCS3 mRNA的稳定性。
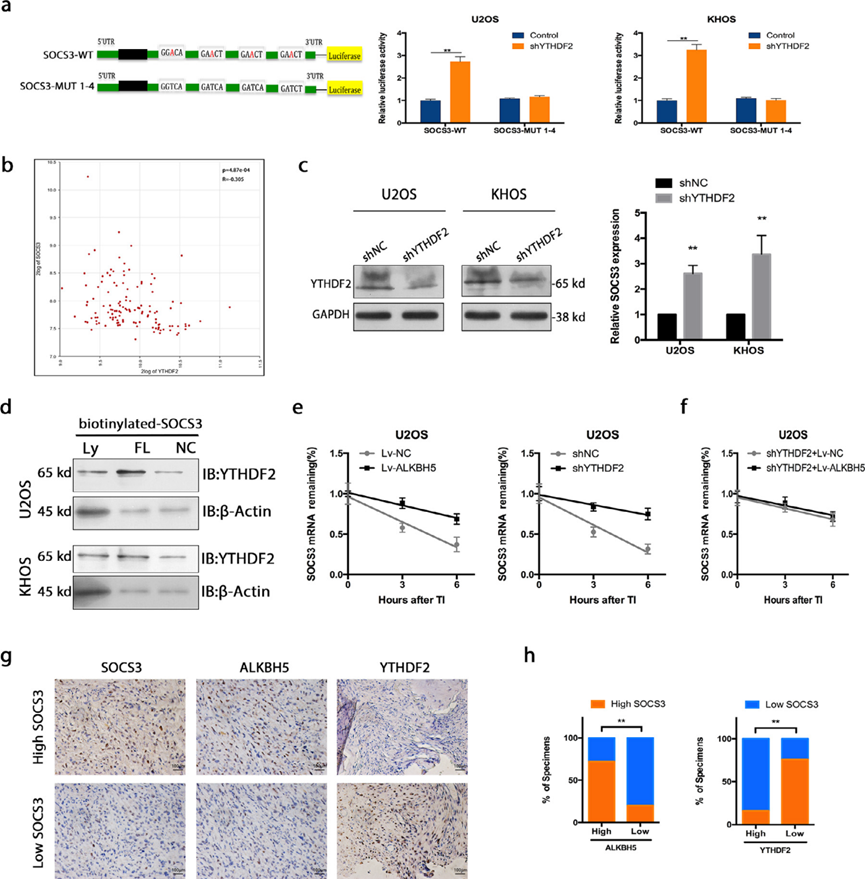
6)STAT3信号的抑制介导m6A甲基化降低对骨肉瘤细胞增殖和凋亡的影响
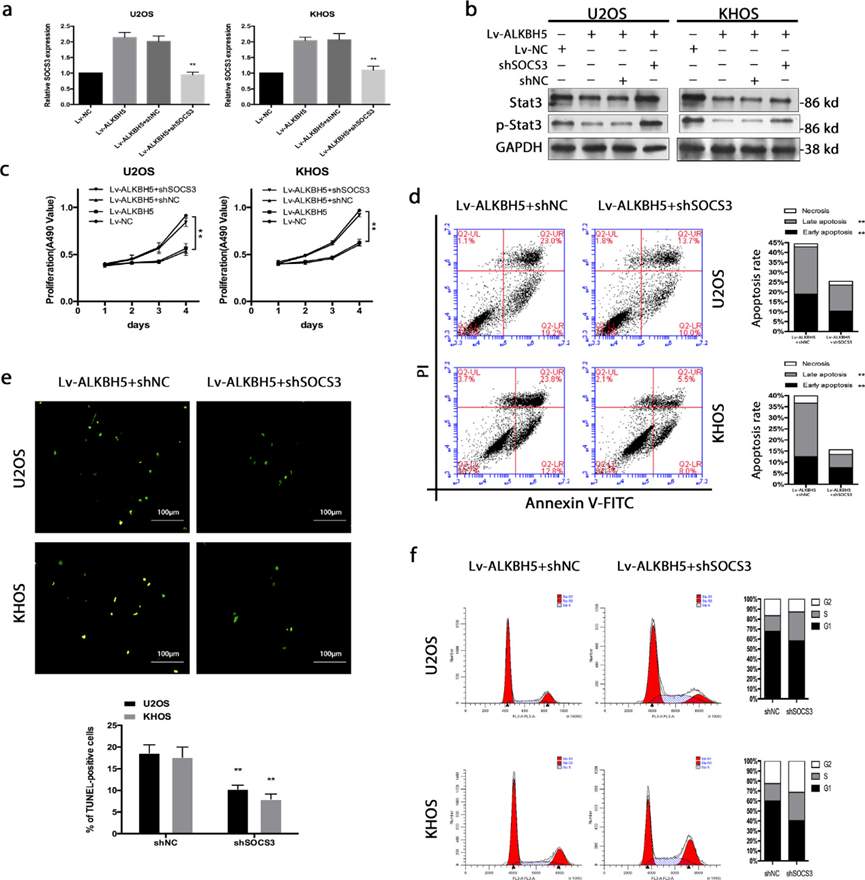
为了确定STAT3失活是否是骨肉瘤细胞m6A甲基化降低后观察到的增殖抑制、凋亡增加和周期停滞的基础,我们试图通过敲除SOCS3来挽救这些表型。SOCS3的下调增加了ALKBH5过表达细胞中p-STAT3的表达(图6a,b)。在功能上,SOCS3敲除挽救了由ALKBH5上调引起的增殖抑制(图6c)、凋亡升高(图6d,e)和周期阻滞促进(图6f)。
7)过表达ALKBH5抑制人体骨肉瘤生长
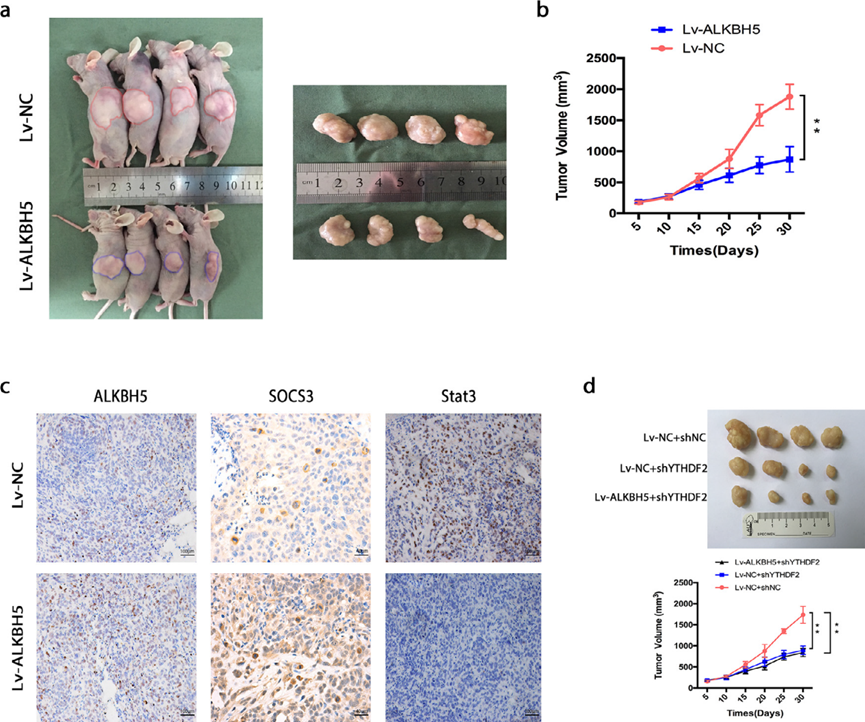
为了进一步研究ALKBH5在人骨肉瘤中的功能,我们在裸鼠皮下移植实验中检测ALKBH5是否对骨肉瘤的致瘤性产生关键影响。与对照组相比,当植入稳定表达ALKBH5的U2OS细胞时,肿瘤的生长被有效抑制(图7a,b)。通过IHC染色对肿瘤样本进行分析,结果表明,在ALKBH5过表达组中,SOCS3的染色增加,STAT3的表达减少(图7c)。此外,在YTHDF2下调组中,肿瘤生长被有效抑制。然而,ALKBH5对YTHDF2缺乏组的肿瘤生长没有显著影响(图7d)。总的来说,ALKBH5在人骨肉瘤中通过m6A-YTHDF2依赖性方式发挥肿瘤抑制作用。
结论:我们的研究结果阐明了ALKBH5介导的m6A修饰在人类骨肉瘤中的临床意义以及肿瘤增殖和生长的调节机制,表明ALKBH5是治疗人类骨肉瘤的潜在生物标记物。
参考文献:Yang Z, Cai Z, Yang C, Luo Z, Bao X. ALKBH5 regulates STAT3 activity to affect the proliferation and tumorigenicity of osteosarcoma via an m6A-YTHDF2-dependent manner. EBioMedicine. 2022 Jun;80:104019. doi: 10.1016/j.ebiom.2022.104019. Epub 2022 Apr 28. PMID: 35490460; PMCID: PMC9062761.






