范本文章之单细胞测序和功能实验的完美结合
骨髓细胞是肝硬化的关键调节因子,肝硬化是世界范围内导致死亡的主要原因。由于基质细胞在体外可以调节髓系细胞的功能,所以靶向基质-髓系相互作用已成为一种有吸引力的潜在治疗策略。本研究的目的是探讨人肝基质细胞如何影响骨髓细胞特性,并了解基质-骨髓共培养系统这些相互作用在肝硬化背景下的效用。本研究最终揭示肝基质细胞可通过释放IL-6调节巨噬细胞的成熟和分化。本研究于20022年1月发表在《JOURNAL OF HEPATOLOGY》IF:30.083期刊上。
技术路线

主要实验结果
1、肝硬化和非肝硬化细胞的单细胞图谱揭示差异细胞群
作者通过两种方法研究了肝基质细胞如何调节骨髓细胞表型,以及体外基质-骨髓系统研究人类肝硬化的相关性。如图1A,对肝基质细胞和骨髓细胞进行单细胞测序;使用原代人基质-髓系共培养系统来研究肝基质细胞如何影响CD14 +细胞的成熟和分化。单细胞测序对骨髓谱系特征的集中分析显示有5个主要的细胞群:血源性单核细胞(Mono1),CD16 +单核细胞(Mono2),KCs,SAM和髓源性树突状细胞(mDC)(图1B)。髓系细胞亚群的分类使用的是关键基因标志物(图1B-C),Mono1表达血源性单核基因CD14,LYZ,S100A9,S100A8;Mono2表达CD16阳性单核基因FCGR3A,TIMP1,CD52;KC细胞表达C1QC,CD163,CTSB,FCGR3A;SAM细胞表达TREM2,CD9,FABP5,SPP1,mDC细胞低表达CD14和上调的CD1C及CLEC10A。总之,肝硬化和非肝硬化细胞的单细胞图谱已经具有明显不同。
2、CD14+细胞HLA-DR上调提示巨噬细胞成熟
为单细胞测序结果的髓系细胞群生成基因特征,并使用DWLS方法估计了这些细胞群在培养的CD14+细胞中的相对丰度(图1D)。如预期的,在共培养0h时,以Mono1亚群为主,然而,72h后,CD14+细胞向巨噬细胞亚群的表达谱转变,如KCs和SAM。转录组测序的结果支持这一结论(图1E)。这些结果表明共培养72小时后单核细胞向巨噬细胞转化。
由于巨噬细胞比单核细胞更适合呈递抗原,所以作者检测了HLA-DR的表达以区分人类巨噬细胞和单核细胞。结果显示和单核细胞亚群比较(Mono1和Mono1),HLA-DR的表达在巨噬细胞亚群(KCs和SAM)中上调(图1F)。转录组测序也证实CD14+细胞培养72h后HLA-DR的表达显著上调(图1G-H)。研究发现培养72小时的细胞基因主要富集在Antigen processing and presentation via MHC class II的GO条目中。因此,这些结果表明HLA-DR的表达可鉴定巨噬细胞并且提示CD14+细胞向HLA-DR巨噬细胞成熟在培养72小时后。
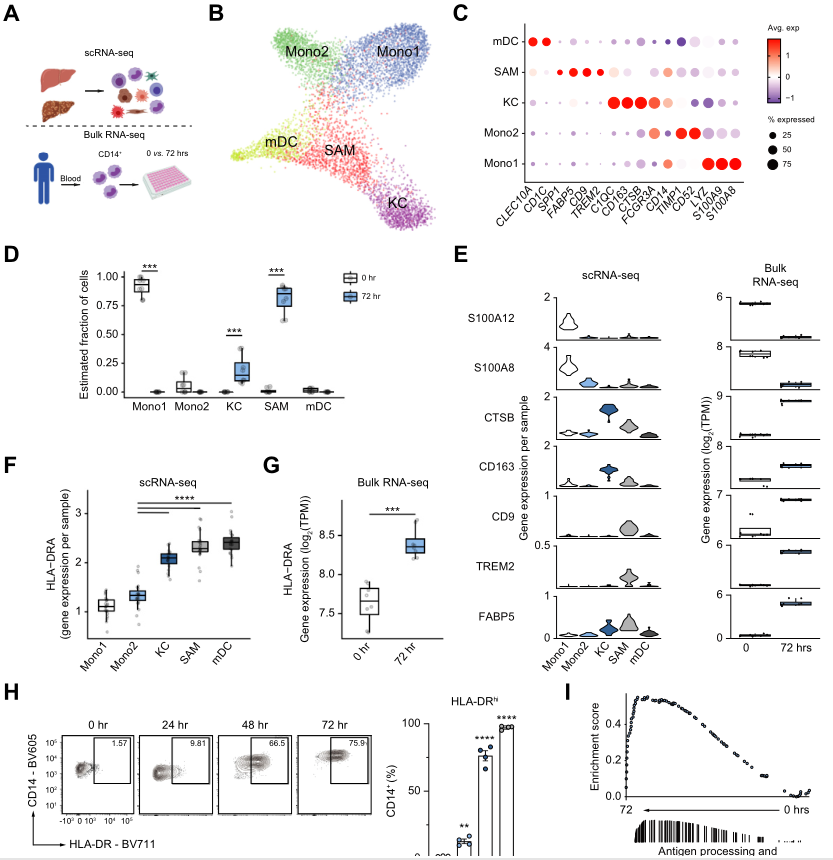
3、基质细胞限制人单核细胞向巨噬细胞成熟
为了研究基质细胞对巨噬细胞成熟的影响,采用了人基质-髓系共培养系统,将原代肝基质细胞与新鲜分离的血液CD14+细胞共培养0-72小时(图2A)。基质细胞显著降低了CD14+细胞向巨噬细胞的转化(图2B)。转录组测序的结果也支持这一结论(图2C)。这些表明原代肝脏基质细胞在体外限制单核细胞向巨噬细胞成熟的转变。
4、培养的基质细胞在转录上类似于原纤维间充质细胞亚群 Mes-2
为了区分哪个肝基质细胞亚群在体外限制巨噬细胞成熟,作者比较了通过 单细胞测序的离体肝基质细胞的转录组和通过批量 RNA-seq 的体外原代肝基质细胞。亚聚类分析显示了14种非造血细胞亚群,如图2D-2F所示,每种类群根据区基因标志物的特异性表达区分。使用 DWLS 分析将 scRNA-seq 亚群与体外基质细胞的转录比对确定间充质细胞亚群 Mes-2 为主要亚型,而 Mes-1、肝星状细胞和各种内皮细胞群的混合物为少数亚型(图2G)。此外,进一步探究发现基质细胞限制巨噬细胞的成熟是依赖于细胞间之间接触机制的(图2H)。
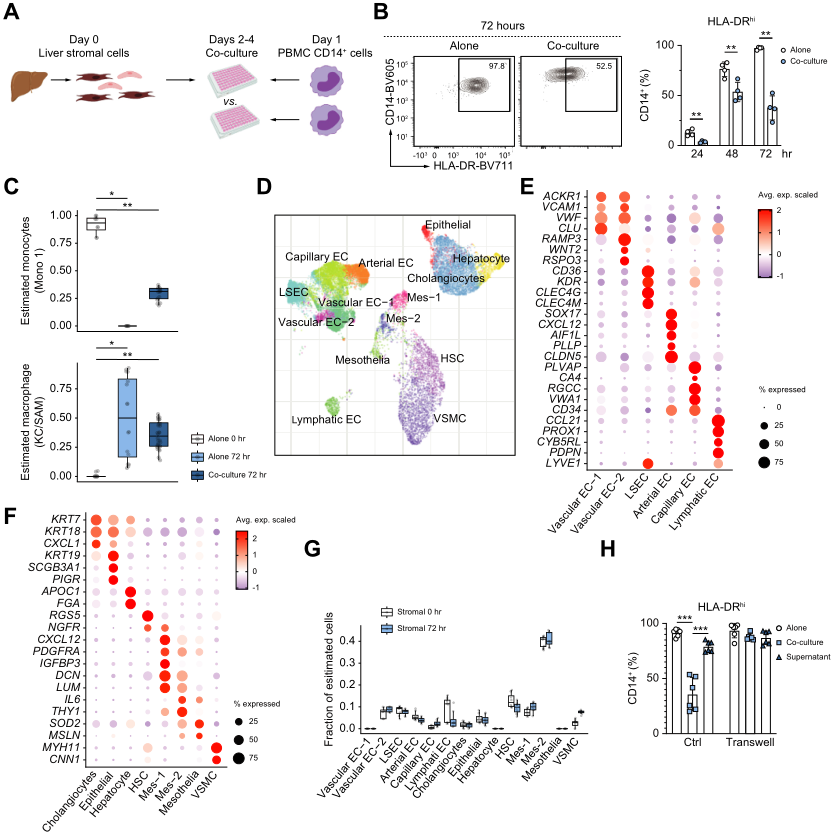
图2肝纤维化细胞限制巨噬细胞成熟
5、基质细胞限制巨噬细胞向CD9+ SAMs的分化
由于CD9+ SAMs亚群在硬化肝脏中增加而CD163+ KC亚群减少,所以作者探究了是否基质细胞改变了髓系细胞分化为巨噬细胞亚群的临床相关性。RNA-seq分析显示,CD14+细胞单独培养与SAMs相似,而CD14+细胞与基质细胞共培养在转录上与KCs相似(图3B)。基因表达分析证实了这种相关性,CD14+单独培养CD9,FABP5,TREM2的表达增加,类似SAMs亚群,但是和基质细胞共培养则CD163,C1QA,CTSB的表达增加,类似KC亚群(图3C)。因此,作者猜想CD9+和CD163+可能分别是SAMs亚群和KC亚群的标记。为检验该猜想,进行了流式定量分析,CD14+细胞与基质细胞共培养减少了CD9+的比率并增加了CD163+的比率(图3D)。这些数据验证了作者的猜想,即基质细胞信号调控巨噬细胞分化可能通过限制SAM保护干燥免受纤维化。

6、基质可溶性因子足以限制SAM的分化且依赖于IL-6/IL-6R通路
鉴于基质接触是巨噬细胞成熟所必须的,作者评估了这种接触是否也是巨噬细胞分化所必须的。结果发现上清液转移和共培养的方法都能诱导KC样CD163+和限制SAM样CD9+表达,提示基质可溶性因子足以控制巨噬细胞分化(图4A)。
随后使用RNA-seq对体外基质细胞和CD14 +细胞进行了注释的同源受体-配体对表达分析,以检测控制巨噬细胞分化的潜在机制。识别到可溶性和依赖于接触的注释通路,但重点关注可溶性通路,因为它们足以改变分化(图4B)。作者验证了一系列基质-髓对,包括IL-6/IL-6R(图4C)。与CD14+细胞单独培养组比较,IL-6蛋白表达在共培养组显著升高(图4D),提示其可能参与两者的相互作用。RNA-seq证实了IL-6在肝脏基质细胞中的表达和IL-6R在CD14+细胞的表达(图4E)。这些数据说明基质可溶性因子对SAM分化的限制依赖于IL-6/IL-6R通路。
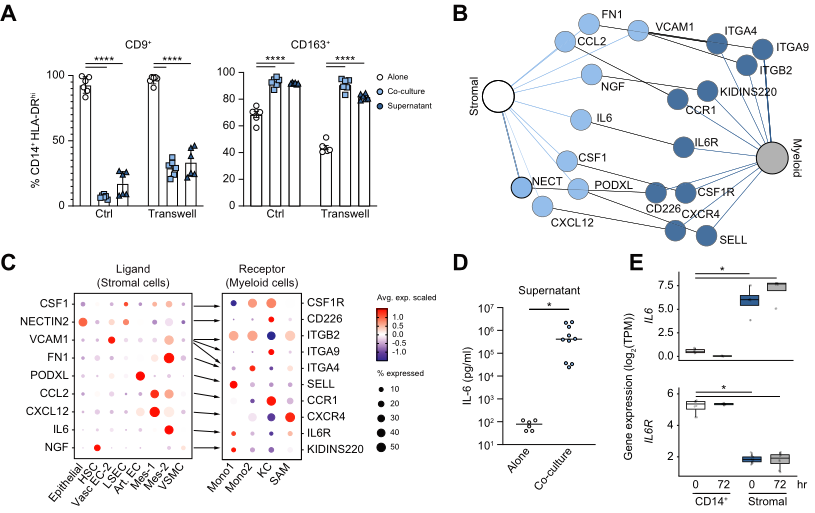
图4基质可溶性因子足以限制SAM的分化和IL-6/IL-6R通路上调
7、基质细胞来源的可溶性因子IL-6限制CD9+ SAMs的分化
为了进一步探究是否是IL-6影响了巨噬细胞亚群分化,使用IL-6R抗体阻断了IL-6信号通路,结果发现IL-6R抗体处理显著降低了共培养体系和上清液体系中的CD163+ KC样亚群,而增加了CD9+ SAM样细胞亚群,表明CD+向CD163+分化受到限制(图5A-B)。随后作者探究通过IL-6/IL-6R复合物能否控制巨噬细胞分化。经典的IL-6信号涉及IL-6与膜结合的IL-6R和gp130蛋白的相互作用,而反式IL-6信号允许IL-6与可溶性IL-6R复合体,并与细胞膜上的gp130蛋白相互作用。所以作者检测了CD14+细胞单独培养72小时后,重组IL-6 (rIL-6)(经典),或IL-6/IL-6R融合(FC-IL-6)(反式)蛋白CD9+和CD163+的表达,(图5C)。这些结果表明经典和反式IL-6都能调节巨噬细胞分化。DWLSf分析证实rIL-6处理的CD14+细胞转录最大程度上接近于KC肝细胞亚群,类似于基质共培养细胞(图5D)。此外,图5E-F的结果提示IL-6起源于肝脏基质细胞亚群并分布于整个肝脏组织,并且基质IL-6主要产生于Mes2细胞。临床样本证实,和健康对照的肝脏组织比较,IL-6的表达在NSAH和SS肝组织中显著下降(图5G)。这些结果表明基质细胞来源的可溶性因子IL-6限制CD9+ SAMs的分化,并且认为干预IL-6通路可调节巨噬细胞分化。

图5基质细胞来源的可溶性因子IL-6限制CD9+ SAMs的分化
参考文献:
Buonomo Erica L., Mei Shenglin., Guinn Samantha R., Leo Isabelle R., Peluso Michael J., Nolan Mei-An., Schildberg Frank A., Zhao Lei., Lian Christine., Xu Shuyun., Misdraji Joseph., Kharchenko Peter V., Sharpe Arlene H.(2022). Liver stromal cells restrict macrophage maturation and stromal IL-6 limits the differentiation of cirrhosis-linked macrophages. J Hepatol, 76(5), 1127-1137. doi:10.1016/j.jhep.2021.12.036






