CircRNA在肿瘤研究中的经典实验设计思路 EWSR1诱导的circNEIL3通过稳定IGF2BP3促进胶质瘤进展和外泌体介导的巨噬细胞免疫抑制极化
作者通过分析环状RNA在胶质瘤组织中的表达谱,鉴定了一个来自NEIL3的环状RNA, hsa_circ_0001460,命名为circNEIL3,在体外和体内促进了胶质瘤的发生和进展。随后通过不同的通路,阐明circNEIL3促进胶质瘤进展的分子机制。该文章发表在《Molecular Cancer》,IF: 41.44。
技术路线:

主要研究结果:
1. CircNEIL3在胶质瘤组织中表达显著上调
作者首先分析了39个胶质瘤组织(11个GBM和28个低级别胶质瘤(LGG))和8个正常脑组织(NBTs)中环状RNA的表达谱。火山图显示,在GBM和LGG之间,以及LGG和NBTs之间,circRNA表达有系统性差异(图1A, B),在胶质瘤组织中差异上调的环状RNA (Log2FC≥4, P adj≤0.05),并鉴定出hsa_circ_0001460 (图1C)。与NBTs相比,CircNEIL3在胶质瘤组织中显著上调,且随着胶质瘤分级的增加其表达增加(图1D)。ROC曲线表示circNEIL3可预测胶质瘤患者不良预后(图1E)。通过UCSC基因组学研究所生物信息学网站,发现circNEIL3在NEIL3基因的第8外显子和第9外显子之间反接,长度为596 nt(图1)。使用发散引物扩增circNEIL3的后剪接位点,并通过Sanger测序确认(图1F)。凝胶电泳分析结果显示,circNEIL3只能从cDNA中扩增出来,而从cDNA和gDNA中可以扩增出线性形态(图1G)。此外, RNase R和放线菌素D的处理证实了circNEIL3比NEIL3更稳定(图1H, I)。核质分离实验和FISH分析显示,circNEIL3主要定位于细胞质(图1J, K)。综上所述,circNEIL3在胶质瘤组织中表达显著上调,且在GBM中表达最高,提示其参与了胶质瘤的发生和恶性进展。

图1 CircRNA在胶质瘤中的表达谱和circNEIL3的特征
2. CircNEIL3在体外和体内均可促进胶质瘤的发生
功能实验表明:下调circNEIL3显著抑制细胞增殖、迁移和侵袭,过表达circNEIL3显著促进这些细胞行为(图2A-D)。体内实验显示,circNEIL3下调可显著抑制肿瘤生长和侵袭,延长荷瘤小鼠的生存时间,而circNEIL3过表达则会产生相反的效果(图2E、F)。此外,切除的肿瘤切片免疫组化显示,circNEIL3敲低的肿瘤组织中Ki67和CD44的表达低于载体组,而circNEIL3过表达则相反(图2G)。综上所述,circNEIL3在调节肿瘤发生和胶质瘤进展方面具有重要的功能。
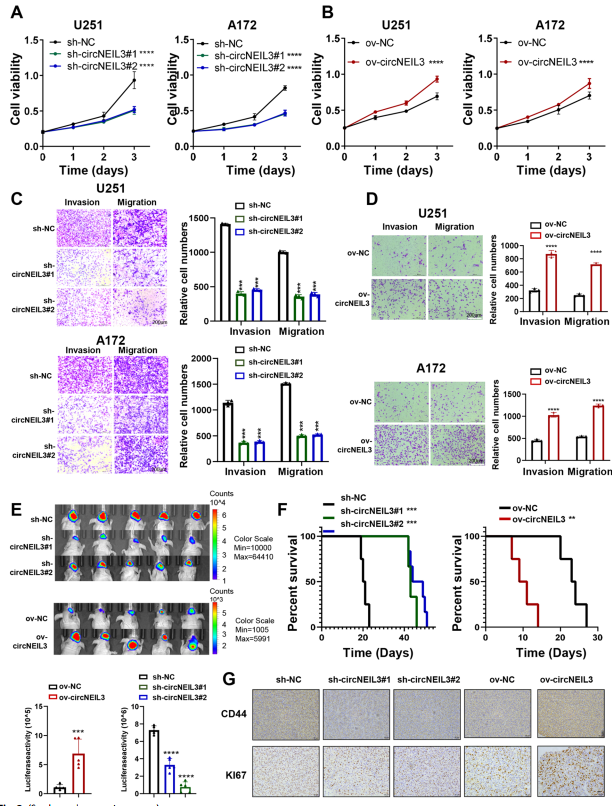
图2 CircNEIL3在体外和体内促进GBM细胞增殖和转移
3. EWSR1促进了circNEIL3在胶质瘤中的生物发生
利用CircInteractome数据库和starBase 3.0数据库在circNEIL3的上下行区域预测了EWSR1的三个结合位点,分别称为序列1、序列2和序列3(图3A)。随着胶质瘤级别的升高,EWSR1表达水平升高,高表达的患者预后较差(图3B)。此外,敲低EWSR1可以抑制GBM细胞的增殖、侵袭和迁移(图3C、D)。在circRNA转录组中,发现circNEIL3与EWSR1呈正相关(图3E),而在EWSR敲低的U251和A172细胞中,circNEIL3的表达明显下降(图3F)。将U251和A172细胞置于缺氧条件下0 h、6 h、12 h和24 h,随着暴露时间的增加,EWSR1和circNEIL3的表达上调(图3G,h)。通过RIP-qPCR检测证实,EWSR1能与NEIL3 pre-mRNA序列1和序列3结合,且在缺氧条件下结合能力显著上调(图3I)。最后设计拯救实验, EWSR1过表达诱导U251和A172细胞增殖、迁移和侵袭增加,可通过下调circNEIL3来逆转(图3J-L)。
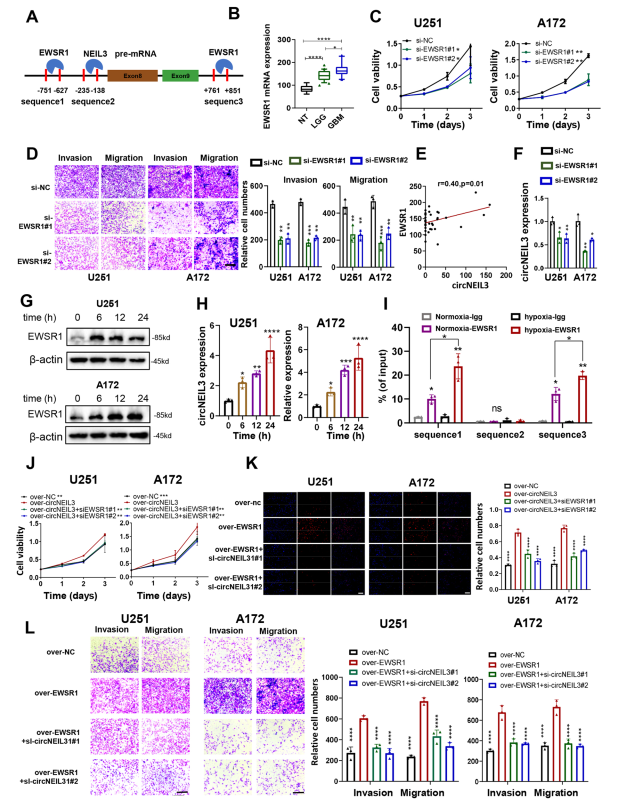
图3 EWSR1促进circNEIL3的生物发生
4. CircNEIL3在物理上与IGF2BP3相互作用,并抑制泛素/蛋白酶体介导的IGF2BP3降解
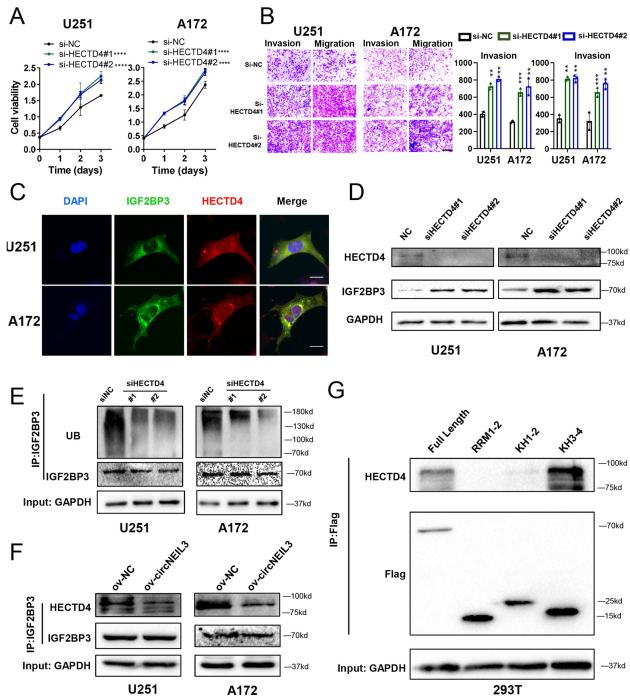
为了探索circNEIL3诱导GBM细胞进展的分子机制,首先进行了RNA下拉分析和质谱分析,以探索与circNEIL3结合的潜在蛋白。共鉴定出50个与circNEIL3相互作用的蛋白,其中不包括AGO2,排除了circNEIL3作为ceRNA的可能性。将质谱数据与CircInteractome数据库中预测的RBP进行交叉。发现circNEIL3与IGF2BP3蛋白结合(图4A)。RNA pull-down和RIP-qPCR进一步证实了circNEIL3与IGF2BP3的相互作用(图4B, C)。RNA fish -免疫荧光分析,发现circNEIL3与IGF2BP3在细胞质中共定位(图4D)。IGF2BP3由2个RNA识别基序(RMS)和4个KH结构域组成。因此,建立了6个flag标记的载体,并通过Western blot进行了确认,以测试哪个区域与circNEIL3相互作用(图4E, F)。RIP-qPCR检测显示,circNEIL3主要结合在KH3-4区域,表明这个结构域负责招募circNEIL3(图4G)。然后为了识别IGF2BP3结合的circNEIL3序列,设计了三个突变位点,最终观察到IGF2BP3与circNEIL3的第三个位点结合(图4H)。这些结果表明circNEIL3在细胞质中与IGF2BP3发生相互作用。
然而,circNEIL3并没有显著改变IGF2BP3的mRNA水平(图4I),但显著促进IGF2BP3及其下游靶点CDK4/6、CD44和c-MYC的蛋白表达(图4J),表明circNEIL3可能通过破坏IGF2BP3蛋白的稳定来调控胶质瘤的恶性进展。由于过表达circNEIL3可以提高IGF2BP3的蛋白表达水平,延长IGF2BP3的半衰期(图4K),表明circNEIL3通过蛋白酶体活性调控IGF2BP3蛋白的稳定性。circNEIL3过表达降低了IGF2BP3的泛素化(图4L)。然后,通过Ubibrowser数据库鉴定出一个泛素化赖氨酸(K)残基(K450),位于IGF2BP3的KH3结构域(图4N)。利用Uniport数据库预测了IGF2BP3的K450位点在6个物种中高度保守(图4N),并将K450泛素化位点可视化(图4O)。然后,作者将预测位点从赖氨酸(K)突变为精氨酸(R),以确认其作为泛素化靶点的作用。免疫沉淀(IP)结果显示,与野生型IGF2BP3相比,K450突变显著降低了IGF2BP3的泛素化水平,且在表达突变体的细胞中,cirNEIL3过表达导致的泛素化增强也被抑制(图4M),突显出K450是IGF2BP3的主要泛素化位点。这些结果表明,circNEIL3通过抑制泛素/蛋白酶体依赖的降解,增强IGF2BP3蛋白的稳定性,从而促进胶质瘤的恶性进展。
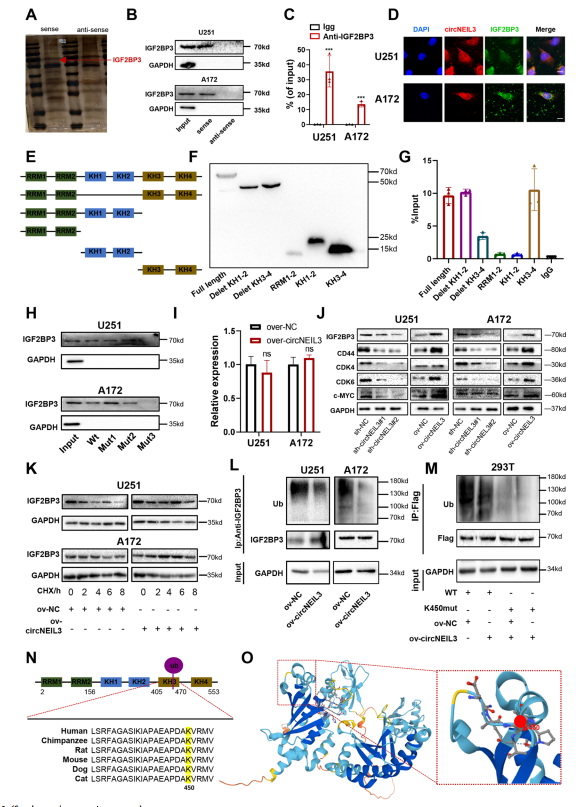
图4 CircNEIL3与IGF2BP3相互作用并抑制其泛素化
5. CircNEIL3通过抑制IGF2BP3蛋白HECTD4 -介导的泛素化
co-IP和质谱分析,发现属于E3泛素连接酶的HECD家族的蛋白HECTD4可以与IGF2BP3结合。细胞实验证明HECTD4可以抑制GBM细胞的增殖、侵袭和迁移(图5A, B)。免疫荧光实验,证实IGF2BP3与细胞质中的HECTD4共定位(图5C)。此外,在HECTD4敲除GBM细胞中,IGF2BP3蛋白水平显著升高(图5D),而其泛素化水平明显降低(图5E),这表明在胶质瘤中,HECTD4作为E3泛素连接酶通过泛素-蛋白酶体途径降解IGF2BP3。
过表达circNEIL3可以阻断IGF2BP3与HECTD4的结合(图5F),这解释了circNEIL3是如何稳定IGF2BP3的。Co-IP实验观察到HECTD4结合在IGF2BP3的KH3-4结构域,这是circNEIL3与IGF2BP3相互作用的同一位点(图5G和图4G)。这些数据表明circNEIL3通过阻止HECTD4介导的泛素化而稳定IGF2BP3蛋白。
图5 CircNEIL3阻断IGF2BP3与HECTD4的结合
6. CircNEIL3促进胶质瘤中巨噬细胞的浸润
如图6A所示,与circNEIL3低表达组相比,circNEIL3高表达组TME细胞浸润更多,免疫评分和基质评分更高,肿瘤纯度更低。与circNEIL3低表达的胶质瘤相比,circNEIL3高表达的胶质瘤中巨噬细胞浸润明显增加。使用Transwell实验发现,与NC组相比,过表达circNEIL3的GBM细胞的条件培养基(CM)显著促进THP1分化的巨噬细胞迁移(图6B),而来自circNEIL3敲低的GBM细胞的CM则显示相反的结果(图6C)。总之,circNEIL3过表达的肿瘤细胞可以驱使巨噬细胞浸润到胶质瘤微环境。
GSEA结果表明,与circNEIL3低样本相比,circNEIL3高样本中YAP1信号基因标记高度富集(图6D)。对TCGA胶质瘤标本进行IGF2BP3的检测也得到了同样的结果(图6E)。qRT-PCR实验验证了circNEIL3促进CCL2和LOX表达的结果(图6F),而这种由circNEIL3过表达诱导的表达增强可以通过IGF2BP3敲低来拯救(图6G)。最后,circNEIL3可以增加GBM细胞中YAP1和LOX的蛋白表达(图6H)。过表达circNEIL3引起的表达增加也可以通过敲低IGF2BP3来消除(图6I)。总之,这些结果表明circneil3过表达的GBM细胞可能通过激活YAP1信号驱动巨噬细胞浸润到肿瘤相关的微环境。
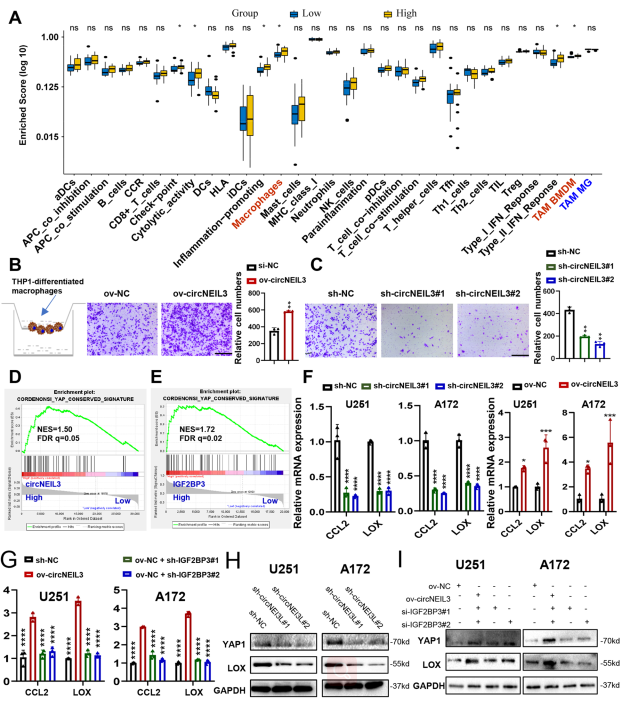
图6 CircNEIL3促进胶质瘤内巨噬细胞浸润
7. CircNEIL3可通过hnRNPA2B1被包装成外泌体
circNEIL3下拉实验的质谱数据,发现circNEIL3可以与hnRNPA2B1结合,hnRNPA2B1被报道可以运输各种RNA进入外泌体。并且在GBM细胞中通过RIP和RNA下拉实验证实了circNEIL3和hnRNPA2B1之间的相互作用(图7A, B)。在hnRNPA2B1敲低的GBM细胞中,circNEIL3在细胞中表达上调,在外泌体中表达下调(图7C)。综上所述,这些结果表明,circNEIL3可以被hnRNPA2B1包装成外泌体。
8. 外泌体向TAMs传递circNEIL3,从而使TAMs通过稳定IGF2BP3获得免疫抑制特性
流式细胞术结果表明,circNEIL3过表达显著上调巨噬细胞激活标志物CD163(图7D)。随着circNEIL3在外泌体中的表达增加,巨噬细胞激活标志物、免疫抑制分子和SPP1(维持胶质瘤细胞存活并刺激血管生成)显著上调(图7E, F,图S11J)。总之,这些结果表明,外泌体可以将circNEIL3传递给TAMs,从而使它们获得血管生成和免疫抑制特性。为了阐明circNEIL3介导巨噬细胞免疫抑制特性的机制,通过RNA下拉和RIP实验发现,在THP1分化的巨噬细胞中,circNEIL3与IGF2BP3结合的位点与肿瘤细胞相同(图7G, H)。此外,在肿瘤细胞中观察到,在THP1分化的巨噬细胞中,circNEIL3增加了IGF2BP3蛋白的表达,抑制了IGF2BP3的泛素化(图7I, J)。因此,与GBM细胞一样,IGF2BP3可以作为circNEIL3在巨噬细胞中的下游效应因子,介导巨噬细胞向免疫抑制表型极化。western blot检测结果证实,在THP1分化的巨噬细胞中,过表达circNEIL3和IGF2BP3均能提高YAP1蛋白的表达,而敲除它们的结果则相反(图7K, L)。此外,敲除IGFB2P3可消除过表达circNEIL3对YAP1蛋白表达的增强(图7M),表明circNEIL3通过稳定IGF2BP3蛋白来增强YAP1的表达,从而促进巨噬细胞的免疫抑制表型极化。为了进一步验证circNEIL3在体内对巨噬细胞免疫抑制极化的影响,将过表达cicrNEIL3的巨噬细胞或阴性对照载体与胶质瘤细胞共原位植入裸鼠大脑。与NC组相比,circNEIL3过表达组肿瘤生长加快,荷瘤小鼠的生存时间延长(图7N-P)。为了进一步证明circNEIL3通过IGF2BP3-YAP1轴发挥作用,在临床胶质瘤患者局部组织中进行了免疫荧光染色实验。这些结果表明,IGF2BP3可以作为circNEIL3在巨噬细胞中的下游效应因子,使巨噬细胞获得免疫抑制特性,从而促进胶质瘤的进展。

图7外泌体可将circNEIL3传递给TAMs,从而使其获得血管生成和免疫抑制特性
结论:
作者发现了一种在人脑胶质瘤组织中上调的新型环状RNA circNEIL3。随着胶质瘤分级的增加,受EWSR1调控的circNEIL3表达增加。在功能上, circNEIL3在体外和体内促进了胶质瘤的发生和进展。从机制上讲,circNEIL3通过阻止HECTD4介导的泛素化来稳定IGF2BP3,这是一种已知的致癌蛋白。此外,circNEIL3过表达的胶质瘤细胞可驱动巨噬细胞浸润至TME。最后,circNEIL3可通过hnRNPA2B1打包成外泌体,传递给浸润的TAMs,从而使其通过稳定IGF2BP3获得免疫抑制特性,进而促进胶质瘤的发生和恶性进展(图7Q)。这些研究结果表明,circNEIL3可能是一种新的预后生物标志物和有希望的胶质瘤治疗靶点。