『基金热点精读』“炎症记忆”驱动过敏性哮喘——“代谢-表观遗传回路”介导巨噬细胞重编程
传染性病原体可以“重编程”或“训练”巨噬细胞及其祖细胞,使其更容易对随后的损伤作出反应。然而,这种炎症记忆是否存在于过敏性哮喘等T2炎症条件中尚未清楚。作者采用HDM(室内尘螨)过敏患者临床样本、HDM诱导的小鼠AAI(气道过敏性炎症)和体外训练相结合的方法,探讨巨噬细胞在过敏性哮喘中的免疫机制。该研究于2022年6月发表在《The Journal of Allergy and Clinical Immunology》,IF:10.228。
技术路线:
主要研究结果:
1. HDM过敏患者的巨噬细胞发生转录重编程且T2炎症介质增多
为研究过敏性哮喘中潜在的巨噬细胞记忆,作者从HDM过敏或健康供者的单核细胞中产生aMDM(巨噬细胞)。RNA测序分析发现,与非过敏供者相比,HDM过敏供者的aMDM有88个基因差异表达(图1A和B),表明稳定的转录重编程持续整个体外分化。体外HDM暴露导致患者源性aMDM中TNF、IL-12、CXCL2和S100P的产生增加(图1C),这表明aMDM患者的HDM反应增强以TNF为主。来自HDM过敏个体的未受刺激的aMDM,产生了大量的cysLT,这是T2炎症的重要介质。哮喘中TH2反应的驱动因子CCL17在HDM患者的aMDM和AM(气道巨噬细胞)中有升高的趋势(图1D和E)。因此,过敏性哮喘患者的aMDM在基线时表现出炎症印记和T2驱动介质谱,并增强了TNF主导的HDM反应。
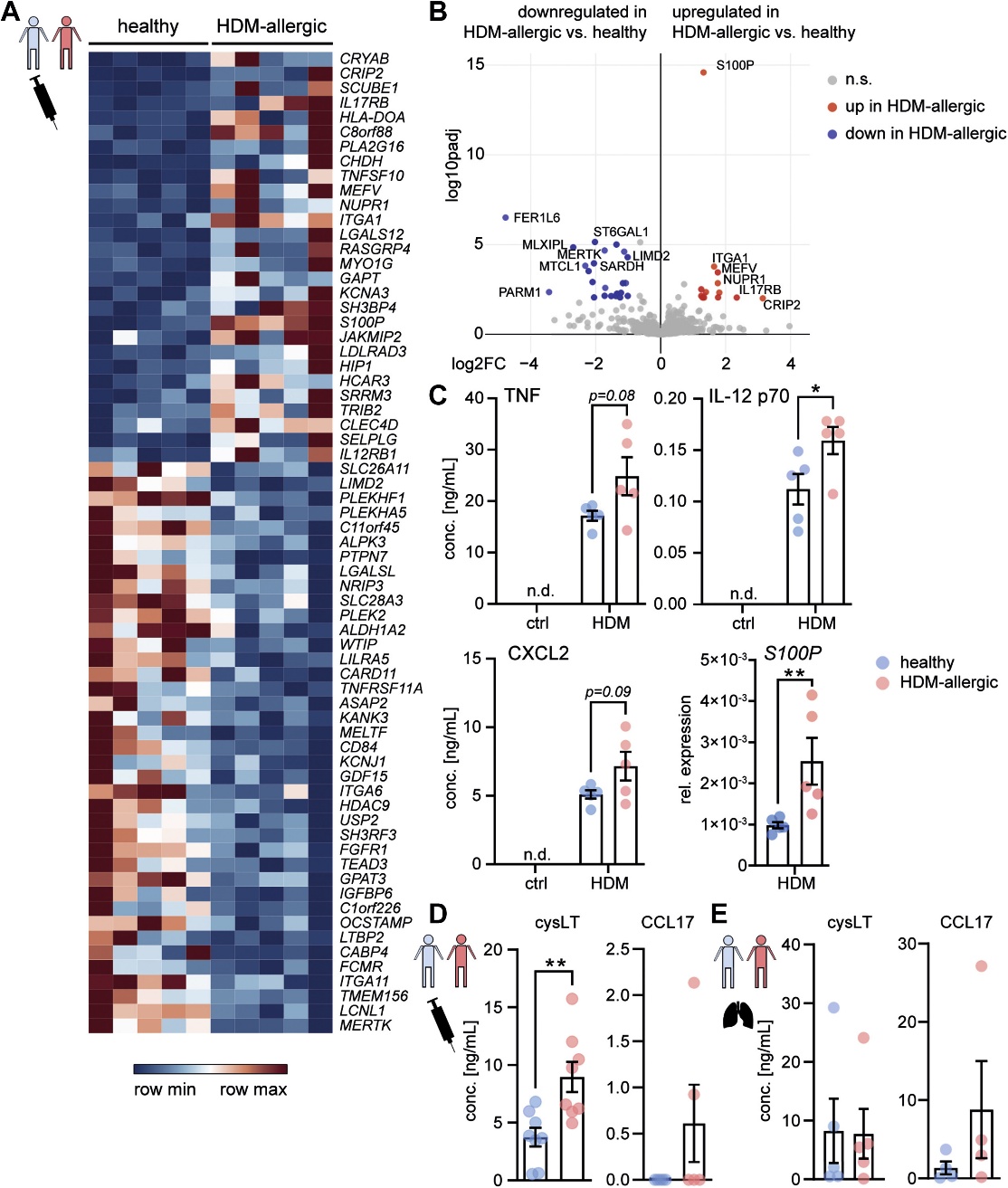
图1 HDM过敏性哮喘患者单核细胞来源的巨噬细胞表现出持续的炎症基因表达和炎症介质的过度产生
2. HDM诱导的AAI可诱导骨髓持续炎症印记
与PBS致敏小鼠相比,BMDM(骨髓起源的巨噬细胞)和AM从HDM致敏小鼠的骨髓祖细胞分化7天,显示cysLTs产生增加和Ccl17表达增强(图2A和B)。攻击7天后,HDM诱导的AAI和T2细胞因子在骨髓中的表达基本消失(图2C)。然而,AM和BMDM保持了CCL17的高产量(图2D)。此外,BMDM上调了经典训练免疫基因(Il6和Ptgs2) (图2E)。总之,这表明AAI在局部和骨髓祖细胞中都留下了先天记忆。
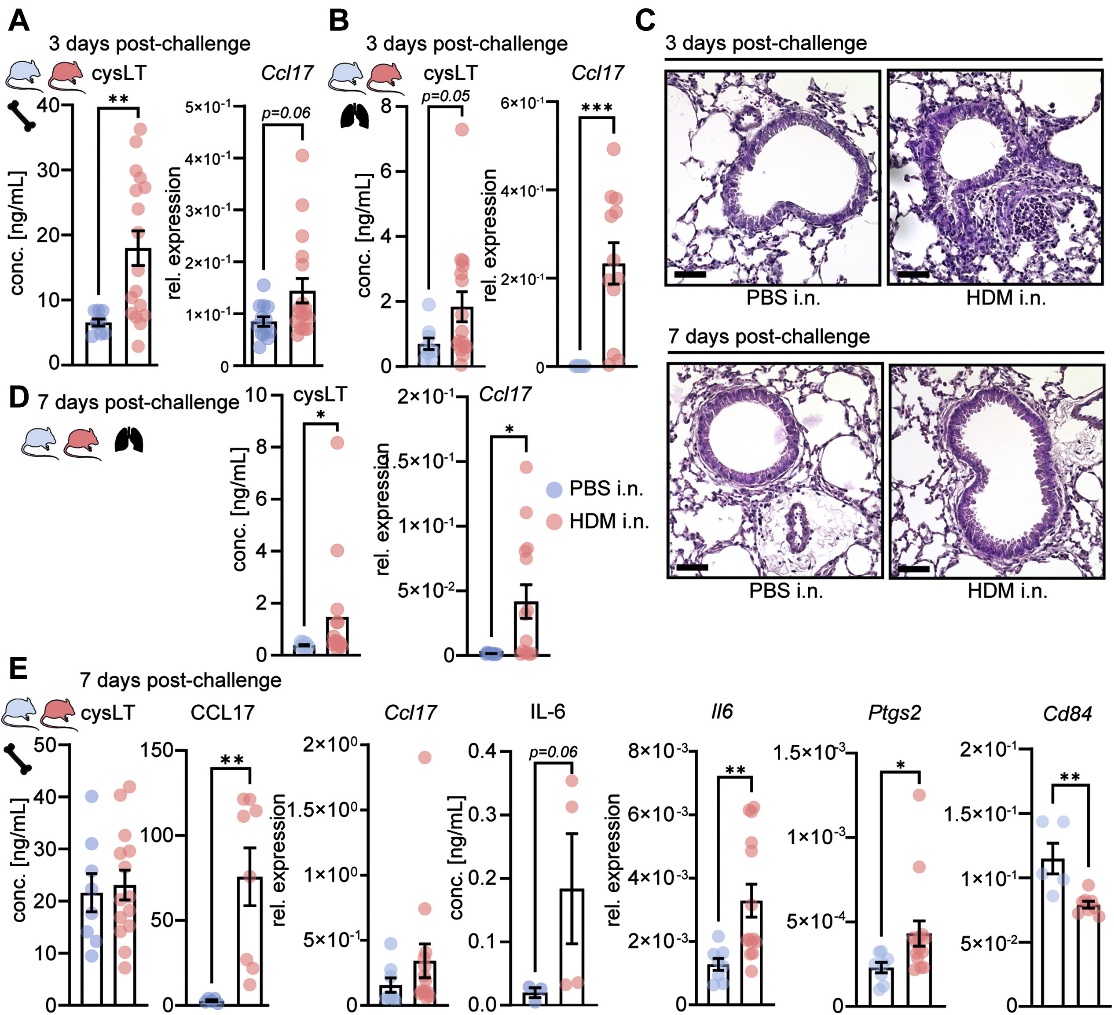
图2 HDM诱导的气道炎症在小鼠外周和AMs中诱导T2印记,向经典的中枢训练免疫转移
3. HDM训练驱动人巨噬细胞中cysLT过度、CCL17反应及转录重编程
在分化第7天,用HDM训练aMDM,经过5天的冲洗期后重新刺激,体外HDM训练和再刺激的aMDM中cysLT和CCL17的产生增加(图3A和B)。通过RNA测序,用火山图和聚类热图显示炎症基因的差异表达(图3C、D、E和F)。炎症基因的表达伴随HDM训练巨噬细胞的代谢激活(图3G、H和I),表明清除HDM后代谢重编程仍然存在。IL17RB(受体亚基结合IL-25)在体外训练和患者的aMDM中上调(图1A和B;图3J)。与对照组aMDM相比,暴露于IL-25的过敏原训练中,CCL17和cysLT的产生增加(图3K和L),表明对上皮信号的反应性增强。相反,来自HDM训练和攻击的巨噬细胞的上层清液上调人支气管上皮细胞中的CXCL8(图3M)。因此,体外HDM训练诱导哮喘患者巨噬细胞的转录和代谢重编程,再现炎症记忆特征,并对气道上皮细胞产生功能性影响。
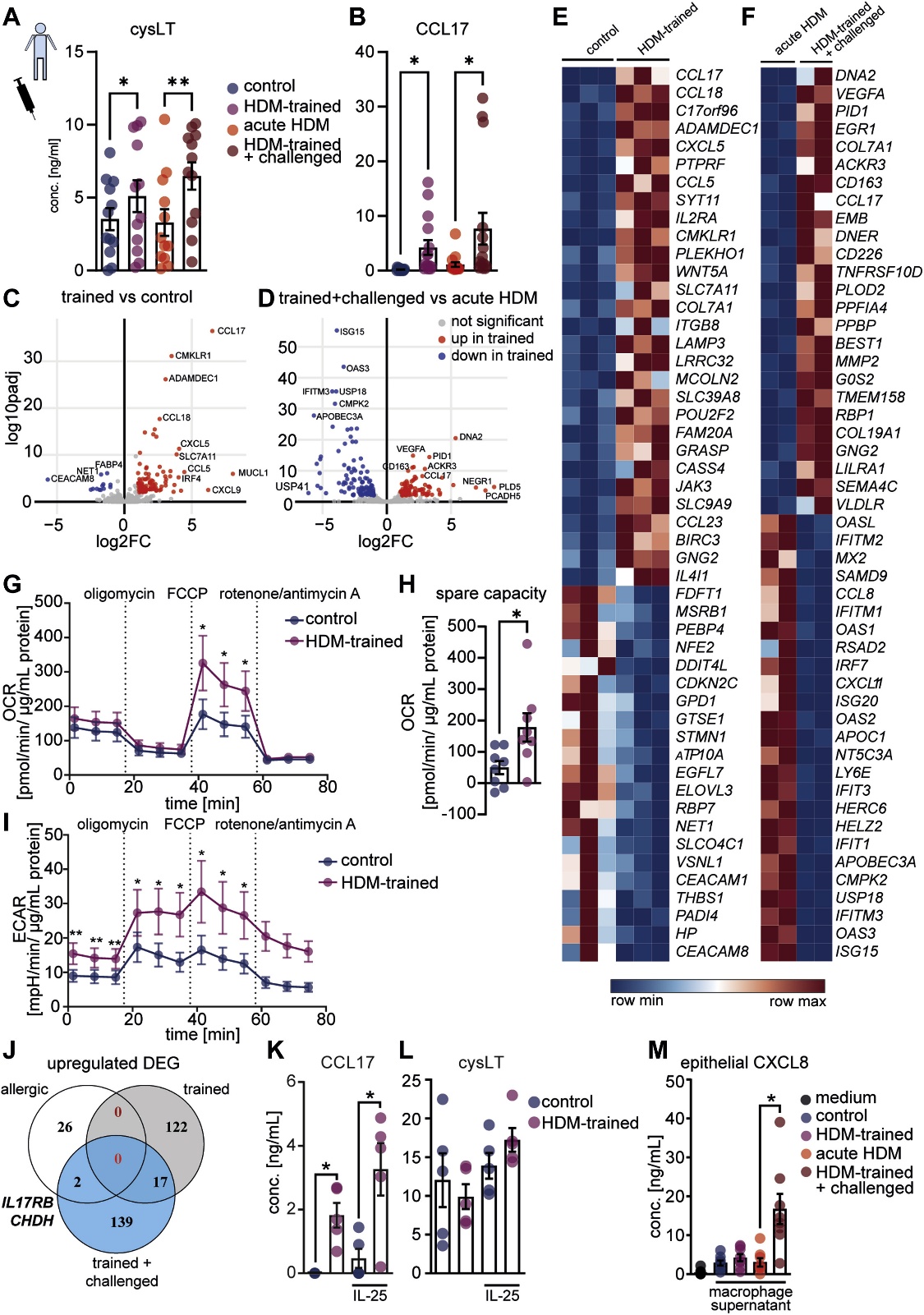
图3 HDM训练分化的人类巨噬细胞驱动T2促进和代谢激活表型
4. FPR2和TNF信号通路介导HDM诱导的巨噬细胞重编程
接下来,作者试图确定HDM介导巨噬细胞重编程的机制。与HDM传感有关的FPR2,在HDM训练的巨噬细胞中持续上调,并由HDM刺激诱导(图4A)。在HDM训练期间,通过药物抑制剂(PBP10)阻断FPR2信号通路可以抑制CCL17的增强反应(图4B),并阻止TNF的诱导(图4C),表明FPR2可能是主要的HDM受体,参与HDM驱动的巨噬细胞重编程。作者在HDM训练期间中和了TNF,从而抑制了HDM刺激的aMDM中CCL17的增强反应(图4E)。为了测试体内TNF信号传导的相关性,作者在致敏和攻击过程中向HDM致敏小鼠注射依那西普(图4F,顶部)。依那西普治疗减弱了来自HDM致敏小鼠的BMDM中CCL17的增加释放(图4H,左)。在体外HDM诱导的AAI期间,依那西普治疗可防止HDM再刺激来自HDM致敏小鼠的BMDM中CCL17和IL-6的增强反应(图4H,右;图4I)。TNF(LysM-cre Tnffl/fl)骨髓缺乏小鼠的致敏和挑战(图4F,底部)导致气道嗜酸性粒细胞减少(图4J)以及BMDM在基线和IL-4刺激后产生的CCL17减少(图4K),支持骨髓来源的TNF的作用在HDM诱导的AAI期间骨髓中的T2印记。总之,这表明在过敏原驱动的炎症过程中,通过FPR2诱导的自分泌TNF信号通路驱动促炎巨噬细胞的记忆。
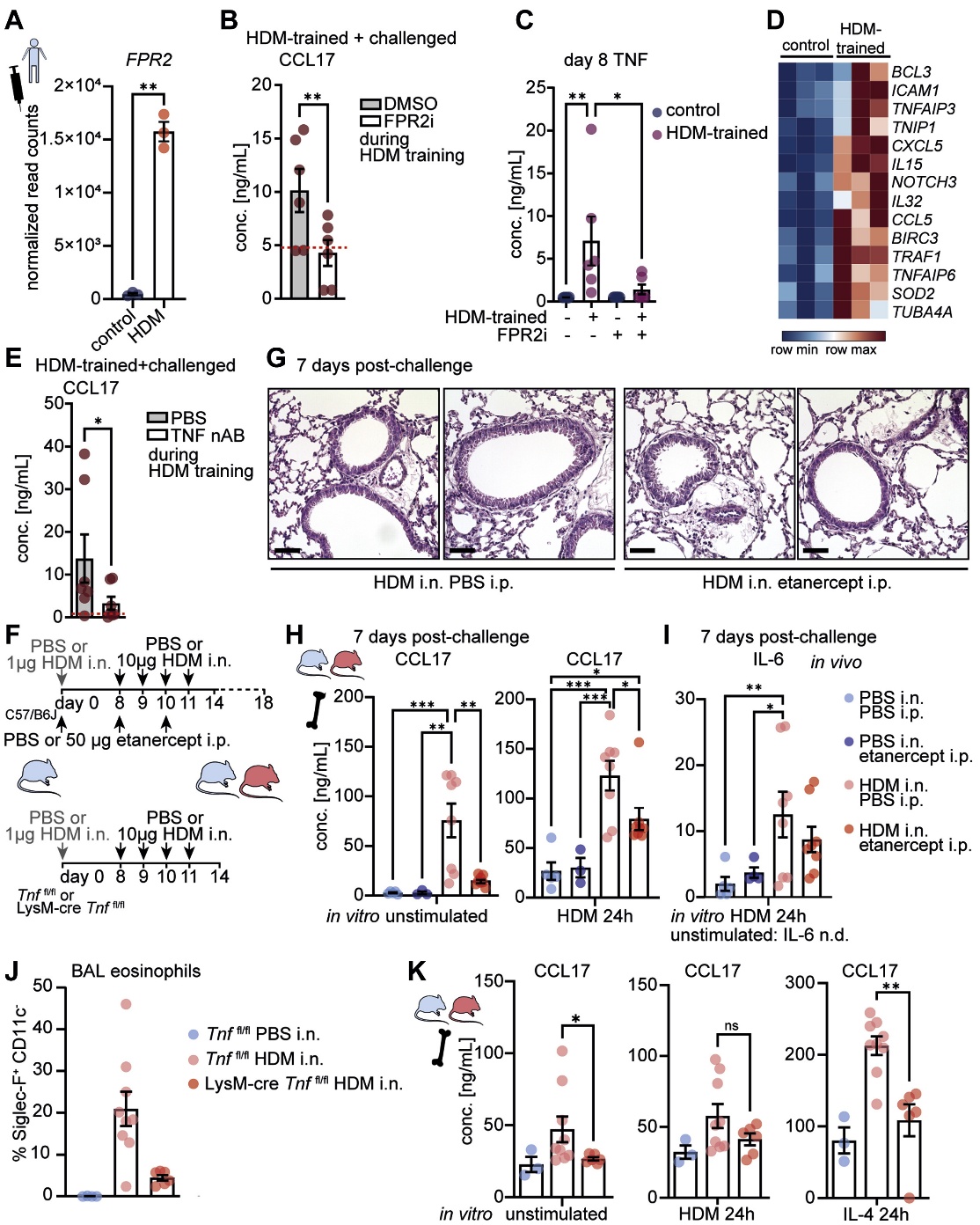
图4 在体外和体内,自分泌TNF信号通路介导HDM驱动T2印迹
HDM致敏小鼠的BMDM显示氨基酸和三羧酸循环中间体的输出增加,包括参与LT生物合成、M2活化和T2免疫的代谢产物(图5A、B和C)。2-HG是a-酮戊二酸依赖型双加氧酶活性的调节剂,其产生增加(图5D)。在BMDM中Arg1表达增加(图5E、F),表明TNF对T2炎症的负调节因子具有抑制作用。与HDM致敏的BMDM中2-HG增加一致,急性HDM暴露上调人aMDM中的2-HG(图5G)。在训练期间用2-HG替代HDM导致CCL17增强(图5H),但cysLT对HDM挑战的反应没有增强,部分模仿了HDM诱导的训练。在对巨噬细胞的急性激活过程中添加LPS时,2-HG可增强CCL17、IL1B和PTGS2的诱导(图5I),表明2-HG可增强aMDM的炎症激活。在BMDM中,添加2-HG会增加PGE2和CCL17的产生(图5J),表明2-HG参与T2印记。HIF-1α靶基因,以及HIF1A转录在人类巨噬细胞中由HDM诱导(图5K),但在HDM训练期间抑制HIF-1α只能部分消除CCL17的增强反应(图5L)。在训练过程中KDM1A抑制剂pargyline的应用抑制了CCL17和cysLT对HDM攻击的反应(图5M),这表明LSD1介导的重编程是HDM训练的表观遗传机制。
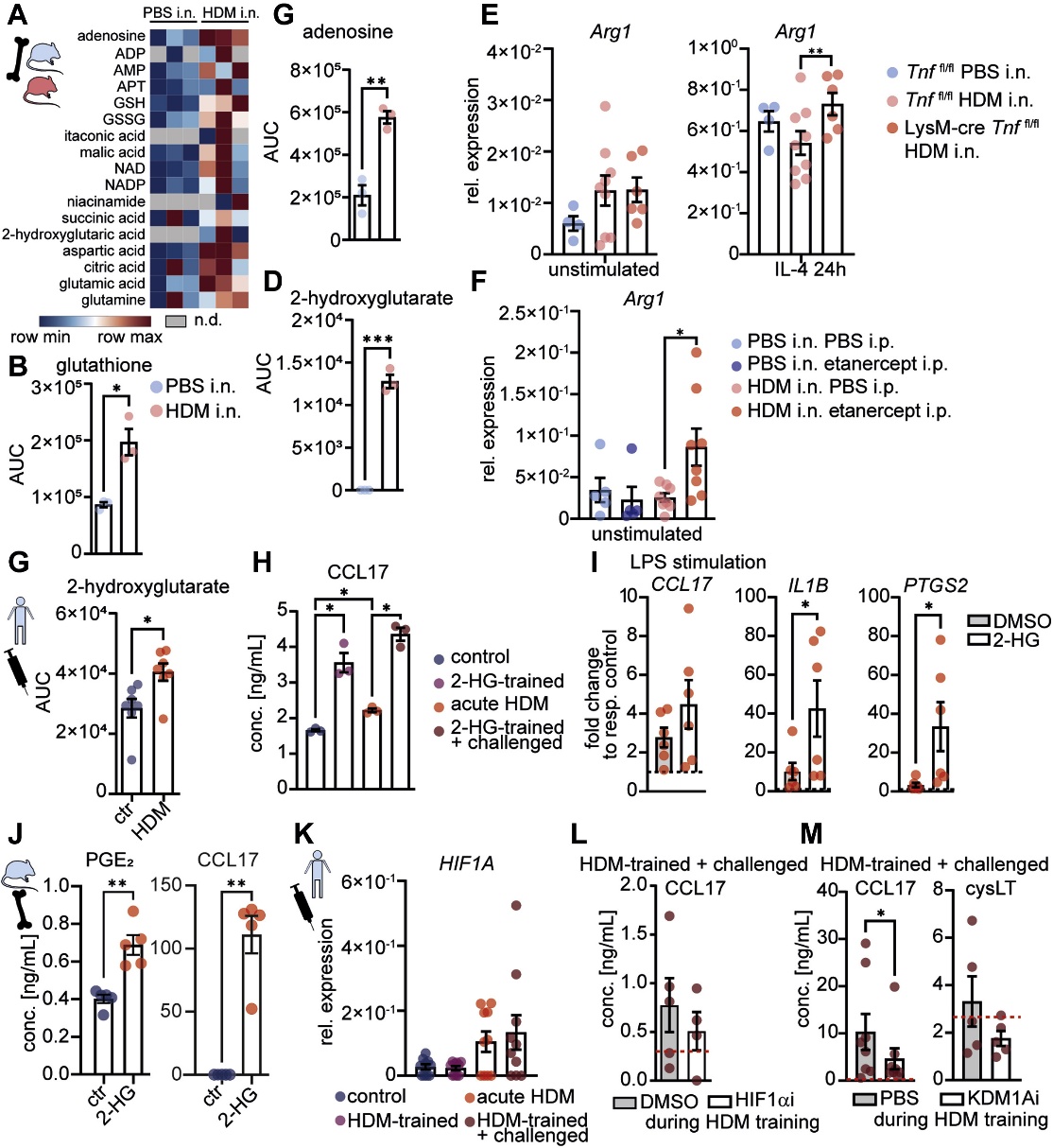
图5 2-HG和KDM1A介导的“代谢-表观遗传”crosstalk促进HDM诱导的巨噬细胞高反应性
6. 不同于传统的训练免疫,HDM诱导的巨噬细胞训练由PGE2/EP2信号驱动
为进一步识别TNF驱动的巨噬细胞代谢和表观遗传重编程的下游介质,作者在过敏原训练后(第8天)、休息5天后(第13天),以及HDM挑战后24小时(第14天),对HDM训练的aMDM进行了RNA测序(图6A和B)。HDM训练的aMDM在攻击时也合成了大量的前列腺素(图6D),并且参与PGE2生成的酶,特别是微粒体前列腺素E合酶1,持续诱导HDM训练和攻击(图6E和F)。与HDM诱导的环氧合酶2一起,这可能解释了HDM经历的人和鼠巨噬细胞中HDM触发的PGE2产生增加的原因(图6G和H)。依那西普治疗后HDM触发的COX-2(Ptgs2)诱导减少(图6I),进一步暗示了TNF驱动的重编程中的COX-2/PGE2途径。与野生型BMDM相比,EP2缺陷型BMDM表现出完整的HDM触发的TNF反应,但CCL17反应降低(图6J和K)。表明PGE2增强巨噬细胞的合成代表了TNF介导的先天免疫训练的下游机制。因此,HDM训练的巨噬细胞的花生四烯酸代谢增加有助于TNF介导的训练T2免疫。总之,这些数据确定了导致过敏性哮喘中持续T2炎症巨噬细胞重编程的代谢-表观遗传回路。
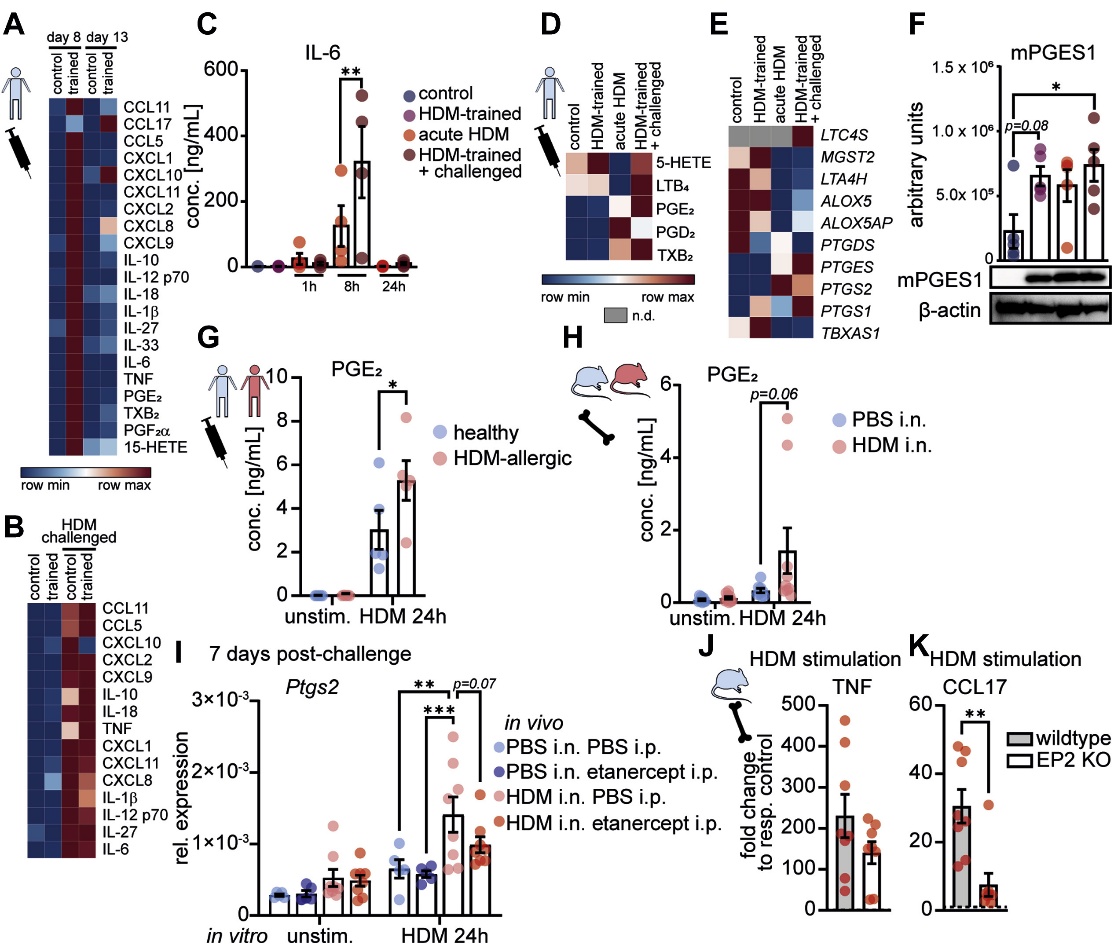
图6 不同于传统的训练免疫,HDM诱导的巨噬细胞训练由PGE2/EP2信号驱动
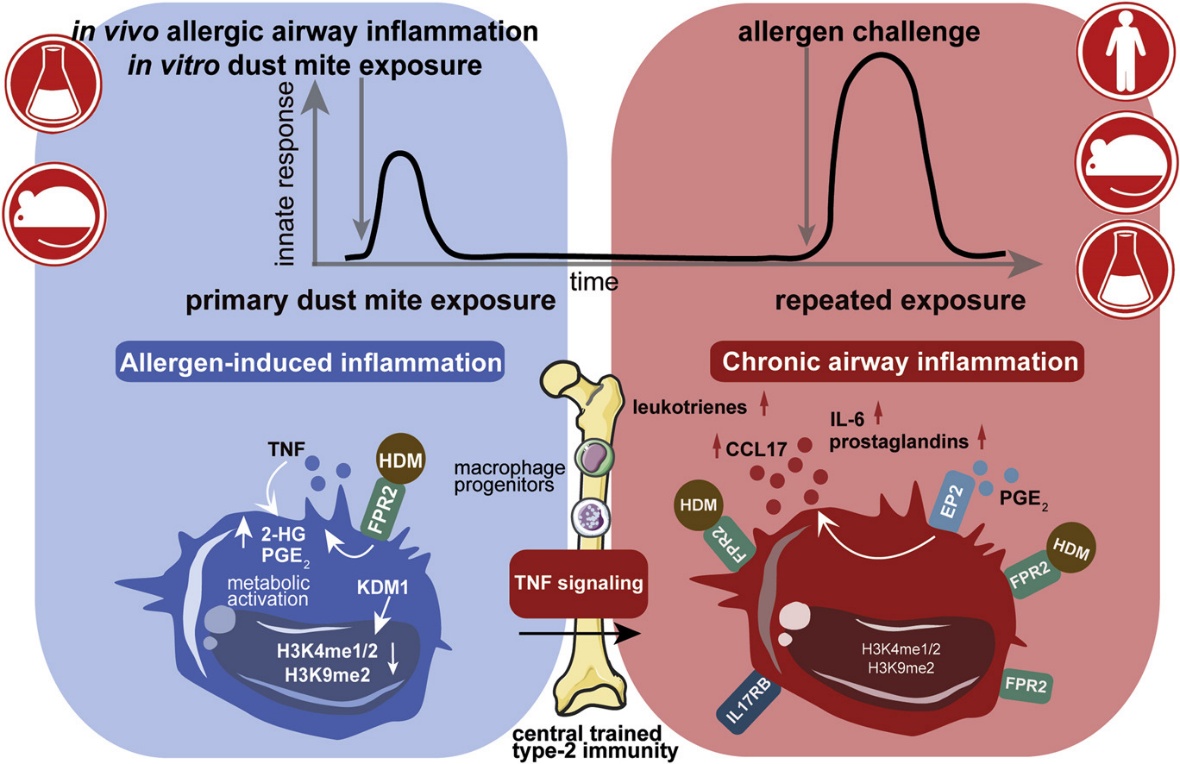
摘要图
结论:
过敏原引发的炎症驱动依赖于TNF的先天记忆,这可能会使慢性T2气道炎症持续存在并加剧,因此成为哮喘治疗的靶点。






