TRIM47加重脂多糖诱导的小鼠急性肺损伤
内皮激活在脓毒症诱导的急性肺损伤的发病机制中起着至关重要的作用,然而,详细的调控机制仍不清楚。在这里,我们报道了TRIM47在血管内皮细胞中高表达。TRIM47缺陷小鼠通过减轻肺部炎症,有效抵抗脂多糖(LPS)诱导的急性肺损伤(ALI)和死亡。在TNFα诱导的体外内皮激活过程中TRIM47上调。内皮细胞中TRIM47的敲除抑制多种促炎细胞因子的转录,减少单核细胞粘附和粘附分子的表达,并抑制内皮细胞中IL-1β和IL-6的分泌。相反,在TNFα刺激下,TRIM47的过表达促进炎症反应和单核细胞粘附。此外,TRIM47能够在内皮激活期间激活NF-κB和MAPK信号通路。TRIM47通过促进TNFα信号通路的关键成分TRAF2的K63连接泛素化而导致内皮细胞活化。总之,TRIM47作为一种新型的内皮细胞激活剂,通过增强TRAF2的K63连接泛素化,促进LPS诱导的肺部炎症和急性肺损伤,进而激活NF-κB和MAPK信号通路,触发内皮细胞的炎症反应。本文于2022年5月发表于“Signal Transduction and Targeted Therapy”(IF=38.104)上。
技术路线

结果
1)TRIM47在血管内皮细胞中高表达
我们首先检测了TRIM47在小鼠不同组织中的分布和表达。如图1a所示,免疫组织化学分析表明,TRIM47在肺、肾小管、心脏和附睾白色脂肪组织(eWAT)中高表达,在脑、胃、皮肤和结肠中中度表达,在肝脏、睾丸、脾脏和胸腺中低表达。实时PCR和western blot检测不同组织中TRIM47的mRNA和蛋白水平。与免疫组化结果一致,TRIM47 mRNA在肺、肾、心脏和eWAT中高表达(图1b),该蛋白在肺、肾脏、心脏、eWAT和睾丸中丰富(图1c)。接下来,我们检测了TRIM47在多种细胞类型中的表达。实时PCR结果显示,TRIM47在人脐静脉内皮细胞(HUVEC)、人脐静脉细胞系EA.hy926、人大脑微血管内皮细胞系hCMEC/D3和小鼠大脑微血管内皮细胞系bEnd.3中特异表达,但在人单核细胞系THP-1和小鼠巨噬细胞系RAW264.7中观察到低表达(图2a)。此外,通过western blot检测,内皮细胞表现出高水平的TRIM47蛋白(图2b)。特别是,免疫组化结果显示,如箭头所示,包括肺、脑、结肠和皮下组织在内的多个组织的血管内膜中有TRIM47的强烈表达(图2c)。与其他56个TRIM基因相比,TRIM47分别在HUVEC和hCMEC/D3中表现出适度表达(图2d,e)。这些结果表明,TRIM47在多种组织中广泛表达,并在血管内皮细胞中高表达。


2)TRIM47缺乏减轻LPS诱导的小鼠急性肺损伤和肺部炎症反应
为了研究TRIM47对全身炎症反应和器官损伤的影响,我们利用CRISPR/Cas9技术,去除TRIM47基因的所有外显子,获得TRIM47全面敲除小鼠(TRIM47- /−)(图3a)。通过小鼠尾部DNA的RT-PCR分析进一步确认敲除小鼠(图3b)。通过western blot分析检查肺组织提取物,结果表明TRIM47蛋白在纯合靶向等位基因中完全被消除(图3c)。脂多糖(LPS)诱导的休克模型广泛用于模拟人类感染性休克的症状,如全身炎症反应、多器官功能障碍综合征和内毒素休克。注射LPS 24小时后,TRIM47−/−小鼠的肺水肿减轻(图3d)。此外,TRIM47缺乏可提高LPS诱导后小鼠的存活率(图3e)。HE染色显示正常条件下WT与TRIM47−/−小鼠的肺组织学无明显差异。WT小鼠的肺部出现显著的组织损伤,包括中性粒细胞浸润、肺泡壁增厚、出血、肺泡水肿和肺泡破裂(图3f)。TRIM47缺乏显著减轻了LPS诱导的TRIM47−/−小鼠的组织学变化。TRIM47−/−小鼠中促炎细胞因子mRNA表达量明显低于WT小鼠(图3g),同时,TRIM47缺乏也显著降低了LPS诱导的小鼠血清IL-1β、IL-6和TNFα水平的升高(图3h)。这些结果表明,在LPS诱导期间,TRIM47缺乏显著减轻了急性肺损伤和肺部炎症。

3)内皮细胞炎症刺激可提高TRIM47的表达
我们建立体外模型以进一步阐明内皮TRIM47在炎症和ALI中的作用。我们首先研究了外源刺激对TRIM47表达的影响。结果表明,TRIM47的mRNA表达在LPS(图4a)和H2O2(图4b)的作用下显著上调。自TNFα刺激后2小时起,TRIM47的表达显著增加,并在12小时达到峰值(图4c)。TRIM47蛋白水平也因炎症或氧化应激而上调(图4d-f)。免疫细胞化学分析证实TRIM47主要位于HUVEC的细胞核内。TNFα刺激1小时后,在胞浆和细胞核中发现TRIM47的表达增加,并持续8小时(图4g)。LPS在1小时和8小时时间点诱导细胞质TRIM47荧光增加(图4h)。此外,通过western blot分别测定TRIM47在细胞质和细胞核部分的定位。结果表明,细胞核中含有显著比例的TRIM47,其在TNFα刺激下显著上调。TNFα刺激后,细胞质TRIM47含量也增加(图4i)。LPS诱导细胞质TRIM47略微增加,但在细胞核中没有显著变化(图4j)。总之,TRIM47的表达因炎症刺激而升高,可能在内皮细胞的炎症反应中发挥作用。

4)TRIM47促进TNFα诱导的内皮细胞活化
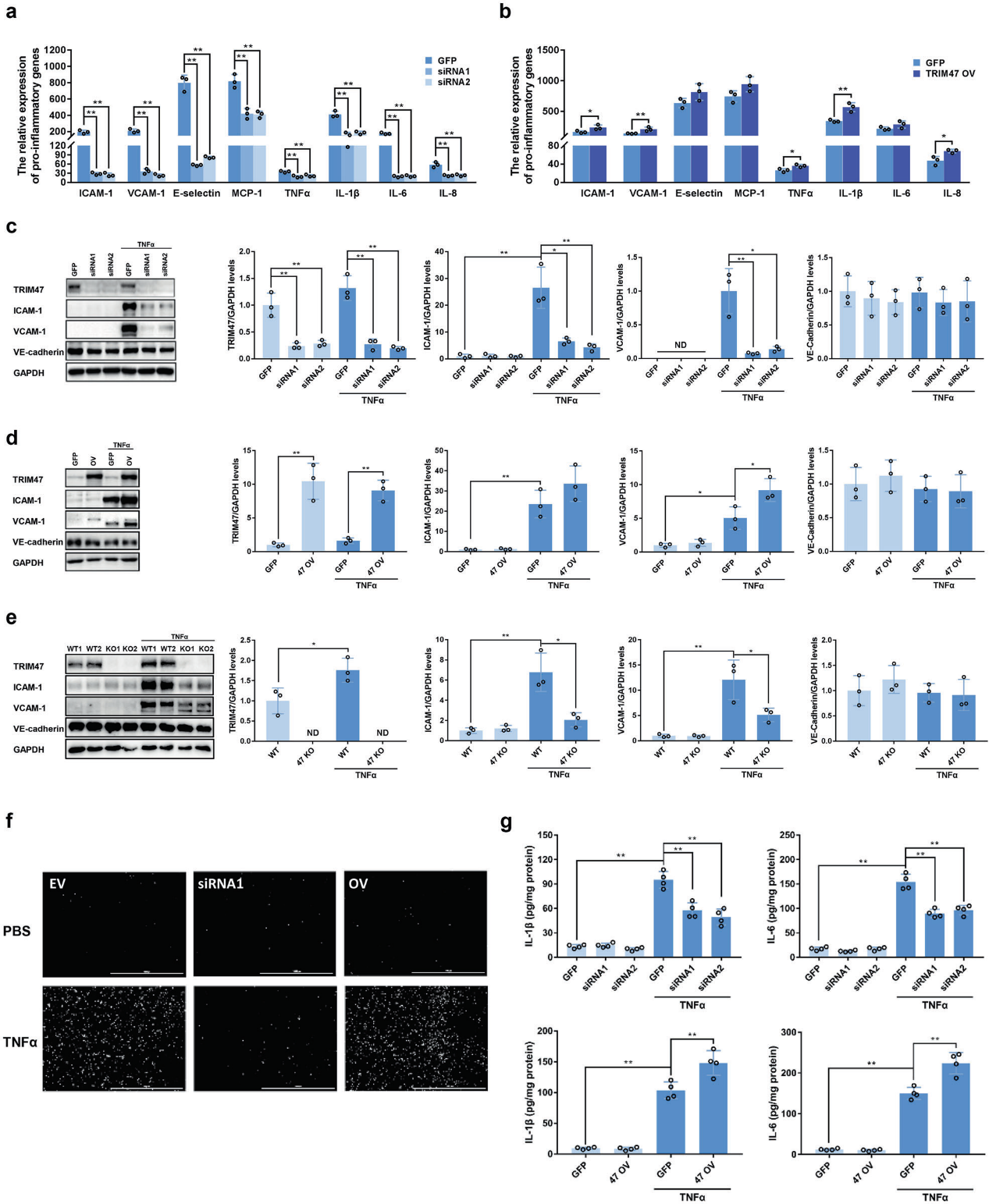
我们构建siRNA和过表达载体,探讨TRIM47在TNFα诱导的内皮细胞激活中的作用。TIRM47的敲除显著降低了TNFα诱导的多种粘附分子(如ICAM-1、VCAM-1、E-selectin和MCP-1)的mRNA表达,以及促炎细胞因子(如TNFα、IL-1β、IL-6和IL-8)在HUVEC中的表达(图5a)。相反,TRIM47的过表达显著增强了这些分子的mRNA水平(图5b)。Western blot结果表明,敲除TRIM47显著抑制TNFα诱导的ICAM-1和VCAM-1的表达(图5c),而TRIM47过表达促进了这些蛋白质的表达(见图5d)。TRIM47对粘附分子表达的影响在野生型和TRIM47-KO小鼠的肺微血管内皮细胞中得到进一步证实。正如所料,TNFα诱导的ICAM-1和VCAM-1的升高在TRIM47缺陷的肺微血管内皮细胞中被显著抑制(图5e)。此外,TRIM47的敲除显著降低了TNFα诱导的THP-1细胞对HUVECs的粘附,但过表达TRIM47则有相反的效果(图5f)。TRIM47的敲除也抑制了TNFα诱导的促炎细胞因子IL-1β和IL-6的分泌。相比之下,过表达TRIM47促进了TNFα诱导的促炎细胞因子的产生(图5g)。这些结果表明,TRIM47是TNFα诱导的内皮细胞激活的调节因子。
5)TRIM47激活NF-κB和MAPK促炎信号通路
我们研究了包括NF-κB和MAPK在内的潜在信号通路在TRIM47介导的内皮激活中的作用。结果表明,TRIM47的敲除显著抑制IκBα、IKKα/β和p65亚单位的磷酸化,并阻止IκBα的降解(图6a),而TRIM47过表达促进了NF-κB信号通路的激活(图6b)。TRIM47敲除抑制JNK和p38 MAPK信号通路的激活,但对ERK没有明显影响(图6c)。TNFα诱导后,TRIM47过表达进一步激活JNK和p38信号通路(图6d)。这些结果表明,TRIM47介导的内皮细胞激活可能与NF-κB和MAPK信号通路的激活有关。

6)TRIM47促进K63连接的TRAF2泛素化
新的证据表明,TRIM蛋白介导K48或K63连接泛素化,激活NF-κB信号通路,以响应外源性刺激。因此,我们分析了参与内皮激活的TRIM47泛素化模式。结果表明,TRIM47的过表达明显增强了K63连接的泛素化,而不是K48(图7a)。TRAF2是TNFR信号复合物中的关键衔接分子,促进下游信号级联,如NF-κB和MAPK激活,而TRAF6是IL-1受体/TLR信号的主要转导子。据报道,K63连接的多泛素链可以连接到TRAF2,作为招募TAK1、TAB1和TAB2的支架。活性TAK1进一步磷酸化MAPK和IKK复合物,以启动MAPK和NF-κB级联。因此,我们检测了参与该信号通路的TRIM47的可能结合蛋白。如图7b所示,TRIM47与TRAF2而非TRAF6结合。TRIM47不与下游蛋白TAK1、IKKγ和IκBα发生相互作用。用TRIM47和TRAF2抗体进行的共免疫沉淀分析进一步证实内源性TRIM47与TFAF2参与了HUVECs中K63连接的泛素化(图7c,d)。这些结果表明,TRIM47可能通过增强TRAF2的K63连接泛素化来调节NF-κB和MAPK的激活。

结论:我们发现TRIM47是一种新型的内皮细胞激活剂,在ALI期间,它通过激活内皮细胞TRAF2-MAPK/NF-κB促炎轴介导炎症反应并促进炎症和组织损伤。TRIM47可能是内皮炎症和ALI药物开发的一个有吸引力的靶点。
参考文献:
Qian Y, Wang Z, Lin H, Lei T, Zhou Z, Huang W, Wu X, Zuo L, Wu J, Liu Y, Wang LF, Guan XH, Deng KY, Fu M, Xin HB. TRIM47 is a novel endothelial activation factor that aggravates lipopolysaccharide-induced acute lung injury in mice via K63-linked ubiquitination of TRAF2. Signal Transduct Target Ther. 2022 May 6;7(1):148. doi: 10.1038/s41392-022-00953-9.






