建立基于肿瘤浸润免疫细胞程度和分子分型的肺鳞癌免疫治疗疗效预测模型
近日,有研究基于肿瘤浸润免疫细胞程度和分子分型,建立了一种肺鳞癌免疫治疗疗效预测模型,该研究发表在《Journal of Translational Medicine》,IF: 8.44。
技术路线:

主要研究结果:
1. NMF分型将training set分为低免疫细胞浸润型和高免疫细胞浸润型
以TCGA数据库中501例肺鳞癌(LUSC)患者的数据作为训练集,根据单样本基因集富集分析(GSEA)评估的瘤浸润免疫细胞(TIICs)程度,采用非负矩阵分解(NMF)进行分组。结果发现,当rank值为2-3时,遗传分型指数下降幅度最大(图1A)。因此,选择秩值2,将患者分为低免疫细胞浸润型(cluster 1:C1)和高免疫细胞浸润型(cluster 1:C2)。热图还显示,当类型数量限制在两种时,training set的样本可以很好地区分(图1B)。此外, tSNE降维(图1C)和 PCA(图1D)表明,C1和C2具有较好的识别能力,表明该分类方法的可行性。在C1和C2患者中,执行抗肿瘤免疫和执行促肿瘤免疫的细胞类型得分均存在显著正相关(图1E),C1患者的相关系数为0.86 (P=1.2e−56),C2患者的相关系数为0.83 (P=2.8e−82)。C2患者的抗肿瘤免疫(p<0.0001)和促肿瘤免疫(p<0.0001)富集评分显著高于C1患者(图1F)。此外,28种免疫细胞的富集分数存在显著差异,其中C1型显著低于C2型(图1G)。这些结果提示LUSC的C1型可视为低免疫细胞浸润的“冷肿瘤”,而C2型则倾向于高免疫细胞浸润的“热肿瘤”。这些结果表明,NMF分型对training set中的免疫细胞浸润程度有较强的区分能力。
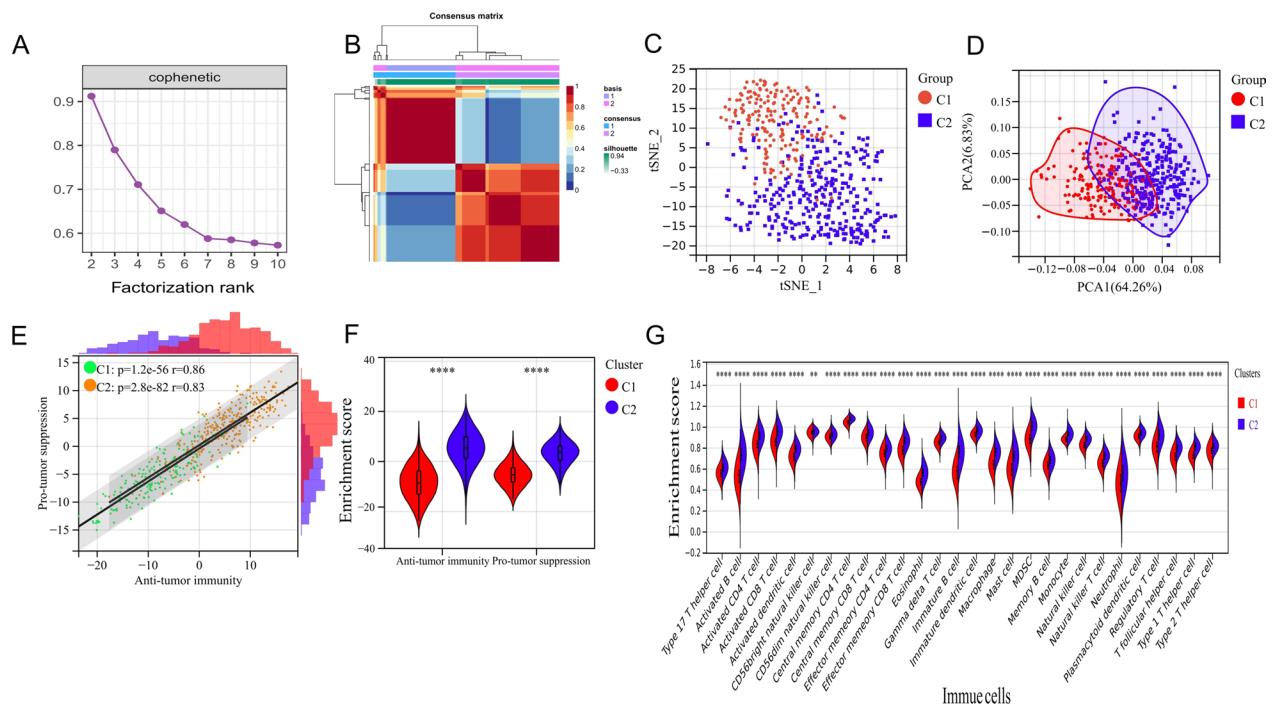
图1 NMF分型将训练集分为低免疫细胞浸润型和高免疫细胞浸润型
2. NMF分型的临床病理特征
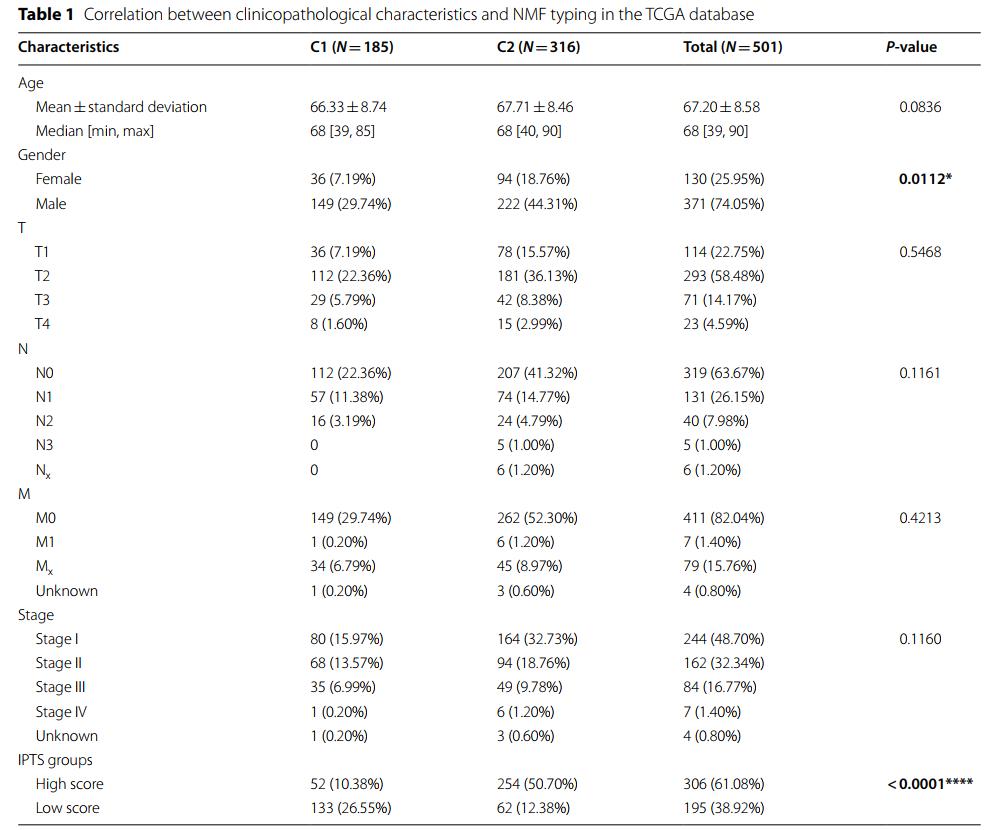
根据NMF分型,对training set中患者的几个重要临床病理特征进行了差异分析,包括年龄、性别、TNM分期和临床分期。结果仅显示两种亚型在性别上有显著差异。C1型患者中女性36例(7.19%),显著低于C2型患者94例(18.76%)(P=0.0112)。各亚型间的其他临床病理特征如年龄和分期无差异(表1)。随后的生存分析显示,两种亚型间LUSC患者的OS (P=0.74,图2A)和DFS (P=0.5,图2B)均无显著差异。
3. NMF类型间的DEGs主要参与免疫系统调节
通过差异分析,与C2型相比,C1型中有468个基因显著上调,2179个基因显著下调(图2C)。GO富集分析显示,DEGs主要富集于以下生物过程:免疫系统过程(48.50%)、免疫应答(42.02%)、免疫系统调节过程(27.84%)等(图2D)。从细胞成分来看,主要富集在胞外区(37.87%)、膜内成分(15.40%)和膜内成分(14.78%)等(图2E)。而在分子功能方面,这些基因主要富集在信号受体活性(16.61%)、分子换能器活性(16.61%)和信号受体结合(15.25%)等方面(图2F)。KEGG富集分析显示,DEGs主要参与细胞因子受体相互作用(12.75%)、趋化因子信号通路(8.55%)、病毒蛋白、病毒蛋白与细胞因子及细胞因子受体相互作用(7.46%)等途径(图2G)。
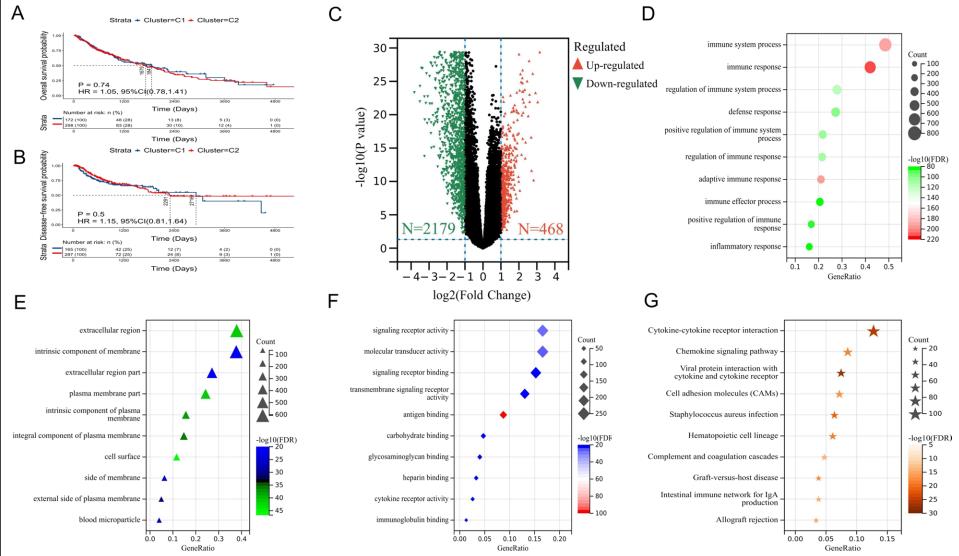
图2 NMF类型间差异表达基因(DEGs)主要参与免疫系统调节
4. 构建17个基因的免疫浸润预测模型
虽然NMF分型能较好地区分TIICs的丰度,但不能预测患者的生存预后。因此,需要在此前提下建立新的预测模型。取DEGs、影响患者OS和DFS的基因和两个验证集测序的基因(图3A)这5个基因集的交集,共得到20个基因用于构建预测模型(图3A)。通过LASSO回归,共筛选出17个具有回归系数的基因(图3B)。另外,从图3C可以看出,在考虑调优参数的最小值(λ)时,模型曲线下的ROC 面积 (AUC)值较大。通过构建nomogram预测模型对C2型患者的预测效果可视化(图3D)。当IPTS=0.6369时,C1型和C2型患者患病的概率均为50%,且当IPTS值超过0.6369时,C2型患者患病的概率更高。此外,在1000次重复条件下,校准曲线(图3E)的平均绝对误差(MAE)为0.062,曲线拟合良好,预测效果良好。由该模型可以看出,回归系数< 0的基因共有9个,可以作为C1型的基因签名;8个回归系数 > 0的基因可作为C2型的基因标记(图3F),从而在一定程度上实现了分子分型。
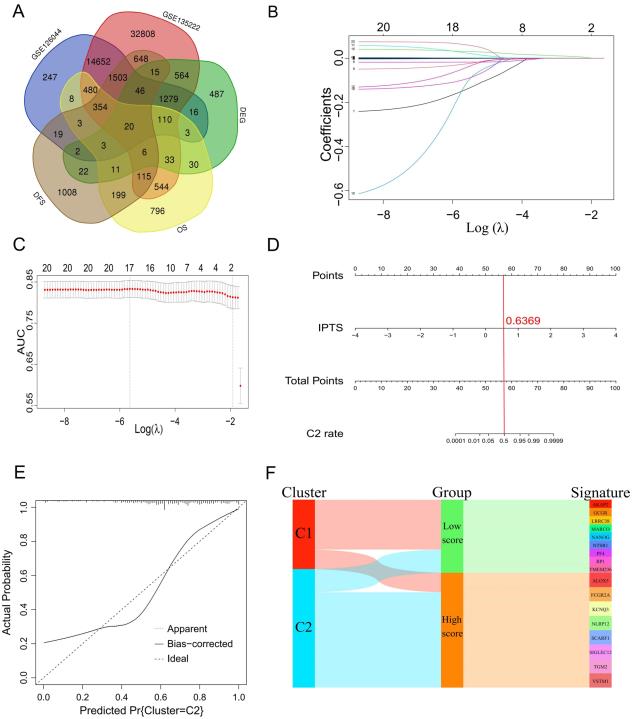
图3构建基于17个基因的免疫浸润预测模型
5. 基于IPTS预测模型的分子分型可替代NMF分型
通过分析并绘制ROC曲线,AUC为0.82 (95% CI= 0.86-0.79)(图4A),最大约登指数对应的截断值在nomogram中预测概率为50%,即0.6369。此时ROC曲线预测敏感性为0.8038,特异性为0.7189,提示IPTS模型能较好预测LUSC患者的NMF分型。C2型患者IPTS显著高于C1型患者(P=0.0026,图4B), C2型患者IPTS高于C1型患者数量显著高于C1型患者(P<0.0001,表1)。初步认为基于IPTS的分子分型可以很好地预测NMF分型。为了进一步明确IPTS亚型分型是否可以替代NMF分型,还进行了差异分析和相关分析。如图4C所示,高IPTS患者的抗肿瘤免疫(P<0.0001)和促肿瘤免疫(P<0.0001)富集分数显著高于低IPTS患者。此外,在高IPTS组和低IPTS组中,抗肿瘤免疫和促肿瘤免疫的富集分数之间均存在显著相关性(图4D)。高分组相关系数为0.86 (P=5.1e−89),低分组相关系数为0.90 (P=1.8e−73)。此外,除CD56 bright NK细胞外(P=0.07),高IPTS组TIICs的富集分数显著高于低IPTS组(P <0.0001,图4E)。因此,基于IPTS的分子分型可替代NMF分型,具有潜在的临床应用治疗价值。由于预测模型是基于影响患者OS和DFS的基因构建的,因此通过生存分析来评估该模型的预后预测价值。此外,作者又评估了该模型是否能够弥补NMF分型缺失的预后预测功能。结果显示,当以最优截断值代替ROC曲线的截断值时,低IPTS组的OS (HR=1.06, 95% CI= 0.98-1.16, P=0.03,图4F)和DFS (HR=1.12, 95% CI= 1.03-1.20, P=0.0027,图4G)均优于高IPTS组。该预测模型能在一定条件下预测患者的预后。
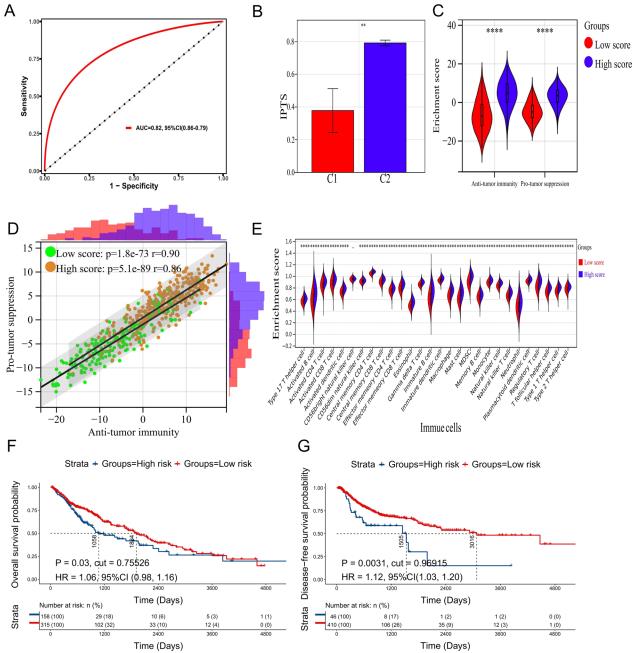
图4基于IPTS预测模型的分子分型可替代NMF分型
6. 免疫浸润预测模型预测免疫治疗的免疫疗效和5种抗肿瘤药物的潜在治疗价值
在接受抗PD-1抗体免疫治疗的NSCLC队列(GSE126044)中,对免疫治疗有反应的患者的IPTS明显高于对免疫治疗无反应的患者(P=0.0032)(图5A),ROC曲线下面积为0.95 (95% CI= 1.00-0.84),而PD-L1的ROC曲线下面积为0.73 (95% CI= 0.99-0.46,图5D),表明在本数据集中,IPTS对免疫治疗的疗效有很大的预测作用。在另一个NSCLC队列(GSE135222)中,受益于免疫治疗的患者IPTS高于未受益于免疫治疗的患者(P=0.0451)(图5B), ROC曲线下面积为0.77 (95% CI= 0.96-0.58),也大于PD-L1的0.69 (95% CI= 0.90-0.48,图5E),提示IPTS对该队列的免疫治疗疗效具有良好的预测价值。此外,该数据集报告了患者PFS的预后信息。取最佳截断值(IPTS=−2.13),高IPTS患者免疫治疗后的PFS优于低IPTS患者(HR=0.72, 95% CI= 0.5-1.04, P=0.0059,图5G),也表明免疫治疗疗效有较好的预测价值,对生存预后有一定的预测价值。有反应组患者的IPTSE明显高于无反应组(P=0.0325)(图5C), ROC曲线下面积为0.88 (95% CI= 1.00-0.66),大于PD-L1的0.64 (95% CI= 1.00-0.26,图5F)。取最佳截断值(IPTS=−4.05),高IPTS患者经免疫治疗后的PFS优于低IPTS患者(P=0.0403,图5H)。由此可以证实,所构建的免疫浸润预测模型对免疫疗效具有预测价值,即高IPTS患者的免疫治疗效果可能更好。
从上述分析来看,低IPTS患者不太可能从免疫治疗中获益。对于这一亚型的患者,作者通过GDSC数据库初步筛选了其他可能有疗效的抗肿瘤药物。分析结果显示,在LUSC细胞系中,高IPTS组的acetalax (P=0.0168)、AZD2014 (P=0.0416)、GSK2606414 (P=0.0145)、obatoclax mesylate (P=0.0061)、VSP34_8731 (P=0.0163) 5种抗肿瘤药物的IC50均高于低IPTS组(图5I)。此外,从热图(图5J)可以看出,高IPTS组的IC50值普遍高于低IPTS组,说明低IPTS组患者对这五种药物可能更为敏感。
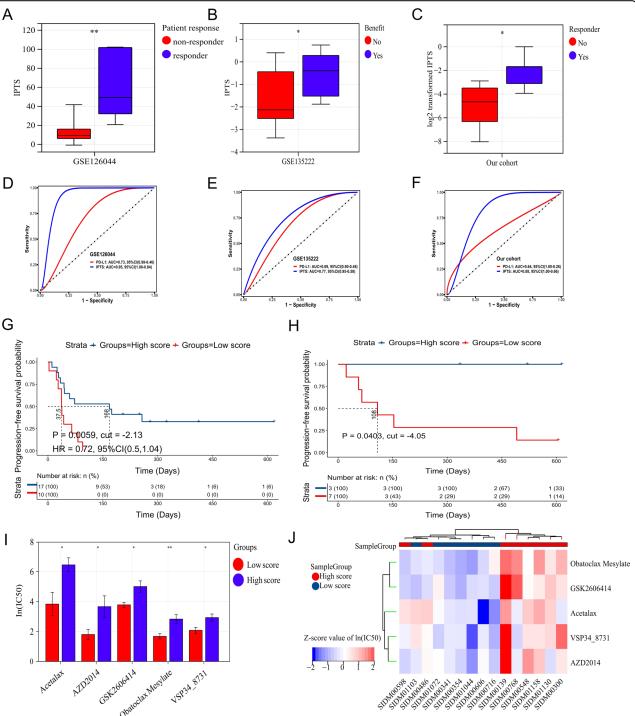
图5免疫浸润预测模型预测免疫治疗相对于5种抗肿瘤药物的免疫疗效
7. IPTS与免疫微环境评分和免疫相关基因特征表达呈正相关
采用IPTS分子分型分组分析法评估训练集中501例LUSC患者的免疫微环境评分。结果显示,高IPTS组间质评分(p0.0001)、免疫评分(p0.0001)和ESTIMATE评分(p0.0001)均显著高于低IPTS组(图6A),提示高IPTS组间质细胞水平和免疫细胞浸润水平高于低IPTS组。同时,IPTS分子分型相关分析显示,只有免疫评分在低IPTS组中具有统计学意义,基质评分和ESTIMATE评分在低IPTS组无显著差异,提示三种免疫微环境评分在高IPTS组中主要与IPTS呈正相关。IPTS分子分型分析结果显示,高IPTS组的趋化因子、受体、MHC分子、免疫抑制剂、免疫刺激因子富集分数明显高于低IPTS组(图6B)。分析四种免疫抑制剂CTLA-4、PD-1 (PDCD1)及其两种配体PD-L1 (CD274)和PDL-2 (PDCD1LG2)在训练集中IPTS组间表达值的差异。结果显示,CTLA-4、PD-1、PD-L2在高IPTS组表达明显高于低IPTS组,PD-L1表达不显著(P=0.22)(图6C)。IPTS分子分型相关分析结果显示,在低评分组PD-1表达与IPTS呈显著负相关(图6H),而其他三种免疫抑制剂的表达均无统计学意义。在高评分组,四种免疫抑制剂CTLA-4、 PD-1、PD-L1、PD-L2与IPTS呈正相关(图6G-J)。上述结果在一定程度上进一步为高IPTS患者获得更好的免疫治疗效果提供了理论依据。

图6 IPTS与免疫微环境评分和免疫相关基因签名表达呈正相关
8. 高IPTS参与免疫相关信号通路
GSEA结果显示,IPTS主要与帕金森病、氧化磷酸化、亨廷顿病、阿尔茨海默病、剪接体、同源重组、核苷酸切除修复等相关(图7A)。相反,高IPTS主要与细胞因子-细胞因子受体相互作用、趋化因子信号通路、自然杀伤细胞介导的细胞毒性、白细胞跨内皮迁移、利什曼原虫感染、细胞粘附分子、JAT - STAT信号通路等有关(图7B)。这些结果表明,低IPTS主要参与疾病、遗传和代谢相关信号通路,而高IPTS主要参与免疫相关信号通路。
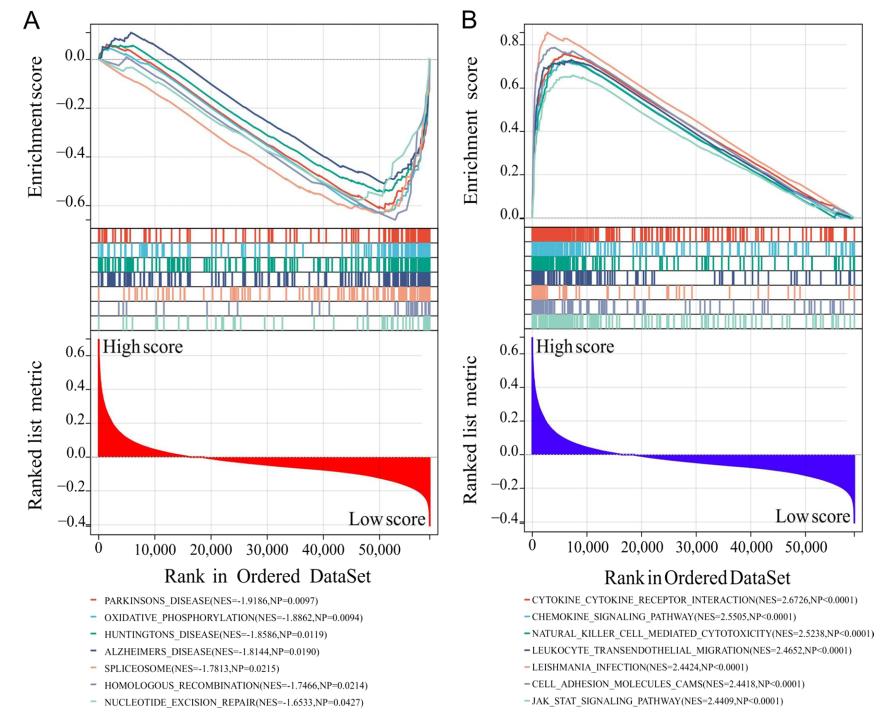
图7高IPTS参与免疫相关信号通路
结论:
综上所述,基于TCGA数据库的生物信息学分析,构建了包含17个基因的LUSC患者免疫治疗效果预测模型。在GEO数据库的两个独立队列中验证了该模型的预测效果。IPTS分子分型与肿瘤免疫细胞浸润程度呈正相关,与免疫治疗疗效呈正相关,具有潜在的预后价值。该研究为预测LUSC免疫治疗的疗效提供了一种新的方法,具有潜在的临床前景.
参考文献:
Yang L, Wei S, Zhang J, Hu Q, Hu W, Cao M, Zhang L, Wang Y, Wang P, Wang K. Construction of a predictive model for immunotherapy efficacy in lung squamous cell carcinoma based on the degree of tumor-infiltrating immune cells and molecular typing. J Transl Med. 2022; 20(1):364. doi: 10.1186/s12967-022-03565-7.






