17分外泌体的新角色——限制CD8+ T细胞的免疫浸润
使用抗PD-1抗体的免疫检查点阻断治疗已被证明对许多类型的癌症有效。CD8+ T细胞肿瘤浸润缺乏与患者对抗PD-1治疗反应差有关。理解肿瘤浸润是如何调控的是提高治疗效率的关键。本研究发现HRS磷酸化驱动PD-1+免疫抑制外泌体的分泌并限制CD8+ T细胞的肿瘤浸润。本研究于2022年6月发表在《Nature Communications》IF:17.694期刊上。
技术路线

主要实验结果
1、ERK磷酸化HRS限制CD8+ T细胞浸润至肿瘤
肿瘤细胞分泌的外泌体会影响肿瘤微环境和免疫系统。鉴于HRS在外泌体发生中扮演着重要作用,所以作者通过致癌激酶检测了HRS在癌细胞中的潜在磷酸化。使用MS分析了转移性黑色素瘤细胞系WM9来源纯化的HRS,鉴定到一个磷酸化的肽,即S345(图1a)。S345与ERK共识磷酸化位点匹配。为了验证ERK在S345磷酸化HRS,突变了这个位点。结果显示突变体废除了HRS被抗ERK磷酸化底物抗体识别的能力,而突变对照组则没有废除这种能力(图1b)。在HEK293T细胞中构建并纯化Flag标记的HRS然后将其和重组持续性激活ERK(CA-ERK)或激酶失活ERK(KD-ERK)孵育,结果显示是CA-ERK而不是KD-ERK磷酸化HRS(图1c),而使用ERK抑制剂SCH772984可以阻断HRS磷酸化(图1d),表明ERK可以直接磷酸化HRS。
基于HRS氨基酸序列,利用HRS磷酸化肽制备了一种抗体,使其能够特异性识别S345位点磷酸化的HRS(p-HRSS345)。使用这种抗体利用黑色素瘤患者组织芯片检测了p-HRSS345和CD8+ T细胞在肿瘤组织中的分布,结果显示与低水平p-HRSS345肿瘤比较,具有高水平的p-HRSS345的肿瘤其CD8+ 肿瘤浸润淋巴细胞(TILs)水平较低(图1e-f)。CD8+ TILs数量和p-HRSS345水平显著负相关(图1g),而和HRS总蛋白不相关(图1h-i)。
在个体肿瘤中,p-HRSS345异质性表达,CD8+ TILs在p-HRSS345高表达区域大幅减弱(图1j)。IHC显示在肿瘤-基质交界处,当p-HRSS345水平较高时,较少的CD8 + T细胞迁移到肿瘤组织中(图1k-l)。总之,这些结果表明HRSS345磷酸化与黑色素瘤的CD8 + T细胞空间限制有关。

2、HRS磷酸化抑制TILs并诱导抗PD-1治疗抗性
CD8+ T细胞浸润和抗肿瘤免疫有关。为了探究HRS磷酸化是否与肿瘤细胞免疫抑制有关,构建了HRS野生型(HRSWT)和HRS磷酸化缺失(HRSS345A)和HRS磷酸化模拟突变(HRSS345D)。流式显示与HRSWT或HRSS345A比较,HRSS345D组肿瘤中PD-1 + CD8 + TILs的数量显著下降(图2a)。与HRSS345A比较,表达Ki-67和GranzymeB的CD8 + TILs的数量在HRSWT和HRSS345D中显著下降(图1b)。这些提示HRS抑制功能性CD8 + TILs的浸润。
接下来探究HRS是否影响表达不同HRS突变体的黑色素瘤细胞的PD-1阻断治疗效果。结果显示PD-1有效抑制表达HRSS345A的肿瘤生长,但这种抑制作用在HRSWT组减弱,在HRSS345D组几乎被完全非常(图2c)。这提示HRS诱导的免疫抑制阻碍了PD-1阻断治疗的效果,所以造成了一种可能,即抑制HRS磷酸化可增强PD-1阻断的治疗效果。为了验证这种可能性,将抗PD-1和ERK抑制剂BVD-523联合使用处理B16F10肿瘤,该肿瘤与YUMMER1.7黑色素瘤不同,其已知是对PD-1阻断耐受的。结果显示BVD-523增强了表达HRSWT组的CD8 + TILs的数量,稍微提高了HRSS345A组的T细胞浸润,但不影响HRSS345D组,其是由于模拟的HRS磷酸化不能被ERK抑制改变;而BVD-523和PD-1联合治疗则导致HRSWT和HRSS345A组显著的肿瘤抑制,但不影响HRSS345D组(图2d-f)。这些结果表明BVD-523通过抑制HRS磷酸化发挥作用。

图2 HRSS345磷酸化阻断CD8+ T细胞浸润和降低抗PD-1治疗效率
3、HRS磷酸化导致PD-L1选择性富集至外泌体
接下来作者采用MS分析了表达不同HRS突变体的WM9细胞中分离出的sEVs的蛋白组成(图3a-b)。HRSS345A组和HRSS345D组的sEVs的差异蛋白如图3b-c所示,发现相比于HRSS345A组,PD-1在HRSS345D组的sEVs中显著上调,WB实验证实了这种上调趋势(图3d)。此外,BVD-523抑制HRS磷酸化,这减少了PD-L1加载至sEVs中(图3e)。表明PD-L1通过HRS磷酸化被特异性装载至外泌体。
此外,与HRSWT组比较,PD-1和MVEs(multivesicular endosomes)的共定位在HRSS345A组显著下降在HRSS345D组显著增加(图3f-g)。免疫共沉淀表明PD-1和HRSS345D相互作用,但这种相互作用在S245突变后废除,作为对照S245突变不影响HRS和STAM的相互作用(图3h)。这些结果表明ERK介导的HRS磷酸化促进PD-1募集至MVEs。映射实验表明,缺乏泛素化相互作用基序(UIM)(a.a. 275-777)的HRS保留了与PD-L1结合的能力,而进一步删除a.a. 276-478则废除了这种相互作用(图3i-j)。鉴于S345位于PD-L1结合区域,因而这些结果表明,S345磷酸化特异性调节了泛素独立排序。
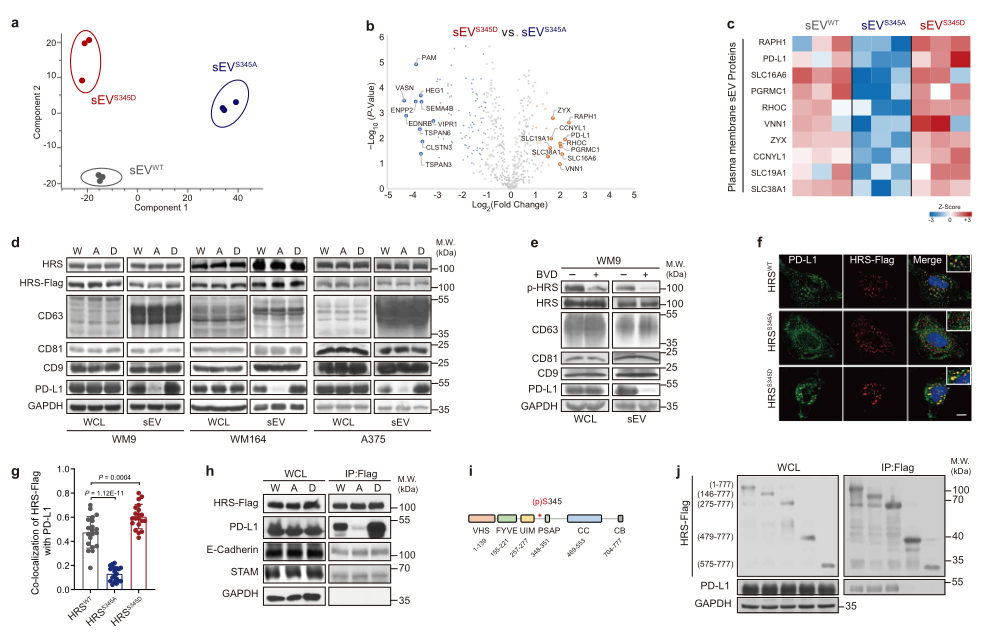
图3 HRSS345磷酸化选择性富集PD-L1至sEVs
4、HRSS345D来源的sEVs有效抑制CD8+ T细胞浸润
将不同HRS突变体来源的sEVs处理肿瘤小鼠,检测肿瘤进展,结果显示表达PD-1的HRSWT和HRSS345D来源的sEVs处理显著促进PD-1敲除C57BL/6小鼠的肿瘤生长,而不影响Rag2 −/−小鼠(图4a-b)。CD8+ T细胞的肿瘤浸润也被HRSWT和HRSS345D来源的sEVs显著抑制(图4c)。此外,与PBS和HRSS345A组比较,HRSWT和HRSS345D来源的sEVs显著抑制CD8+ T细胞的增殖和激活(图4d-e),以及细胞毒性(图4g)。随后采用RPPA检测了不同HRS突变体来源的sEVs处理的CD8+ T细胞的蛋白表达谱,发现HRSWT和HRSS345D来源的sEVs显著下调T细胞增殖和激活相关蛋白的表达,如FOXM1,urora A,ASNS,Cyclin-B1(图4f)。
由于作者此前通过TEM观察到肿瘤组织提取的sEVs经常和ECM纤维结合,所以作者猜想sEVs与肿瘤细胞周围的ECM结合来阻断T细胞的浸润。作者将CD8+ T细胞转移到Rag2−/−小鼠中,并注射PD-L1-KO B16F10细胞与sEVs和Matrigel混合物,该细胞含有ECM成分,经常用于体外模拟ECM。结果发现转移的CD8+ T细胞浸润被HRSWT和HRSS345D来源的sEVs抑制(图4h),体外实验也支持了该结果(图4i)。这些数据表明,在肿瘤ECM中,HRS磷酸化的肿瘤来源的外泌体直接抑制CD8 + T细胞浸润。
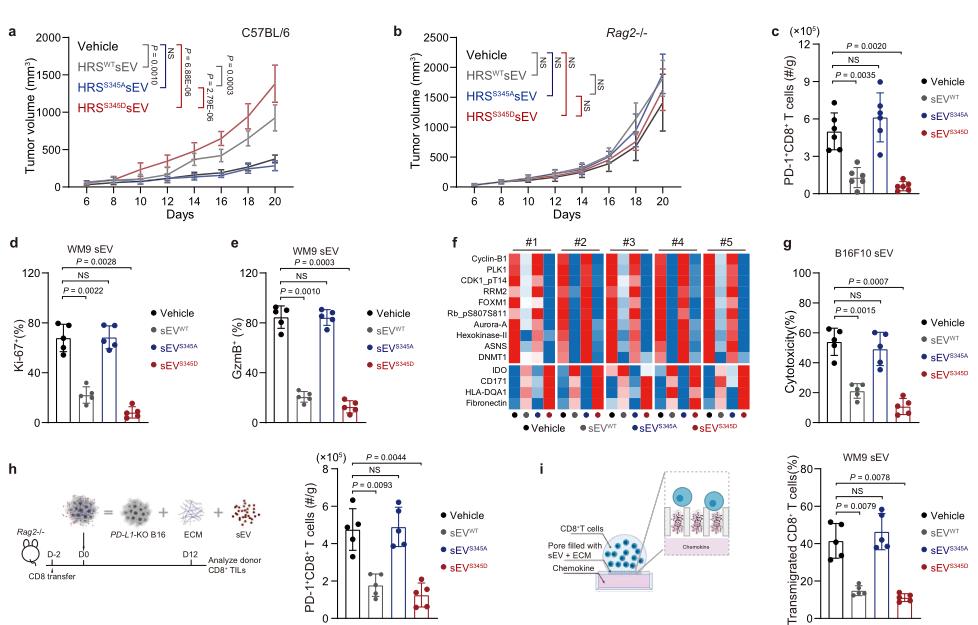
图4 HRS磷酸化增强sEV对CD8+ T细胞的抑制作用
5、PD-L1富集的外泌体介导的CD8+ T细胞抑制是由HRS磷酸化诱导
鉴于HRS磷酸化的结果是PD-A在分泌的外泌体中富集而不改变细胞表面组成,作者接下来检测了sEV PD-L1在pHRS诱导的CD8+ T细胞抑制中的作用。PD-L1-KO B16F10细胞分泌的HRSWT和HRSS345D来源的sEVs不影响CD8+ T细胞的毒性作用(图5a),但是和PD-1抗体联合使用则可以显著抑制CD8+ T细胞的毒性作用(图5b),抑制肿瘤生长(图5c)和提高CD8+ T细胞的肿瘤浸润(图5d)。为了特异性检测PD-1在体内抑制sEV的作用,建立了一种利用CD8+ T亚群CD45.1+和CD45.2+的检测方法,如图5e所示。结果发现,与sEV S345A组比较,预处理sEV WT或sEVS345D的CD45.1+ CD8+ T细胞肿瘤浸润的数量显著降低,但该作用被PD-L1消除(图5e)。鉴于PD-L1在sEV的富集可被ERK抑制剂BVD-523阻断(图3e),所以作者检测了BVD-523处理肿瘤对sEV的影响。结果显示BVD-523处理的sEV丢失了对T细胞激活、迁移、和细胞毒性的抑制作用;而sEVS345D的抑制作用则不能被BVD-523阻断(图5f-h)。这些结果进一步支持了HRS磷酸化调节外泌体对免疫抑制的抑制作用的结论。
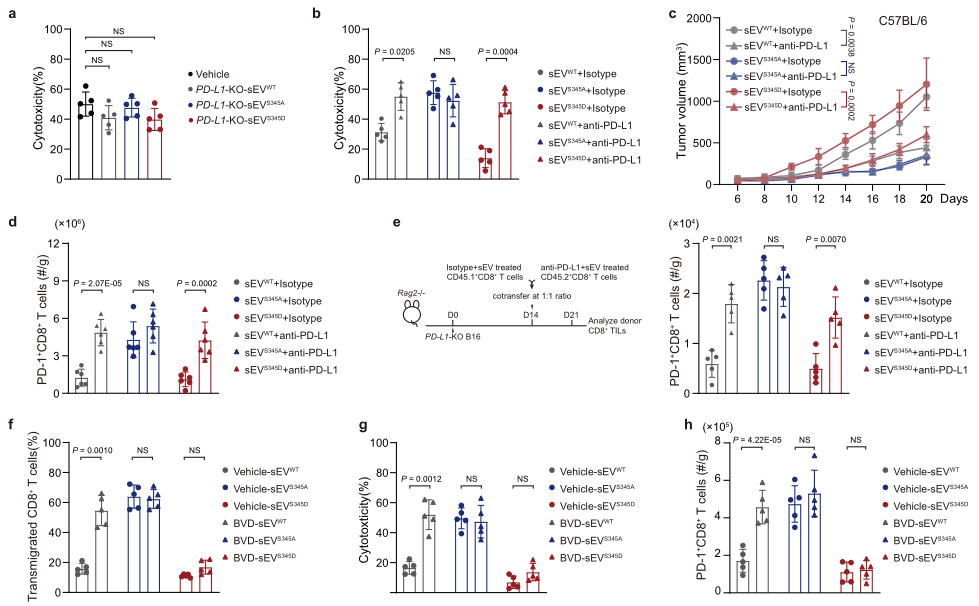
图5 PD-L1在外泌体富集介导的CD8+ T细胞抑制是由HRS磷酸化诱导
总之,本研究发现ERK介导的HRS S345磷酸化限制了CD8+ T细胞的肿瘤浸润,HRS S345磷酸化是通过相互作用介导PD-L1进入外泌体中,PD-L1富集的外泌体可抑制CD8+ T细胞的迁移和细胞毒性,从而发挥肿瘤免疫抑制作用。抑制HRS磷酸化可增强PD-1治疗的效果。
参考文献:
Guan Lei., Wu Bin., Li Ting., Beer Lynn A., Sharma Gaurav., Li Mingyue., Lee Chin Nien., Liu Shujing., Yang Changsong., Huang Lili., Frederick Dennie T., Boland Genevieve M., Shao Guangcan., Svitkina Tatyana M., Cai Kathy Q., Chen Fangping., Dong Meng-Qiu., Mills Gordon B., Schuchter Lynn M., Karakousis Giorgos C., Mitchell Tara C., Flaherty Keith T., Speicher David W., Chen Youhai H., Herlyn Meenhard., Amaravadi Ravi K., Xu Xiaowei., Guo Wei.(2022). HRS phosphorylation drives immunosuppressive exosome secretion and restricts CD8 T-cell infiltration into tumors. Nat Commun, 13(1), 4078. doi:10.1038/s41467-022-31713-6






