整合单细胞RNA测序与空间转录组学揭示间质性膀胱炎的免疫景观
间质性膀胱炎(IC)是一种以剧烈的盆腔疼痛和泌尿系统症状为特征的膀胱疼痛综合征,是一种严重的慢性疾病。目前,IC的病因和病理生理仍不清楚,诊断困难,治疗困难。因此,迫切需要了解IC发生发展的分子机制,找到有效的治疗靶点。最近,有研究通过scRNA-Seq结合CyTOF对CD45+单细胞进行了全面的表型和功能研究。然后,通过多模态交集分析,将scRNA-Seq获得的免疫观点与空间转录组(ST)的结果整合,揭示了IC患者膀胱的免疫景观。该研究发表在《Signal Transduction and Targeted Therapy》,IF:38.104。
技术路线:

主要结果:
1. IC膀胱CD45+免疫细胞的单细胞转录谱
为了破译和构建IC的免疫图谱,作者使用scRNA-seq来检测IC和健康志愿者膀胱的转录组异质性(图1a)。病理特征显示IC膀胱较对照组:尿路上皮剥蚀或解剖丧失、血管生成、免疫细胞浸润(图1b)。IC患者和对照组的膀胱标本新鲜采集,解剖,消化成单个细胞,共分离出135,091个CD45+免疫单细胞并进行测序。经过严格的质量控制,共获得了92,029个优质CD45+免疫细胞(图1c)。细胞计数与基因之间有较高的相关系数(R = 0.8995),而与线粒体基因之间没有相关系数(R =−0.006)(图1d)。检测到7种具有最明显的造血和组织谱系定义基因的细胞类型,包括T细胞、B细胞、髓细胞、成纤维细胞、上皮细胞、NK细胞和内皮细胞 (图1e-h)。去除双联细胞后,当前的细胞景观由94.42%的CD45+免疫细胞和5.58%的CD45 -单细胞组成(图1h)。

图1 scRNA-seq和空间转录组学(ST)工作流程概述
2. T和B细胞谱系的逐步聚类发现CD8+ T细胞功能障碍和B细胞异常活化
为了表征IC组和对照组之间单个T细胞亚群的变化,作者将T细胞亚群化,并根据经典T细胞标志物的表达获得9个亚群:即5个CD4+ T细胞簇、3个CD8+ T细胞簇和1个NKT细胞簇(图2a)。在CD4+ T细胞中,通过独特的转录因子和marker的表达,发现了2个辅助T细胞簇,包括Tregs和滤泡辅助T细胞(Tfh)(图2b),还发现了IL-10,在treg中几乎检测不到,这可能意味着IC组免疫调节紊乱。通过高表达CCL5、CXCR6和PRDM1识别效应性记忆性CD4+ T细胞(CD4+ Tem),通过表达IL-7R、CCR7和SELL识别中枢记忆性CD4+ T细胞(CD4+ Tcm)。CD69和ICOS在这些簇中上调,提示这些细胞更可能是中枢记忆性CD4+ T细胞而不是初始T细胞。TCF7和KLF2的表达表明早期中枢记忆性T细胞表型(图2b)。对T细胞亚群比例的分析表明,IC膀胱中treg细胞显著增加,Th17细胞显著减少(图2c)。对IC组与对照组相比的差异表达基因(DEGs)进行GO和KEGG富集分析。treg的DEGs主要富集在mRNA分解代谢过程、病毒受体和黏着斑(图2d)。而Th17细胞的DEGs主要富集在经典的炎症信号通路,如IL-17信号通路和NF-κB信号通路(图2e)。CD8A和细胞毒基因(GZMA、GZMK、GZMB、NKG7和PRF1)高表达,鉴定出两个CD8+效应T细胞簇(CD8+ Tef)。CD8+ Tef细胞高表达细胞毒标志物,GZMK+ CD8+ T细胞簇中GZMK表达水平最高,GZMA和GZMB表达水平较低。活化的CD8+ T细胞表达活化基因(如TRAC、TRBC1和ACTB),但其细胞毒性活性水平相对较低(图2a、b)。CD8+ T细胞的耗竭marker用NR4A2, ISG20, TANK和CAPZB表示。IC组衰竭基因表达水平相对高于对照组(图2f, g),提示CD8+ T在该慢性疾病中存在功能障碍。为了进一步研究B细胞亚群的转录变化,将B细胞亚群分为6个B细胞亚群(图2h),包括初始B细胞、过渡性B细胞(tbc)、活化B细胞、未转换的记忆B细胞(USMB)、转换后的记忆B细胞(SMB)和浆细胞 (图2i)。活化B细胞和USMB显著增加,SMB和TBC减少(图2J)。IC组B细胞以活化B细胞为主(46.32%),提示IC组B细胞活化程度逐渐加重。衰老相关基因的表达水平在IC组和对照组之间无显著差异(图2k)。B细胞的异常激活和浆细胞的鉴定提示IC患者可能会发生强烈的体液免疫反应。因此,检测患者和对照者血浆、尿液中的免疫球蛋白IgA、IgM、IgG、IgE。虽然两组之间血浆中所有免疫球蛋白的含量没有统计学差异,但IC患者尿液中发现IgE显著增加(图2l),提示IgE可能是IC的一个潜在的尿液生物标志物。
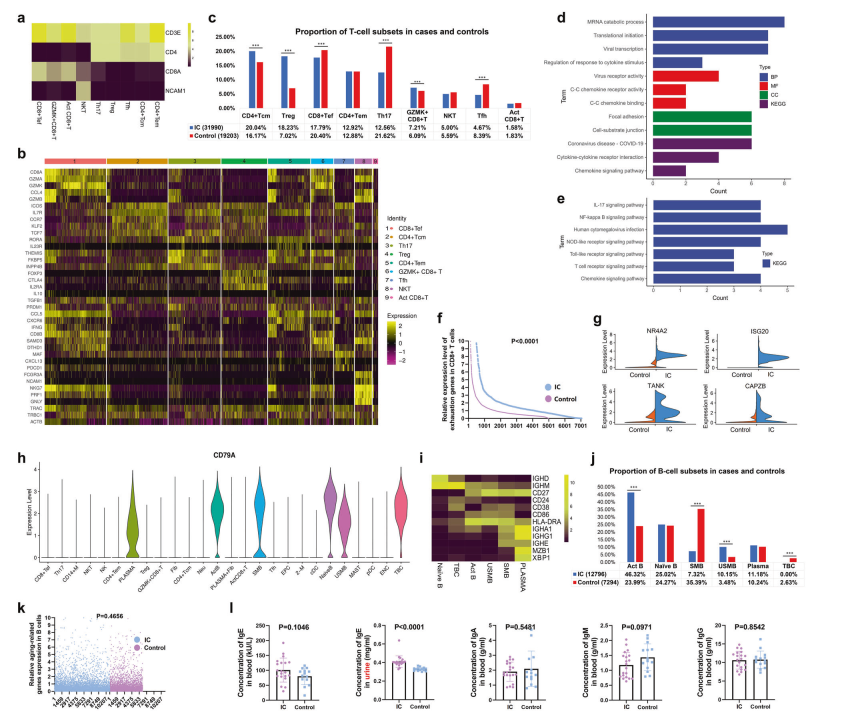
图2 T细胞和B细胞聚焦分析
3.骨髓细胞簇的分类和注释显示为免疫相关的巨噬细胞
作者描述了髓系细胞的分子和功能差异,共鉴定出6种细胞类型,包括中性粒细胞、炎症性CD14+巨噬细胞、M2样巨噬细胞、传统树突状细胞(CDC)、浆细胞样树突状细胞(PDC)和肥大细胞 (图3A)。IC膀胱中的大多数髓系细胞是中性粒细胞(51.20%),而不是肥大细胞(图3B)。与对照组相比,IC组中性粒细胞中DEGS的KEGG分析显示,在抗原处理和呈递以及类风湿关节炎通路中显著富集(图3C)。拟时分析描绘了从CD14+巨噬细胞到M2样巨噬细胞的主流发展轨迹(图3D, E)。在分化过程中,促炎基因(IL-1Β、S100A8和NLRP3)在CD14+巨噬细胞中表达上调,但随着时间的推移逐渐下调。同时,吞噬基因和调节受体(CD163、FOLR2、STAB1、C1QA和MSR1)在M2样巨噬细胞中逐渐上调(图3F)。与对照组相比,炎性CD14+巨噬细胞的功能与炎症产生有关 (图3g)。然而,m2样巨噬细胞主要通过MHC-II类分子调节免疫(图3h)。此外,m2样巨噬细胞的DEGs主要富集于自身免疫性疾病 (图3i)。为了验证两种不同巨噬细胞的存在,对CD68、S100A8和CD163进行了免疫荧光染色(图3j)。

图3聚焦分析骨髓细胞
4. 用CyTOF证实免疫表型异质性
对IC患者膀胱内的免疫亚群进行了CyTOF表征,并验证了scRNA-seq结果(图4a)。每个聚类中所选标记的蛋白水平如图4b所示。图4b, c显示了IC患者和对照组的40个聚类。对CD45+免疫细胞进行CyTOF分析(图4d)。根据经典标志物,确定了不同的细胞亚群,包括CD4+ T细胞、CD8+ T细胞、B细胞、巨噬细胞、DCs、肥大细胞和活化细胞,推测的细胞类型与scRNA-seq的结果一致(图4e)。这些数据有助于验证和构建IC膀胱中的细胞免疫细胞图谱。

图4细胞质量分析(Mass cytometry, CyTOF)证实IC膀胱免疫细胞表型异质性
5. IC的免疫激活网络
为了确定IC组中细胞激活之间的潜在相互作用,作者分析了相应的受体和配体的表达模式。相互作用对主要分布在内皮细胞、巨噬细胞、CDC和效应性记忆性CD4+ T细胞的表面(图5a)。基于IC组中top50交互对的免疫激活网络如图5b所示。两个趋化因子受体在几乎所有细胞亚群中都有表达,但它们的配体主要在成纤维细胞中表达(图5c和补充图4b)。这些结果提示上皮细胞和成纤维细胞可能协调免疫细胞在IC膀胱中的转移。炎症因子(TNF, IFNG和IL-1β)的高表达水平表明IC膀胱内存在稳健的炎症反应(图5d)。此外,趋化因子CCL5在几乎所有类型的细胞中均上调。ELISA检测证实尿液中CCL5水平高,但血液中无CCL5水平高(图5e),因此CCL5可能是IC的尿液生物标志物。此外,IC膀胱中Treg细胞中IL-10和IL-35的表达降低(图5f),TGF-β信号通路的表达上调(图5g),提示IC膀胱中Treg细胞功能障碍。再加上CD8+ T耗竭,这些结果可能提示IC组存在免疫调节功能障碍,这可能导致持续的炎症和纤维化。IC患者上皮细胞的DEGs除了参与免疫应答外,还富集于人乳头瘤病毒感染、病毒蛋白与细胞因子和细胞因子受体的相互作用(图5h)。在成纤维细胞的富集分析中获得了类似的结果(图5i)。对IC膀胱上皮细胞的前5个转录因子进行了预测,包括NR2F1、FOXA1、HOXD1、TBX2和OVOL1(图5j)。对于比例变化较大的细胞类型(Tregs、Th17、Act b、SMB、USMB和中性粒细胞),回顾了这些细胞中DEGs的功能结果,发现它们都与病毒感染相关(图5k)。因此,收集了20例IC患者和14例对照者的尿液标本进行病毒检测。人多瘤病毒-2在IC尿液中检出阳性率为95%(19/20),而在对照组尿液中未检出(图5l)。这一发现将为IC的病因学和病理生理机制提供新的线索和理论依据,今后还需要更多的工作和研究来深入研究感染的细胞类型及其关键受体,从而找到治疗IC的潜在靶点。
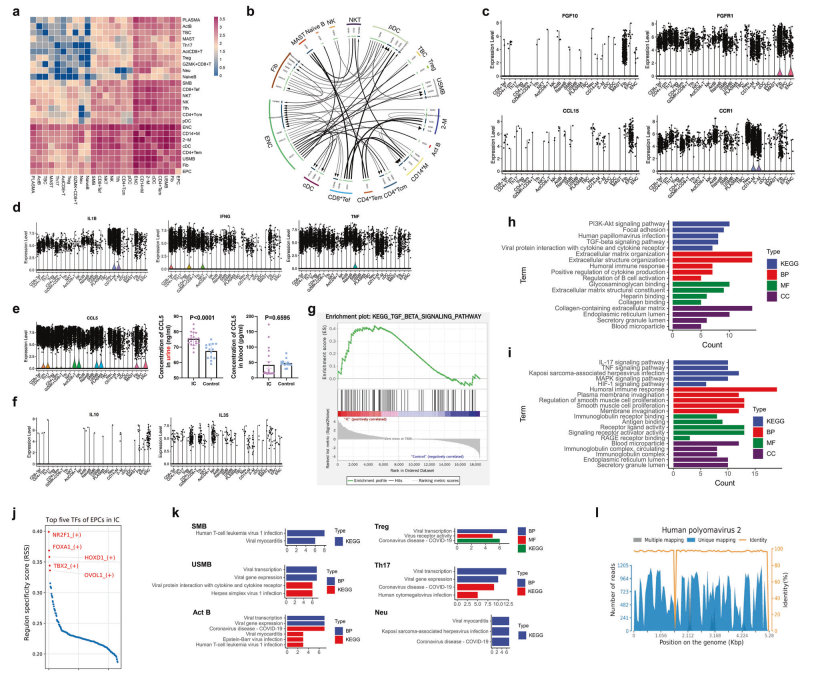
图5基于scRNA-seq的Cellphone DB分析显示了免疫网络中的串扰
6. ST显示IC尿路上皮内有免疫细胞聚集阻断剂在卵巢癌发生中的作用
为了生成组织切片的无偏倚转录组图,将来自3例IC患者的6个膀胱组织样本和来自对照组的3个样本安装在空间条形码ST芯片载玻片上。切片经H&E染色及brightfield成像,观察其组织学特征。经过标准质量控制后,采用Seurat方法进行降维,并通过T-SNE实现可视化。根据每个簇中的DEGs,进行逐步细胞聚类构建ST图。图6a展示了IC膀胱的第一个ST图。基因和UMIs之间有很强的相关性(图6b)。检测了平滑肌细胞(SMCs)、尿路上皮细胞、肌成纤维细胞、间质细胞(ISCs)和肥大细胞(KIT)的标记基因(图6c)。图6d描绘了完整的膀胱壁结构,包括尿路上皮区、固有层和肌肉层(图6d)。FN1、TGF-β1、COL1A1和COL3A1在内的纤维化基因在各种细胞类型中均高表达,这可能表明膀胱结构可能最终发生重度纤维化(图6e)。图6g显示对照膀胱的第一个ST图。基因和UMIs之间的相关系数为0.98(图6h)。鉴定了平滑肌细胞、ISCs、成纤维细胞(COL1A2)、肌成纤维细胞和尿路上皮细胞(图6i, j)。然而,在对照组细胞中,纤维化基因的表达水平较低(图6k)。
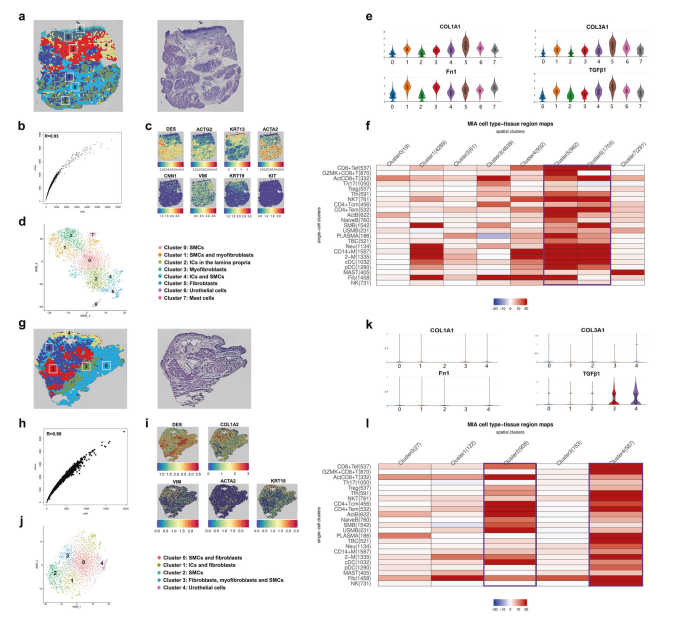
图6利用多模态交叉分析(MIA)绘制IC膀胱切片不同免疫群体的分布图
7.免疫亚群图谱揭示了IC和对照膀胱组织中免疫细胞的分布差异
为了精确定位免疫细胞在IC膀胱中的位置,应用多模态交集分析(MIA)来解释不同组织之间的空间限制性映射。结果显示,几乎所有的免疫亚群,如巨噬细胞、调节性T细胞、驻留记忆CD8+ T细胞、浆细胞、PDC、CDCS、NKT细胞、初始B细胞和中性粒细胞,在IC膀胱的尿路上皮区域富集或位于成纤维细胞附近(图6f),也在对照膀胱的尿路上皮和平滑肌细胞周围发现(图6l)。但其中只有一半的免疫细胞亚群在对照膀胱的尿路上皮区域被识别。MIA的研究结果证实了上皮细胞和成纤维细胞在IC的发生发展中的重要作用,CellPhone DB数据库也提示了这一点。综上所述,作者成功构建了IC膀胱在空间水平上的免疫图谱,并表征了IC膀胱的免疫网络。
结论:
作者构建了女性IC患者膀胱的免疫景观,确定了这些免疫细胞亚群的特征,并阐述了它们之间的关系和相互作用。该研究为IC的免疫图谱研究开创了先例。免疫系统的研究可能会对IC的病理生理机制提供更深入的了解,并为未来该病的诊断和治疗奠定基础。
参考文献:
Peng L, Jin X, Li BY, Zeng X, Liao BH, Jin T, Chen JW, Gao XS, Wang W, He Q, Chen G, Gong LN, Shen H, Wang KJ, Li H, Luo DY. Integrating single-cell RNA sequencing with spatial transcriptomics reveals immune landscape for interstitial cystitis. Signal Transduct Target Ther. 2022; 7(1):161. doi: 10.1038/s41392-022-00962-8.






