CircBCAR3通过海绵化miR-27a-3p加速食管癌的发生和转移
食管癌是一种全球致命的癌症,5年生存率为18%。目前环状RNA(circRNAs)已被证实有助于食管癌的进展。在本研究中,作者通过生物信息学分析预测circBCAR3(hsa_circ_0007624)在食管癌中存在差异表达,进而研究circBCAR3在食管癌发生中的致癌作用和生物发生。该研究于2022年7月发表在《Molecular Cancer》,IF:15.302。
技术路线:

主要研究结果:
1. CircBCAR3在食管癌组织和细胞中表达上调
为了解circBCAR3在食管癌中的表达情况,首先从GEO数据库中分析了circRNAs在食管癌中的表达情况。基于GSE150476和GSE112496数据集,食管癌中存在5种差异表达的circRNAs(图1A)。在EC109细胞中,缺氧治疗后只有hsa_circ_007624表达上调(图1B)。PCR结果显示hsa_circ_0007624(circBCAR3)在食管肿瘤组织和细胞系中表达明显升高,证实circBCAR3表达上调(图1C和D)。将BCAR3 pe-mRNA的2,3,4,5外显子反向剪接,形成circBCAR3的闭环结构(图1E)。作者检测了circBCAR3和线性BCAR3与RNase R的稳定性,环状形式(circBCAR3)对RNase R的抗性更强,而线性形式(BCAR3 mRNA)显著衰减(图1F)。此外,经转录抑制剂Actinomycin D处理后,circBCAR3的转录半衰期长于BCAR3 mRNA,这表明circBCAR3的稳定性高于BCAR3 mRNA(图1G)。通过琼脂糖凝胶电泳分析从EC109和KYSE150细胞中分离cDNA和gDNA。利用cDNA而非gDNA中的不同引物扩增circBCAR3,证实环状BCAR3外显子的存在,排除了反式剪接产物(图1H)。随后对EC109和KYSE150细胞进行了RNA-FISH检测,结果显示circBCAR3主要存在于食管癌细胞的细胞质中(图1I)。
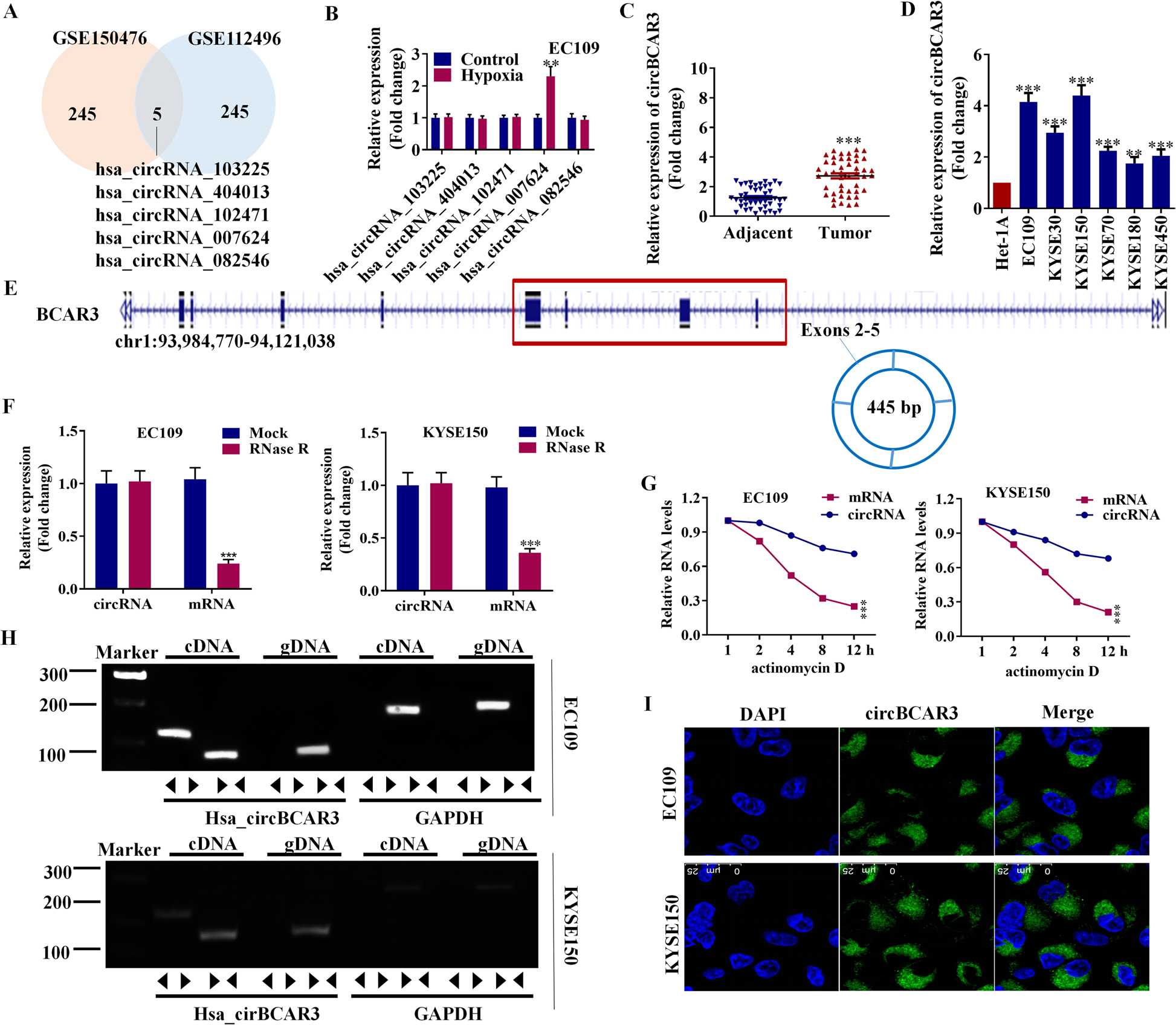
图1. CircBCAR3在食管癌中表达上调
2. 敲低circBCAR3可抑制食管癌细胞的增殖、迁移和侵袭
探讨circBCAR3在食管癌发生发展中的作用,在EC109和KYSE150细胞中,作者设计了两种shRNAs来有效地沉默circBCAR3(图2A)。CCK-8、克隆形成实验和EdU实验结果显示,沉默的circBCAR3抑制了EC109和KYSE150细胞的活力和增殖(图2B-D)。创面愈合试验和transwell试验(包括迁移和侵袭)表明,circBCAR3的下调抑制了食管癌细胞的迁移和侵袭能力(图2E和F)。
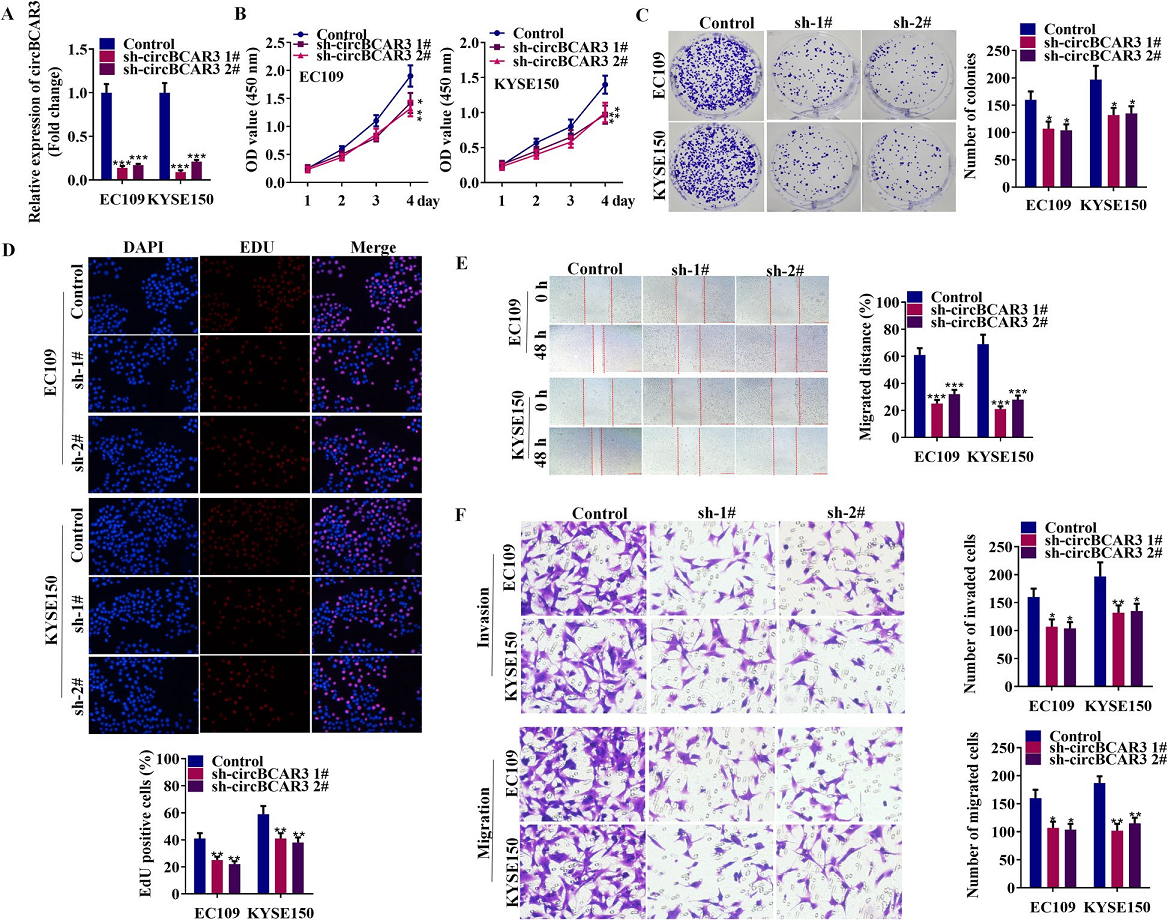
图2. 沉默circBCAR3在体外可抑制食管癌细胞的增殖和运动
接下来,作者进一步探讨敲低circBCAR3对铁死亡的影响。如图3A-D所示,sh-circBCAR3降低了细胞内Fe2+、MDA、脂质ROS,并增加了GSH水平。透射电镜观察sh-circBCAR3在食管癌细胞中还原铁死亡的典型形态变化(图3E)。如图3F所示,沉默circBCAR3后,GPX4蛋白水平升高。因此,circBCAR3的敲低可抑制食管癌细胞的铁死亡。
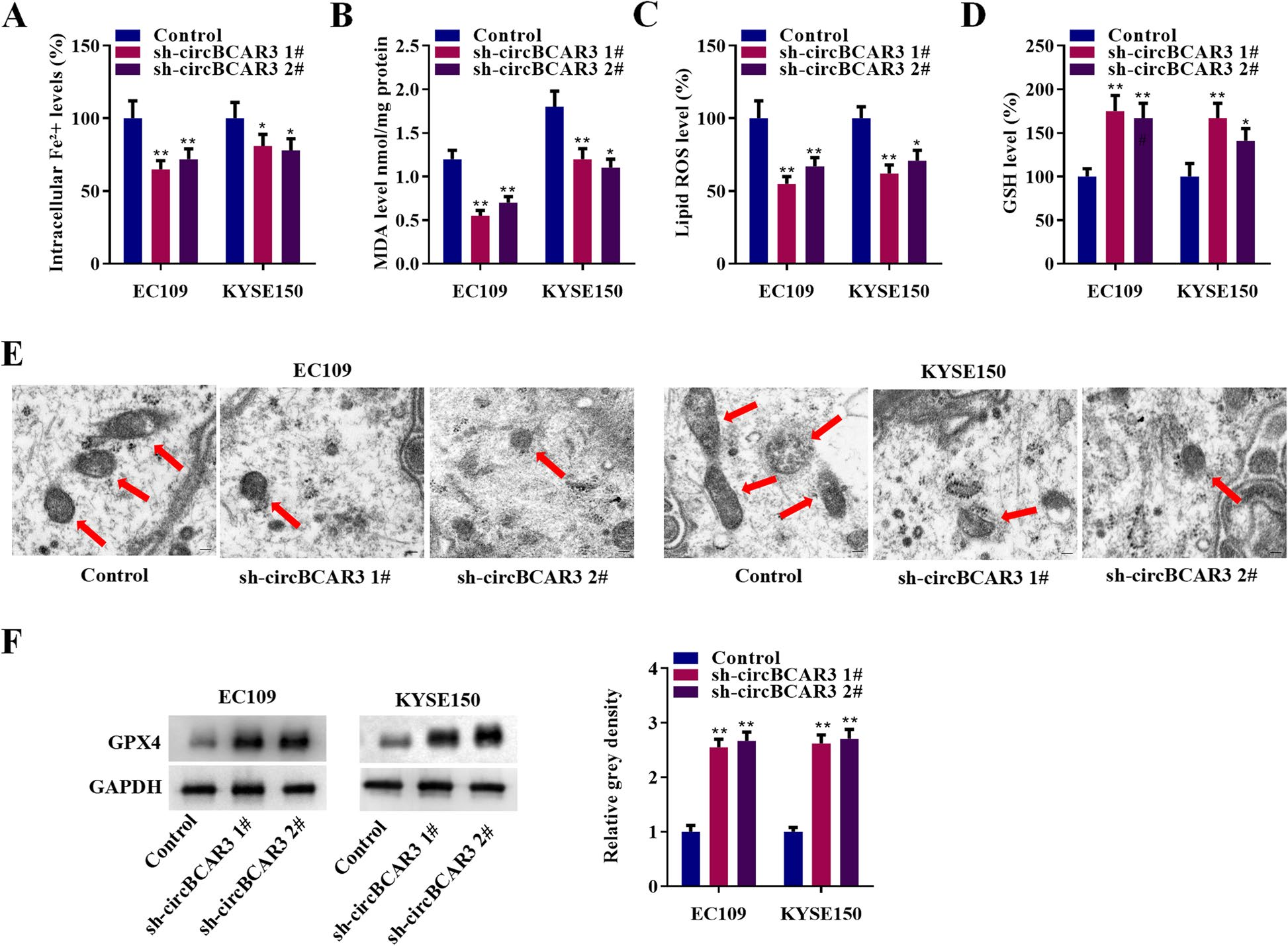
图3. 沉默circBCAR3在体外可抑制食管癌细胞的铁死亡
4. 敲低circBCAR3可逆转缺氧对食管癌细胞增殖、迁移、侵袭和铁死亡的影响
再次进行功能研究,以评估circBCAR3是否介导缺氧诱导的食管癌细胞恶性行为的改变。结果表明,缺氧处理可显著促进食管癌细胞的增殖、迁移、侵袭和铁死亡,CircBCAR3基因的下调明显逆转了缺氧的这些影响(图4)。
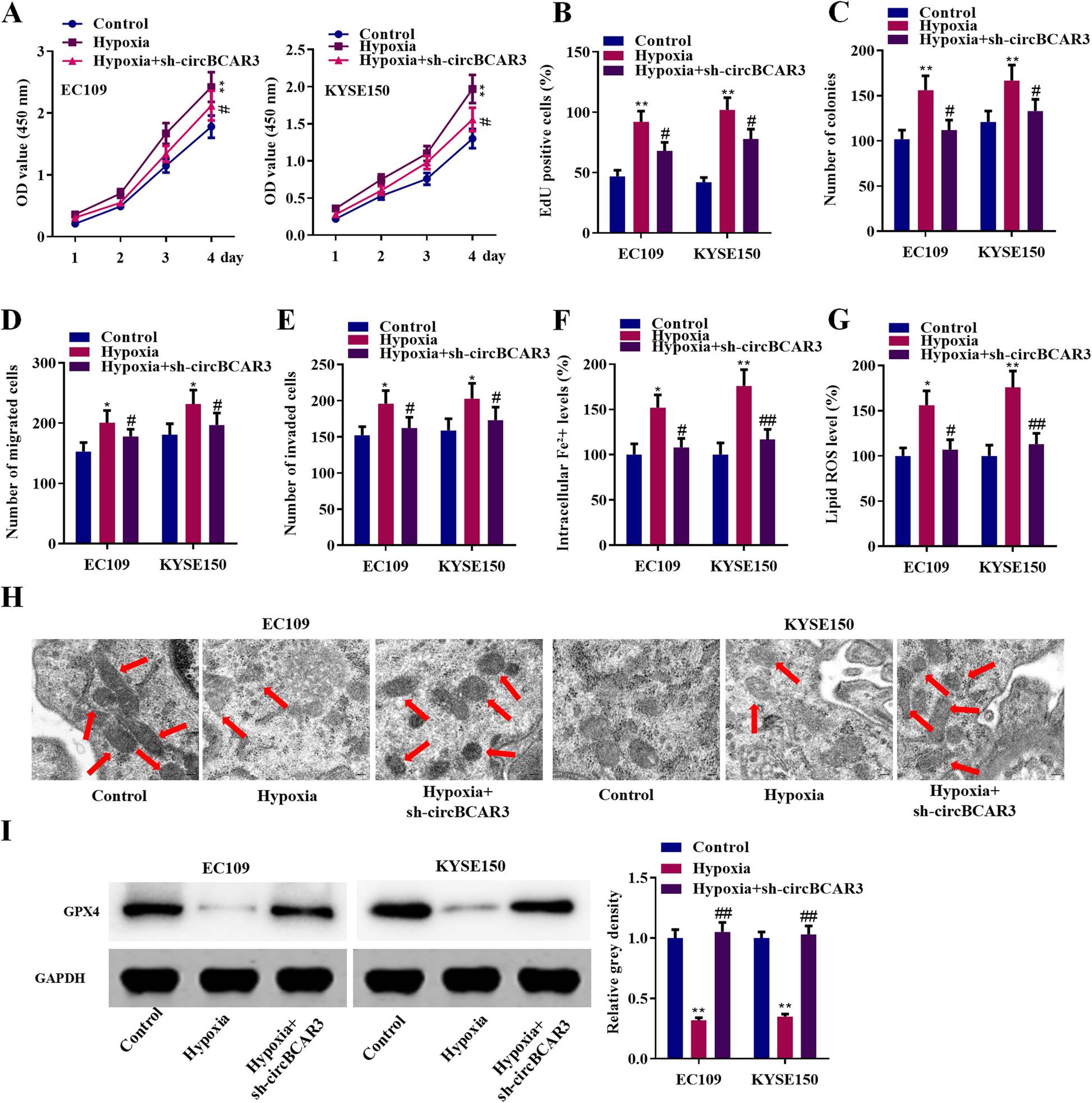
图4. 敲低circBCAR3可逆转缺氧对体外食管癌细胞的影响
5. 沉默circBCAR3在体内可抑制食管癌的肿瘤生长和转移
如图5A-C,结果表明敲低circBCAR3可降低小鼠食管肿瘤的体积和重量。此外,免疫组化染色结果表明,沉默的circBCAR3可降低增殖标志物ki67的表达。H&E染色结果显示,sh-nc组肿瘤细胞分布密集,细胞形态正常,而sh-circBCAR3组肿瘤细胞数量减少,细胞核缩小较多(图5D)。随后,作者建立肿瘤转移模型,通过尾静脉注射食管癌细胞来监测肺转移。生物发光强度的下降证明沉默的circBCAR3诱导小鼠肿瘤抑制(图5E)。与对照组相比,沉默circBCAR3对食管癌肺转移有抑制作用(图5F)。H&E染色结果进一步证实了这一趋势(图5G)。免疫组化染色揭示敲除circBCAR3可抑制肺组织中vimentin、N-cadherin、MMP-2、MMP-9的表达,促进E-cadherin的表达(图5H)。这些数据表明,在体内敲低circBCAR3可抑制食管癌的生长和转移。
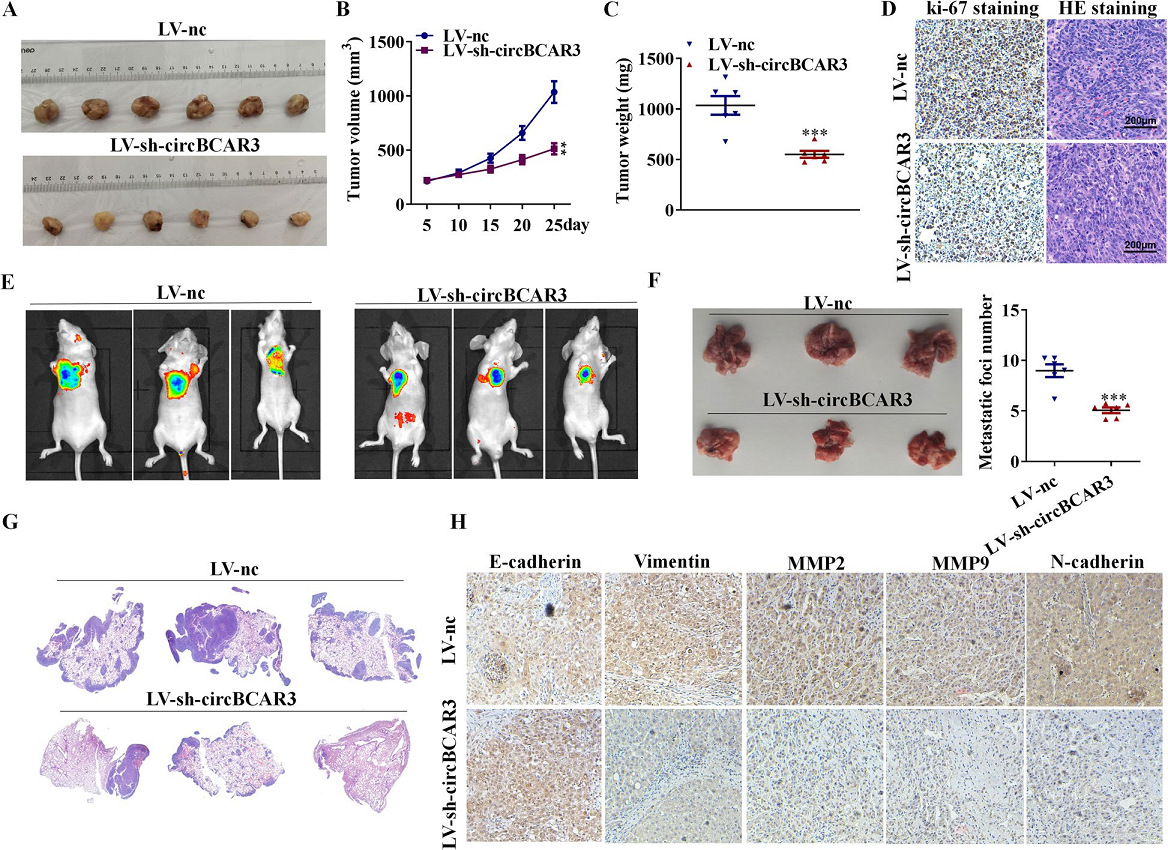
图5. 敲低circBCAR3在体内可抑制食管癌的生长和转移
6. 在食管癌细胞中,circBCAR3负向调控miR-27a-3p
从ENCORI数据库中预测与circBCAR3结合的潜在miRNAs。miR-27a-3p与circBCAR3的结合位点如图6A所示。荧光素酶实验结果显示,circBCAR3负调控野生型miR-27a-3p,与突变型miR-27a-3p无结合关系(图6B)。RIP实验发现,Ago2是miRNA机制的效应物,可与miR-27a-3p和circBCAR3结合(图6C和D)。转染circBCAR3 shRNAs到EC109和KYSE150细胞,miR-27a-3p表达水平升高,而过表达circBCAR3降低了miR-27a-3p的表达水平(图6E)。此外,为确定circBCAR3和miR-27a-3p在食管癌细胞中的亚细胞分布,作者进行了RNA-FISH实验,结果表明circBCAR3和miR-27a-3p均位于细胞质中(图6F)。
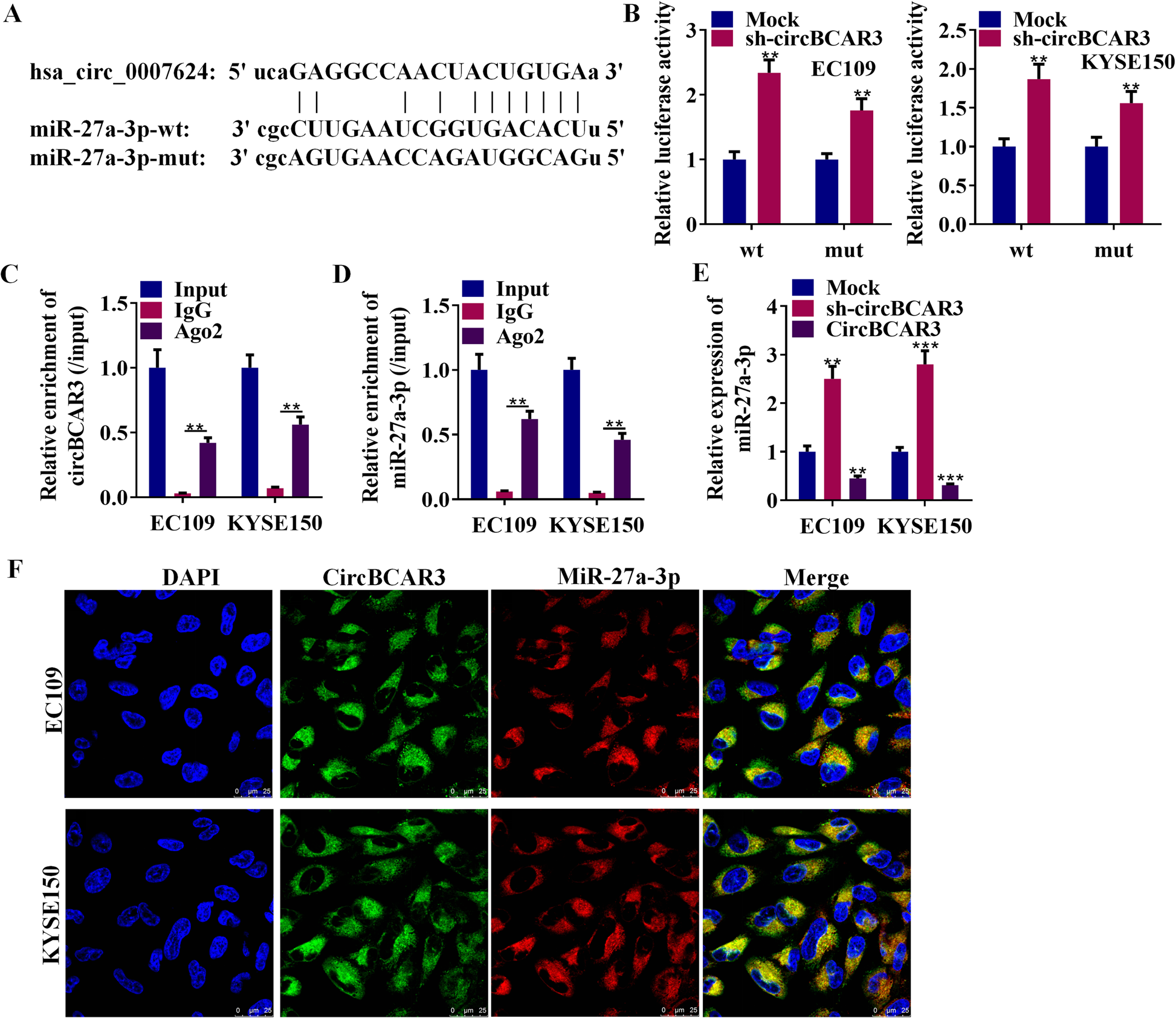
图6. CircBCAR3在食管癌细胞中充当miR-27a-3p的海绵
7. TNPO1在食管癌细胞中作为miR-27a-3p的靶点
通过ENCORI数据库,确定TNPO1、GCC2、THRB和CASC3为miR-27a-3p的潜在靶点。图7A结果表明,miR-27a-3p可引起TNPO1在EC109细胞中的表达降低。与对照Het-1A细胞系相比,6个食管癌细胞中TNPO1表达显著上调(图7B)。从GEPIA数据库中发现,TNPO1在182个食管癌组织中表达高于286个相邻非肿瘤组织(图7C)。根据ENCORI数据库预测,TNPO1 3'UTR与miR-27a-3p序列互补(图7D)。构建TNPO1 3'UTR野生型和突变型荧光素酶报告基因进行荧光素酶实验,证实TNPO1是miR-27a-3p的直接靶点(图7E)。MiR-27a-3p模拟物能有效降低TNPO1的表达水平,而miR-27a-3p抑制剂能显著增强TNPO1的表达水平(图7F)。缺氧可诱导食管癌细胞中TNPO1表达上调(图7G)。PCR结果显示,与45个癌旁非肿瘤组织相比,TNPO1在45个食管癌组织中显著高表达(图7H)。
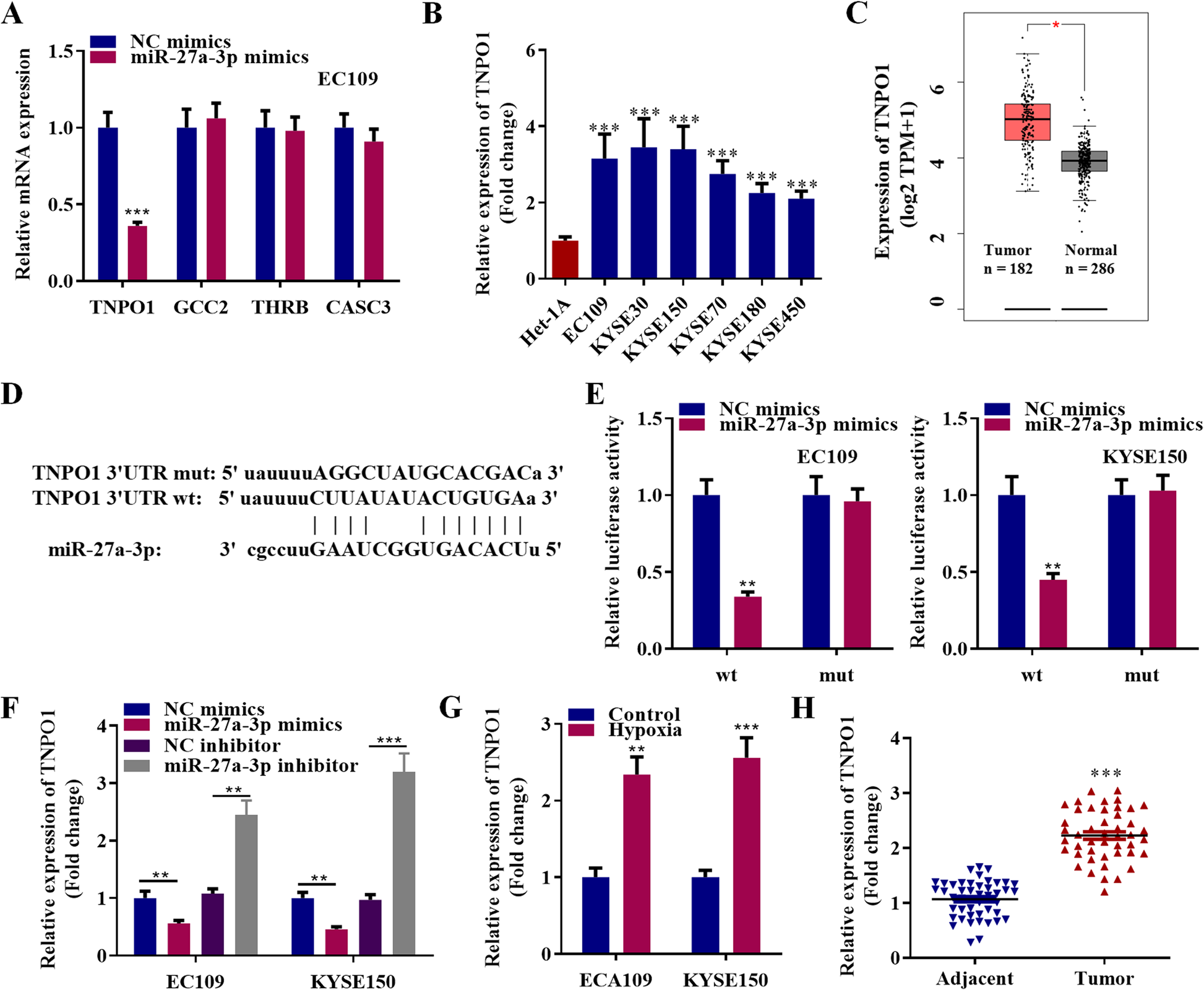
图7. TNPO1在食管癌细胞中作为miR-27a-3p的靶点
8. 过表达TNPO1可拯救沉默circBCAR3介导的对食管癌细胞增殖、迁移、侵袭和铁死亡的抑制
作者设计了TNPO1过表达载体,发现它有效地拯救了sh-circBCAR3对TNPO1表达的抑制作用(图8A)。集落形成实验和EdU实验表明,circBCAR3 shRNA降低细胞活力和增殖,TNPO1过表达进一步提高细胞活力和增殖(图8B和C)。Transwell迁移和侵袭实验表明,TNPO1过表达挽救了敲低circBCAR3对细胞迁移和侵袭能力的抑制作用(图8D)。图9显示sh-circBCAR3对食管癌细胞铁死亡的抑制作用被TNPO1的过表达所拯救,pcDNA-TNPO1-诱导细胞内Fe2+、MDA、脂质ROS升高,GSH和GPX4水平降低。
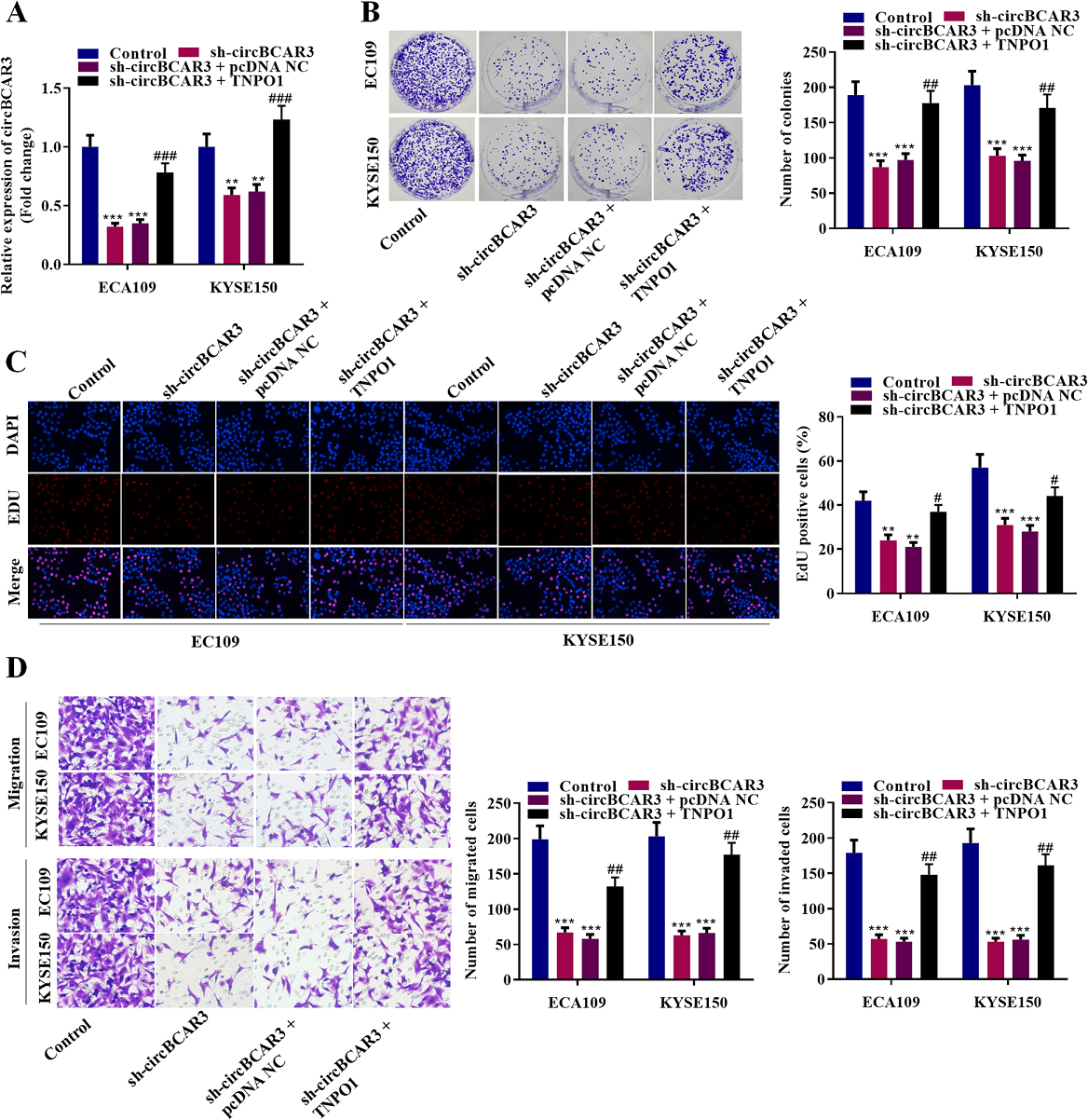
图8. TNPO1可逆转circBCAR3沉默诱导的对食管癌细胞增殖和活力的抑制
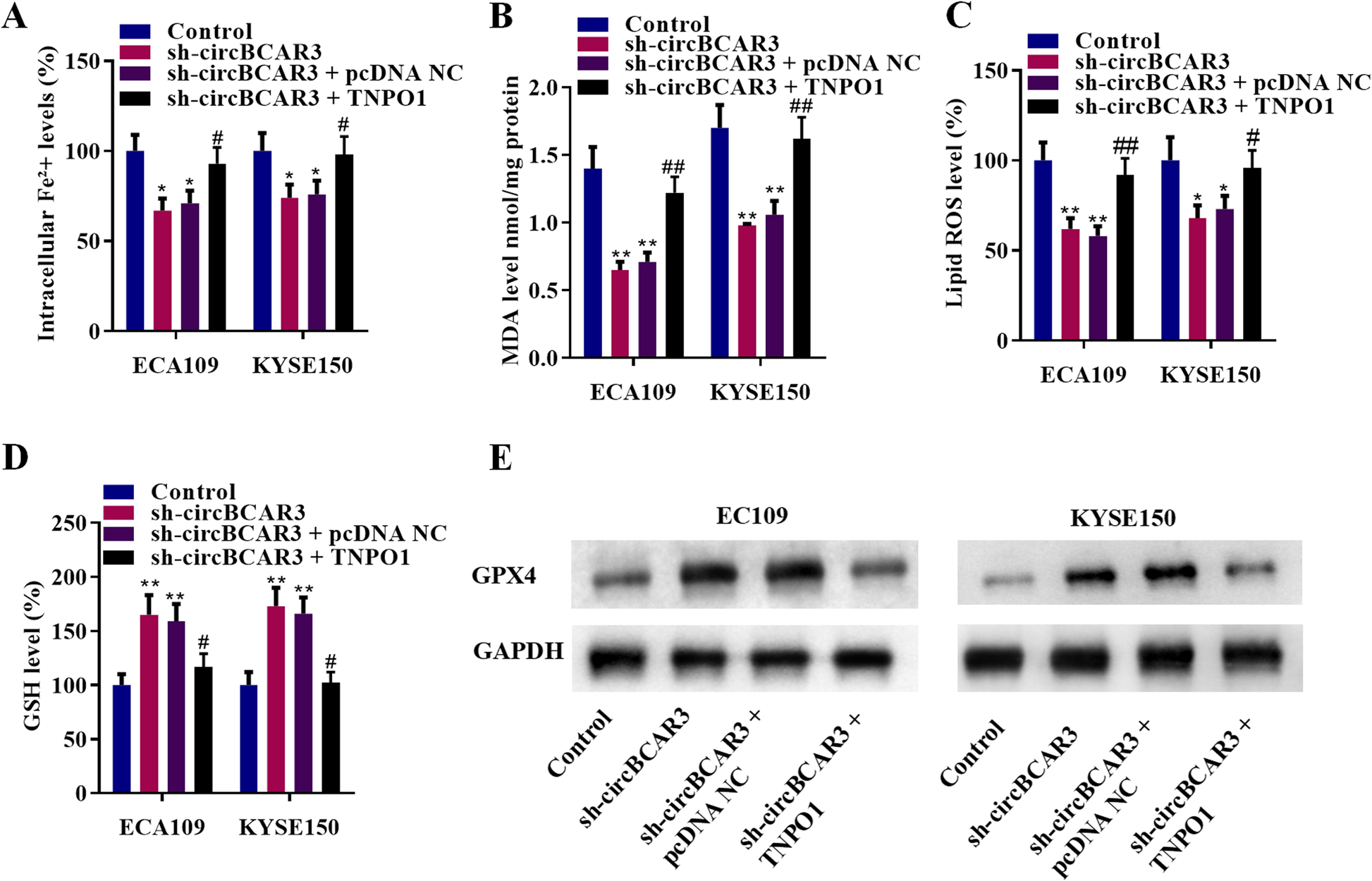
图9. TNPO1挽救sh-circBCAR3诱导的食管癌细胞铁死亡抑制
9. 剪接因子QKI加速circBCAR3的生物发生
PCR分析结果显示,剪接因子QKI和ESRP1对食管癌细胞中circBCAR3的表达有负调控作用,而其他剪接因子对circBCAR3的表达无显著影响(图10A)。接下来展示了5个QKI结合序列位于BCAR3 pre-mRNA外显子的两侧(图10B)。RIP试验使用QKI抗体证明QKI与BCAR3 pre-mRNA在a,b,d和e位点结合(图10C)。此外,QKI在收集的45个食管癌组织中表达上调(图10D)。敲低QKI可以抑制circBCAR3的表达,对BCAR3 mRNA的表达无影响(图10E)。这些发现表明,剪接因子QKI通过内含子中的结合位点加速了circBCAR3的生物发生。
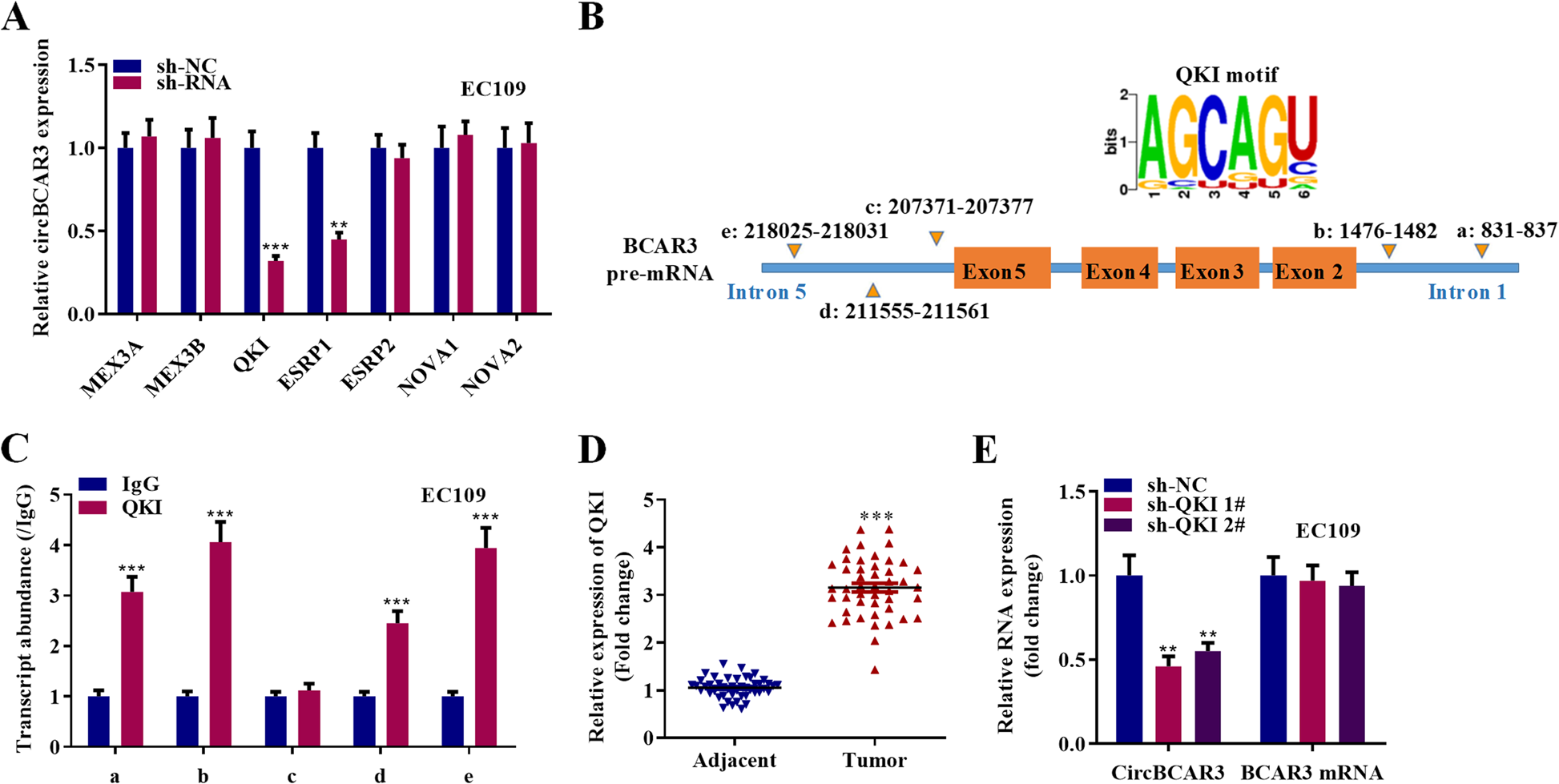
图10. 剪接因子QKI加速circBCAR3的生物发生
10. 缺氧诱导E2F7表达激活QKI转录
作者已经证实,circBCAR3在食管癌中高表达,并通过缺氧治疗上调表达。缺氧如何诱导circBCAR3表达升高尚不清楚。因此,进行RNA-seq筛选异常基因,如热图和火山图所示(图11A和B)。富集分析显示E2F家族的基因被富集(图11C)。通过检索GEPIA数据库来探讨这些E2Fs在食管癌中的表达,发现E2F7在食管癌中显著高表达(图11D)。PCR分析证实,缺氧后EC109细胞E2F7和QKI表达均上调(图11E)。由于E2F7是一个转录激活因子,推测E2F7可能调控QKI的转录。在QKI的启动子中,基于JASPR在线数据库发现了一个E2F7的潜在结合位点(图11F)。随后,将该结合位点的野生和突变形式亚克隆到pGL3载体中。荧光素酶测定后,结果表明,E2F7对携带野生结合位点的报告载体荧光素酶活性有促进作用,但对突变位点无促进作用(图11G)。此外,E2F7基因敲除降低了QKI mRNA表达水平(图11H)。检索GEPIA数据库,在182个食管癌组织中检测这些关键分子的表达相关性,结果显示E2F7和QKI,E2F7和TNPO1,QKI和TNPO1两者之间存在正相关表达(图11I)。
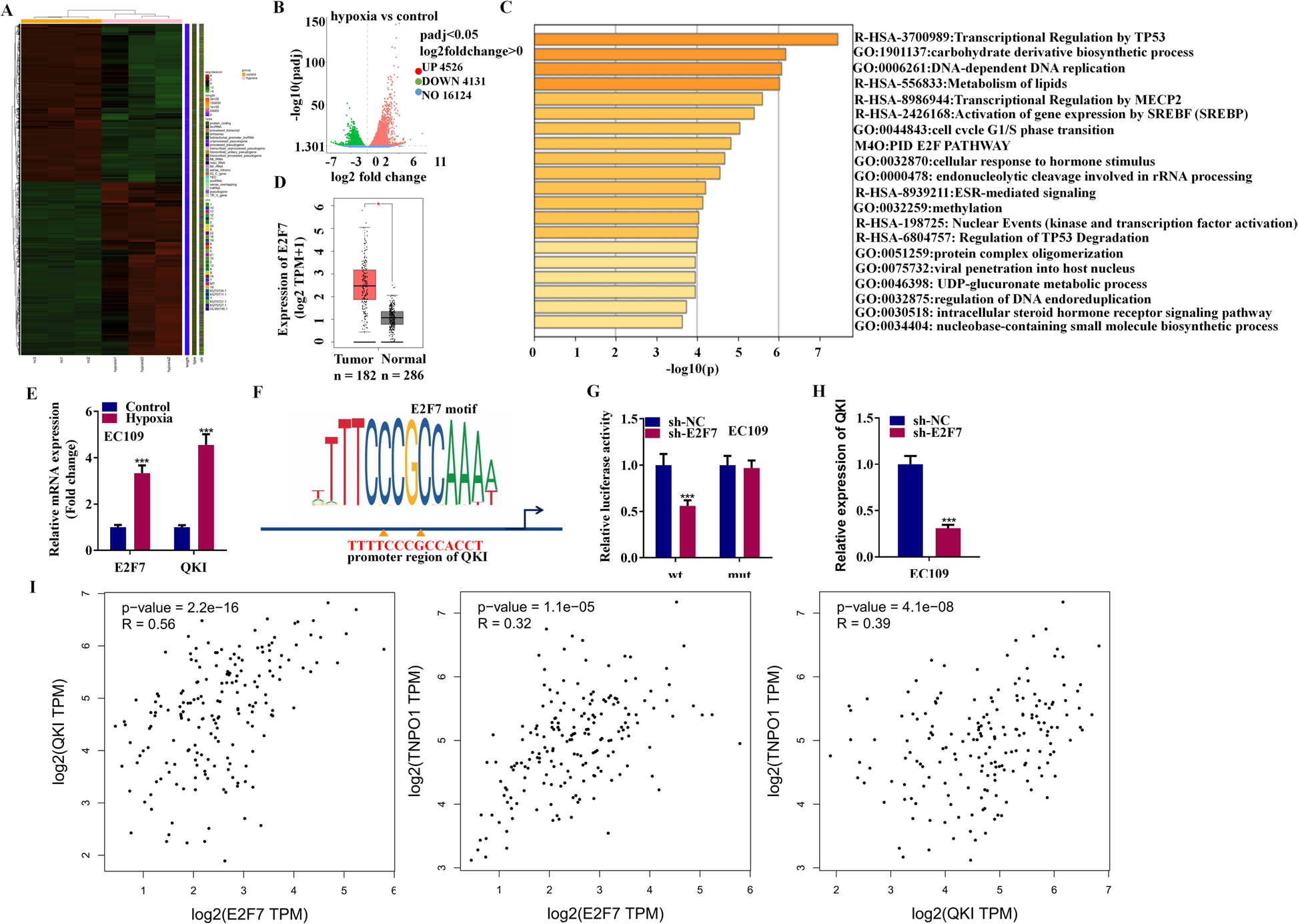
图11. 缺氧诱导E2F7激活QKI的转录
结论:
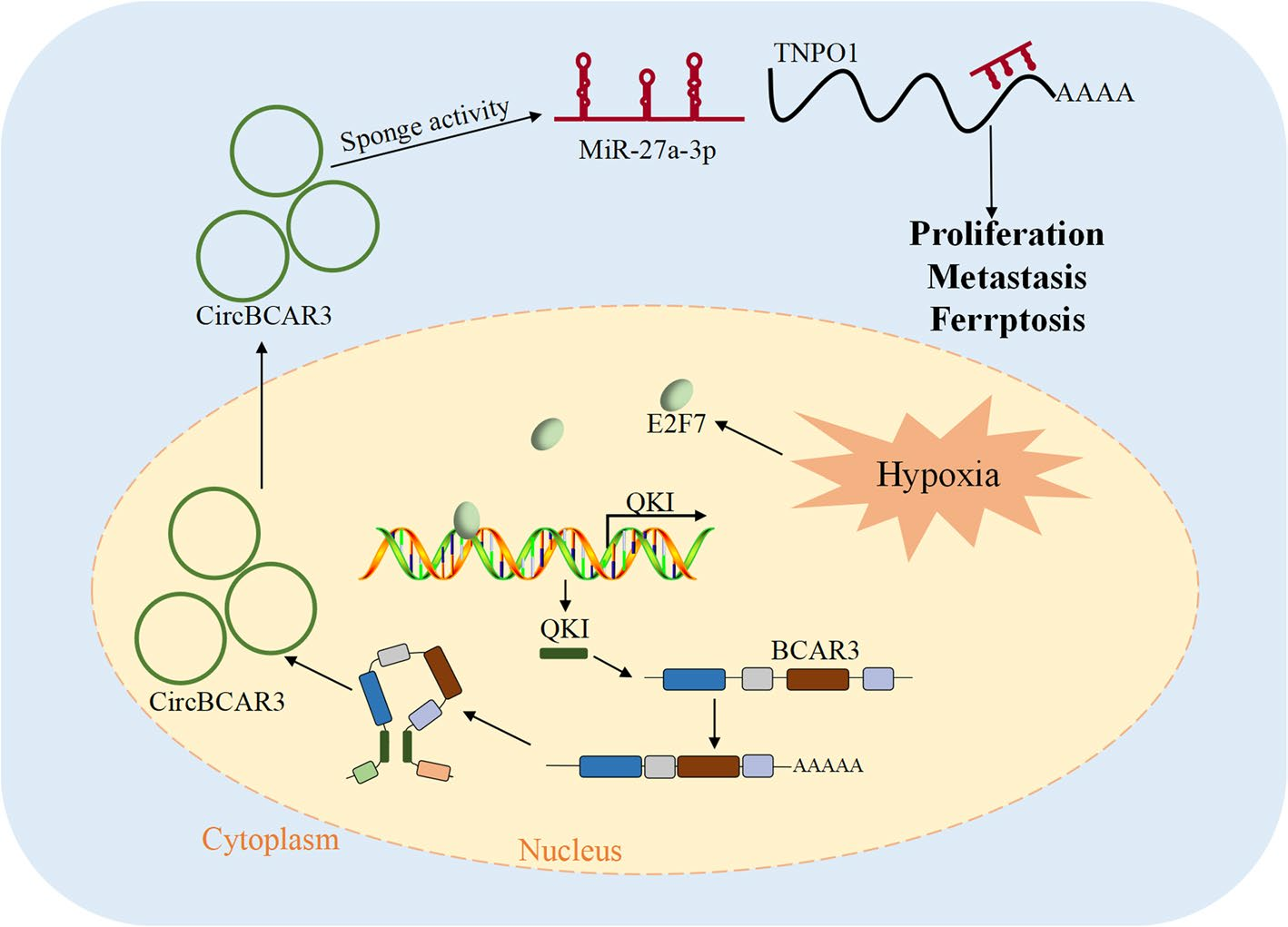
作者创新性地证明了circBCAR3在食管癌中的致癌作用,通过促进癌细胞增殖、迁移、侵袭和铁死亡以及促进小鼠食管癌的发生和转移。在分子水平上,缺氧诱导的E2F7转录激活剪接因子QKI,通过与内含子结合促进circBCAR3的生物发生形成circBCAR3外显子侧面的QKI响应元件。CircBCAR3与miR-27a-3p相互作用上调TNPO1,从而在食管癌细胞中发挥其生物学功能。这些数据表明,circBCAR3可作为食管癌研究和治疗的潜在标志物。






