热门技术单细胞RNA测序解码透明细胞肾细胞癌中腔静脉瘤栓的多细胞生态系统
2020 年全球新诊断肾癌病例超过431280例,其中最常见的组织学亚型是透明细胞肾细胞癌 (ccRCC),约占所有肾细胞癌 (RCC) 病例的 70-80%。RCC 的一个独特临床方面是它可以通过肾静脉侵入下腔静脉 (IVC),甚至长到右心腔。大约 15% 的RCC患者报告了肾静脉或下腔静脉中的静脉肿瘤血栓 (TT)。肿瘤血栓水平不一定影响疾病特异性生存,但对手术的复杂性有重大影响,具有显着的出血风险、不稳定的血流动力学和死亡。新辅助全身治疗可能潜在地降低 TT 负担,从而提高肿瘤血栓切除术的安全性和可行性,从而潜在地提高手术切除的治愈潜力。然而,对 TT 形成的潜在机制知之甚少,这阻碍了设计有效的新辅助疗法来降低肿瘤血栓的分期和降低血栓切除术的围手术期发病率和死亡率。
今天我们介绍一篇关于肾癌静脉肿瘤血栓单细胞测序的文章,该文章发表于Genome biology期刊,IF=17.9。改文章利用单细胞RNA测序解码透明细胞肾细胞癌中腔静脉瘤栓的多细胞生态系统,探索腔静脉瘤栓的形成机制。
肿瘤血栓和匹配的原发性肿瘤中肿瘤生态系统的 scRNA-seq 分析
为了阐明静脉肿瘤血栓中的肿瘤生态系统,我们从未接受治疗的 ccRCC 患者(ccRCC,n = 8)收集了19个手术组织标本用于scRNA-seq。肿瘤血栓(n = 8)、成对的原发性肿瘤(n = 8)和邻近肾组织(n = 3)分别称为 TT、PT 和 ART。此外,还纳入了4个不同的RNA-seq 数据以进行进一步验证。从140805个细胞中获得了大约10亿个独特的转录本:62035个细胞来自TT,58695 个细胞来自 PT,20075个细胞来自ART。根据典型基因标记的表达,识别并可视化了 9 种主要细胞类型:上皮细胞、T 细胞、自然杀伤 (NK) 细胞、骨髓细胞、肌成纤维细胞、内皮细胞 (EC)、B 细胞、浆细胞和肥大细胞。我们的结果揭示了 ART、PT 和 TT 样本之间生态系统组成的显着异质性。

与原发性肿瘤相比,T/NK 细胞聚集和状态分析确定肿瘤血栓富含组织驻留 CD8+T细胞,处于祖细胞耗尽状态
考虑到研究观察到免疫检查点(ICB)治疗后 ccRCC 患者的肿瘤血栓显着减少,我们推测肿瘤浸润性免疫细胞可能在该过程中发挥重要作用。因此,我们首先对 T 和 NK 细胞进行了无监督聚类,并在 ART、PT 和 TT 中获得了12个簇,包括 CD4+ T 细胞的四个亚型,CD8 + T 细胞的五个亚型,两个NK亚簇和一个 NKT 簇。
为了确定 ARTs、PTs 和 TTs 之间的差异,我们计算了 ARTs、PTs 和 TTs 中每个簇的百分比,发现 PTs 中幼稚 CD4 + T 细胞 (CD4-C1) 的相对百分比低于ARTs 和 TTs,抑制性 Tregs(CD4-C4)的比例更高,表明 PT 中可能存在更多的免疫抑制状态。
虽然在正常肾脏组织中发现了大量的组织驻留 CD8 + T 细胞,但其机制仍然很大程度上未知。与我们的发现一致,另一项关于肝细胞癌 (HCC) 的研究也揭示了组织驻留的CD8 + T 细胞在邻近的非肿瘤组织中比在肿瘤中更丰富。此外,正如之前在 ccRCC [ 36 ] 中观察到的,耗尽的 CD8 + T 细胞(CD8-C3)在肿瘤组织中的比例增加,但 PT 和 TT 之间没有显着差异,表明 CD8 + T 细胞在 PT 和 TT 中均已耗尽。在时间分析中,我们移除了 MAIT 细胞,因为它们具有不同的 TCR 特征。CD8-C1 到 C4 的连续发展轨迹代表了一个二元分支结构:CD8-C1 是根,CD8-C3 和 C4 是两个分支的结束状态,CD8-C2 处于过渡状态,在PTs和TTs之间非常相似。从轨迹的通路分析表明,T细胞活化和淋巴细胞分化较早,细胞周期、ATP代谢和缺氧相关通路在CD8 +的终末状态高度富集。这些结果表明,CD8 + T 细胞在 PTs 和 TTs 之间具有相同的过渡轨迹,伴随着功能失调和代谢紊乱,最终在 PTs 和 TTs 中都被耗尽。
有证据表明,某些处于祖细胞衰竭状态的CD8 + T细胞可以增强免疫检查点阻断(ICB)治疗黑色素瘤和肾癌的疗效。同时,考虑到一些 ccRCC 患者使用 ICB 治疗后 TT 的显着消退,我们询问是否有某些我们恢复的 CD8 + T 细胞亚群可能类似于祖细胞耗尽表型。然后,我们根据已发表的研究对 CD8 + T 细胞亚群的祖细胞和最终耗尽的基因特征进行评分]。我们注意到,CD8-C1 亚簇中的祖细胞耗尽签名显着富集,并且最终耗尽签名明显低于其他子集。此外,大多数祖细胞耗尽的特征基因在 TT 样本中的 CD8-C1 细胞中表达上调,这进一步证明了祖细胞耗尽的表型富含TT。此外,我们检查了一大群具有配对 PT 和 TT大转录组的患者,观察到与 PTs 相比,TTs 中 CD8-C1 亚群的比例显着增加,并且在 TTs 中,祖细胞耗尽和 CD8-C1 特征评分均上调。确定了 CD8-C1 细胞(组织驻留的 CD8 + T 细胞)及其特征在 TT 中比在 PT 中更丰富,我们接下来检查了我们发现的 CD8-C1 细胞是否会对抗 PD-1 治疗表现出更好的反应使用来自接受 nivolumab(抗 PD-1)治疗的更大规模 ccRCC 患者(CheckMate 025)的治疗前大量 RNA-seq 数据。总的来说,这些结果表明,原发性 ccRCC 和肿瘤血栓中组织驻留 CD8 + T 细胞的高特征可能是对 ICB 治疗反应良好的暗示。
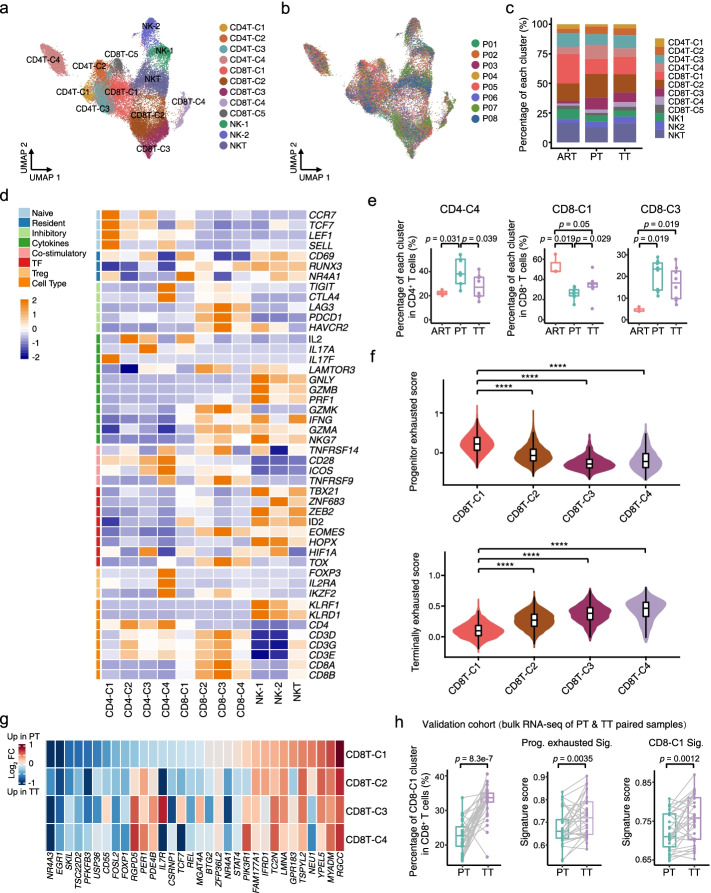
巨噬细胞在肿瘤血栓中表现出增强的 ECM 重塑活性,在原发性肿瘤中表现出免疫反应性扰动
除了适应性免疫外,先天免疫细胞可能是血管内 TT 快速扩展的第一道屏障,这可能对肿瘤血栓形成和对 ICB 治疗的抵抗有重要影响。因此,我们分析了 PT、TT和 ART中 16267 个骨髓细胞的转录组。骨髓细胞表现出显着的异质性,分为 14 个簇。基于典型标记的表达,我们将这些簇注释为巨噬细胞的六种亚型,单核细胞的两种亚型(Mono1-Mono2),DCs 的四种(DC1-DC4),中性粒细胞的一种和循环细胞的一种。与 ART 相比,巨噬细胞在 PT 和 TT 中富集,除了 Macro4 簇。与 ART 相比,PT 和 TT 中的中性粒细胞显着减少,暗示 PTs 和 TTs 的肿瘤细胞可能逃脱循环中性粒细胞的清除。为了更好地了解这些骨髓相关人群的作用,我们首先检查了免疫检查点和逃避相关的基因表达水平。除中性粒细胞外,几乎所有这些基因都在骨髓亚群中高度表达。虽然CD274 ( PD - L1 ) 和PDCD1LG2 ( PD - L2 ) 都是PD-1信号传导介导 T 细胞免疫检查点的配体,但在所有骨髓亚群中都很少检测到。这些结果表明,中性粒细胞可能更有效地对抗癌细胞,而其他巨噬细胞、单核细胞和 DC 可能已经被 PT 或 TT 肿瘤细胞影响。
巨噬细胞通常分为两种典型亚型,促炎 M1 和抗炎 M2。然而,我们无法通过已知的标记基因如CD86、TLR4 (M1) 和CD163和MSR1 (M2) 清楚地区分 M1 和 M2 巨噬细胞。虽然肿瘤相关巨噬细胞 (TAM) 标志物,以及作为M1/M2 和肿瘤相关巨噬细胞 (TAM) 标志物的CD68和HLA - DRA在每个巨噬细胞亚型中都高度表达,表明它们都是 TAM。有趣的是,我们注意到促炎表型中的基因表达特征显着富集,例如对干扰素的反应,以及与 TT 相比,PT 的 TAM 中的抗原呈递途径。令人惊讶的是,与 TT 相比,PT 中的这些 TAM 还上调了免疫检查点和逃避标记的表达。因此,PTs 中的 TAMs 表现出促炎和免疫抑制表型,可能有助于肿瘤细胞免疫逃逸。然而,在 TTs 中,我们观察到与肿瘤进展相关途径相关的特征评分增加,包括上皮-间质转化 (EMT)、细胞外结构组织和血管生成。总的来说,TAM 的复杂性表明 PT 和 TT 之间存在明显的功能障碍状态,PT 中具有更强的免疫抑制表型,并且 TT 中的 ECM 重塑增强。
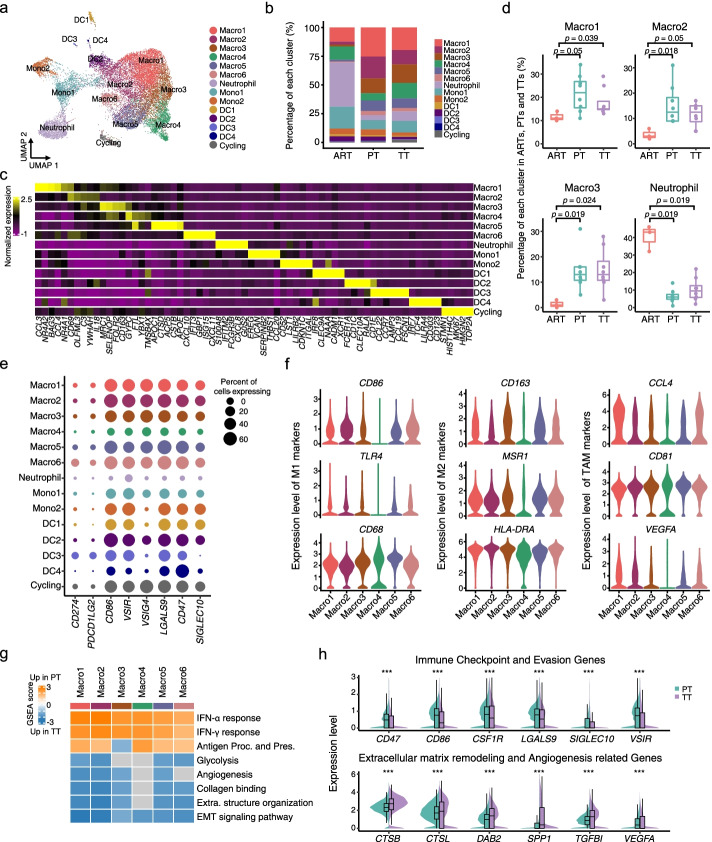
恶性细胞在肿瘤血栓中表现出增加的 ECM 重塑,在原发性肿瘤中表现出更强的免疫抑制表型
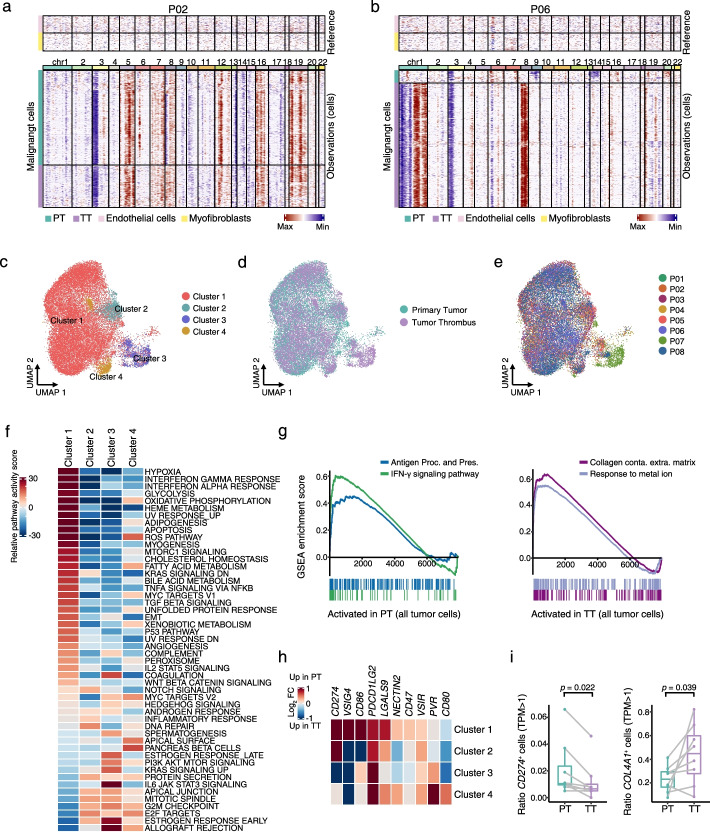
为了更好地了解可能与免疫细胞一起发挥作用的癌细胞中活跃的细胞程序,我们接下来试图确定 PT 和 TT 之间恶性细胞的表达模式。根据一项已发表的研究,通过使用肌成纤维细胞和内皮细胞作为参考,通过 scRNA-seq 数据推断的拷贝数变异 (CNV) 检测证实了肿瘤细胞。除患者 P06 外,8 名患者中有 7 名在 TT 和 PT 之间显示出相似的 CNV 模式和亚克隆结构,支持先前关于 TT 中有限的附加基因组改变的研究。然后,我们评估了PT和TT之间恶性细胞的转录差异。我们总共从 PT 中获得了15012个恶性上皮细胞,从TT标本中获得了12078个细胞。由于近端小管细胞已被确定为 ccRCC,然后我们比较了恶性细胞和近端小管细胞的缺氧和血管生成特征,这是导致致癌作用的两种经典生物状态。与先前的研究一致,PT 和 TT 恶性细胞的缺氧和血管生成特征明显高于来自 ART 的细胞。然后,针对恶性细胞,我们总共获得了4个簇,每个亚簇中个体患者的比例不同,进一步支持了高度的肿瘤间异质性。为了更好地理解它们的转录异质性,我们通过 GSVA Hallmark 分析对四个簇进行了评分,并观察到每个簇之间的显着转录程序差异。具体来说,簇 1 是最丰富的,其特征是缺氧、糖酵解、氧化磷酸化 (OXPHOS) 增加,以及伴随的免疫激活和代谢途径。另一项研究报告了 ccRCC 中糖酵解和 OXPHOS 代谢状态的共存,其中 RCC 中的混合表型有助于代谢可塑性,使癌细胞能够适应各种微环境。此外,有趣的是,与 TAM 相似,我们观察到与 TT 相比,PT 中与干扰素-γ (IFN-γ) 反应和抗原呈递途径相关的基因富集,免疫检查点和逃避基因的表达上调。它证明了它们促进免疫逃逸和抑制抗肿瘤免疫反应的能力。而 TT 肿瘤细胞在 ECM 重塑和对金属离子相关通路的反应中被激活。与这些结果一致,在 PT 中观察到显着更高比例的CD274 +恶性细胞,在 TT 中观察到更多的 COL4A1 + 肿瘤细胞,表明 PTs 中较高的免疫抑制状态和 TTs 中 ECM 的动态重塑。此外,我们发现经典的铁死亡抑制基因GPX4在 TTs 中表达上调,这意味着通过调节GPX4来诱导铁死亡可能在 TTs 中比在 ccRCC 患者的 PTs 中更有效。总之,在单细胞分辨率下,我们发现 PT 中的恶性细胞表现出更强的免疫抑制表型,而 TT 中的肿瘤细胞表现出更高的 ECM 重编程状态。
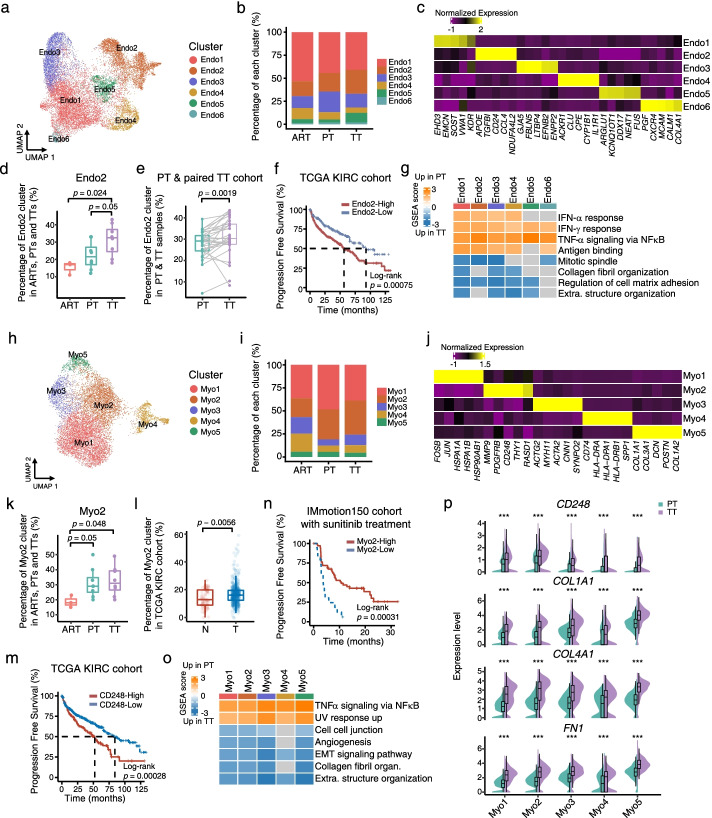
内皮细胞代表肿瘤血栓中 ECM 重塑相关通路的上调,高丰度的CCL4 +和NDUFA4L2 +内皮细胞与较差的存活率相关
为了进一步评估可能促进肿瘤血栓在血管内生长和扩展的内皮细胞作用,我们专注于内皮细胞 (EC),并从 PT、TT和ART。这些细胞被亚簇成六个不同的簇,它们中的每一个都是基于 ECs中的经典表达基因鉴定的,包括肾小球样 ECs (Endo1: SOST + )、癌症相关 ECs (Endo2 : NDUFA4L2 + )、动脉 ECs (Endo3: GJA5 + )、ACKR1 + ECs (Endo4: ACKR1 + )、尖端细胞 (Endo6: CXCR4 + )和一个未定义的簇 (Endo5)。此外,我们发现 TTs 中 Endo2 的比率高于 ARTs 和 PTs,表明与癌症相关的脉管系统形成可能有助于 TT 在血管内空间中的快速延伸。作为支持,我们通过分析来自具有 30 对 PT 和 TT 的大量患者的大量转录组,观察到 TT 中 Endo2 子集的百分比显着增加。此外,高水平的 Endo2 基因特征与 TCGA KIRC 队列中的低生存率显着相关。有趣的是,与 TAM 和恶性细胞一样,我们发现 PT 的 EC 中与干扰素反应和抗原结合途径相关的表达特征显着增加,但伴随着与 PT 和 TT 之间的 EC 子集的免疫抑制相关的基因表达的变化。同时,我们注意到在 Endo2 亚群中,与 TT 相比,PT 中大多数与免疫抑制相关的基因的表达水平上调,表明 PT 中的这些细胞可能处于更免疫抑制状态. 此外,我们发现 ECs 在 TTs 中具有增强的 ECM 重塑和细胞增殖活性。因此,这些数据表明,除了 TAM 和 TT 中的癌细胞外,TT 中的内皮细胞可能会修饰 ECM 以促进肿瘤血栓的生长,而针对具有 Endo2 特征的细胞的分子疗法可能能够特异性地降低腔静脉血栓的阶段。
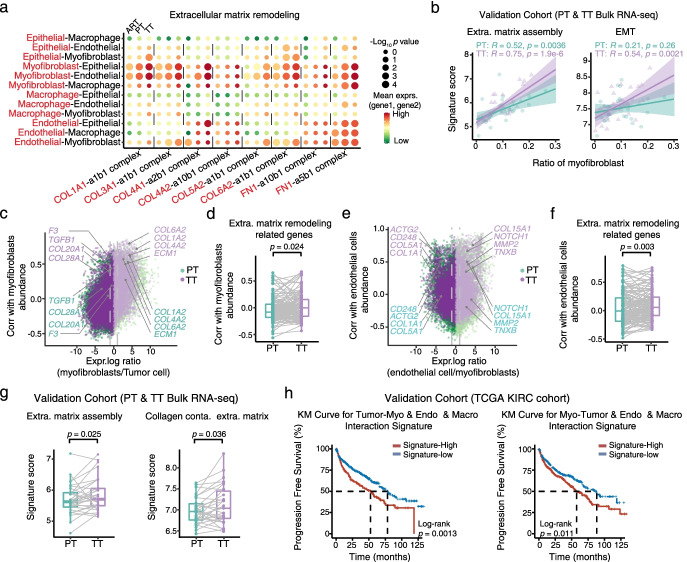
肿瘤-基质相互作用重塑了与存活率低相关的肿瘤血栓中的细胞外基质
鉴于与 PT 相比,活化的 ECM 重塑作为 TT 的巨噬细胞、恶性细胞、EC 和肌成纤维细胞的共同趋势的观察结果,我们假设不同的细胞群参与了复杂的串扰。为了识别可能的非细胞自主效应,我们使用 CellPhoneDB 通过已知的受体-配体对识别不同细胞群之间的假定信号传导。值得注意的是,与 ART 和 PT 相比,ECM 重塑途径中多个配体-受体对的相互作用在 TT 中更强,并且预测肌成纤维细胞具有与肿瘤细胞和 EC 显着相互作用的最强信号,无论它们的亚组如何。我们还在验证队列中使用 30 对PT和TT大量RNA-seq 数据验证了这一发现。与 TT 中基质细胞和其他类型细胞中 ECM 成分及其受体的上调表达一致,与 PT 相比,ECM 组装特征与 TT 中 CIBERSORTx 估计的肌成纤维细胞分数的相关性更强,支持 ECM 重塑相关通路在 TT 中比在 PT 中更激活。
鉴于肌成纤维细胞与恶性细胞和内皮细胞之间的强相互作用,我们首先检查了肿瘤细胞是否控制基质肌成纤维细胞的募集。我们发现了肌成纤维细胞和肿瘤细胞之间的广泛相互作用。详细地说,与 PT 相比,肿瘤细胞上调了 COL20A1、COL28A1和TGFB1的表达,以在 TT 中募集更多的肌成纤维细胞。此外,肌成纤维细胞释放胶原相关基因如COL6A2、COL1A2和COL4A2以促进细胞外基质组装,并且与 TTs 中肌成纤维细胞的丰度具有更高的相关性。TTs中肌成纤维细胞的相对丰度与肿瘤细胞中上调的细胞外基质重塑相关基因之间的相关性显着高于PTs。这些数据表明,肿瘤细胞可能通过分泌 ECM 相关成分在 TT 中募集更多的肌成纤维细胞。此外,我们还发现肌成纤维细胞在 TTs 中比在 PTs 中增强了 ECs 的募集,这可能促进血管生成。此外,在 30 对 PT 和 TT ccRCC 患者的验证队列中,TTs 中 ECM 组装、含胶原的 ECM 和细胞外结构组织的表达特征评分均高于 PTs。因此,我们发现肿瘤血栓中更强的肿瘤-基质相互作用伴随着肿瘤细胞和基质细胞中一组特定的 ECM 相关基因和通路的上调表达。
为了进一步研究肿瘤-基质相互作用与患者预后之间的关联,我们使用显着的 LR 对定义了两个相互作用特征评分,以计算 TCGA KIRC 队列中 ECM 重塑相关相互作用的强度。计算肿瘤细胞与肌成纤维细胞、内皮细胞和巨噬细胞之间的肿瘤-基质相互作用评分,而在肌成纤维细胞与肿瘤细胞、内皮细胞和巨噬细胞之间产生基质-肿瘤相互作用评分。值得注意的是,我们发现更强的肿瘤 - 基质相互作用与较差的生存率相关。总之,肿瘤-基质相互作用重塑了与存活率低相关的肿瘤血栓中的细胞外基质。
总之,本研究提供了原发性肿瘤和肿瘤血栓之间在肿瘤细胞、免疫细胞和基质细胞方面表型异质性的证据。我们的数据可以成为宝贵的资源,有助于更深入地了解与肿瘤血栓相关的机制,并有助于为晚期 ccRCC TT 患者开发更有效的新辅助分子疗法和生物标志物。






