听说过吗?单细胞免疫谱——揭示免疫治疗新机制
过敏性鼻炎已成为影响全球的问题。通常只有一种方法可以改善这种疾病,即抗体特异性免疫治疗,然而这种治疗的作用机制尚不清楚。本研究通过单细胞测序(scRNA-Seq)和单细胞保留库测序分析(scVDJ-Seq)揭示了该作用的部分机制为:舌下免疫治疗(SLIT)促进致病性Th2细胞上肌蛋白的表达并抑制Th2细胞功能。本研究于2022年6月发表在《Journal of Allergy And Clinical Immunology》IF:13.391期刊上。
技术路线

主要实验结果:
1、CD4+记忆T细胞的功能亚群和克隆比例
从SLIP治疗响应良好和较差的患者中获得SLIT治疗前1年和治疗后1年的外周血单核细胞(PBMC)。在用柳杉抗原孵育和刺激后,分离CD3+CD4+ CD45RO+ T细胞用于scRNA-Seq分析和T细胞受体(TCR)的scVDJ-Seq分析。将所有高质量细胞的TCR V(D)J数据合并,校正读取深度和线粒体读取计数,并进行PCA分析。根据已知转录因子和标记基因的表达水平,在PBMCs CD4+T记忆细胞中鉴定出7个T细胞簇(naive、Treg、Th2、T,h17、细胞毒性CD4、自然杀伤T和干扰素反应细胞)(图1A),图1B展示了7个亚群在不同样本中的分布,图1C展示了每个亚群的代表性基因表达(图1C)。在这些细胞中,TCR在67.2%-78.5%的细胞中表达(图1D),然而超过1个克隆的CD4+T记忆细胞在较差响应和良好响应的患者中分别占32.8%和21.5%,超过5个克隆的CD4+T记忆细胞在较差响应和良好响应的患者中分别占10.3%和4.7%。然后,比较T细胞克隆,这些簇的相对比例展示在UMAP中(图1E)。随着克隆数量的增加,克隆在效应细胞中积累。此外,结果显示多克隆T细胞主要是Th2,Th17,Treg,细胞毒性CD4细胞,值得注意的是克隆群体中Th2细胞亚群最多(图1F)。
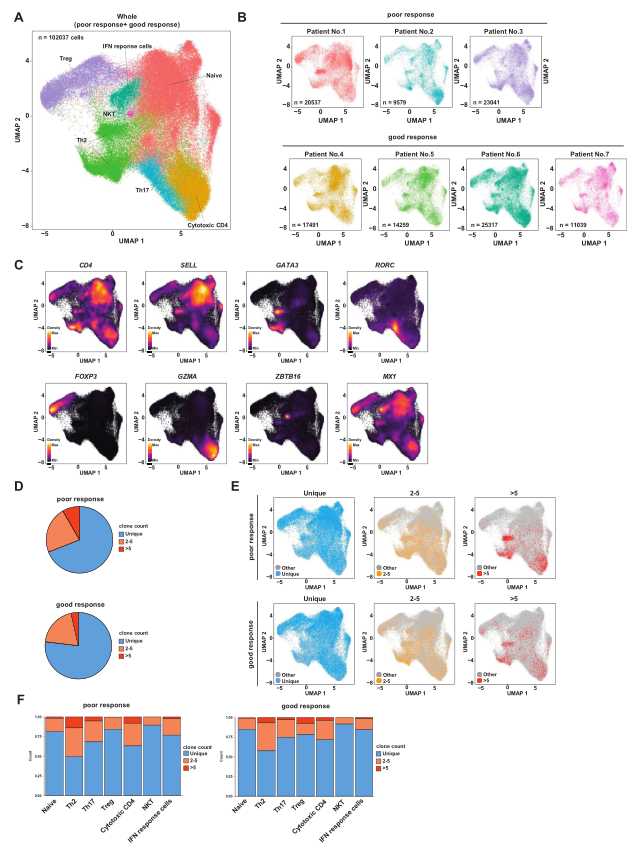
图1 scRNA-Seq和保留库分析揭示T细胞亚群的变化
2、SLIT前和后的T细胞亚群变化
为了探究T细胞响应,比较了抗柳杉抗原SLIT处理前后的T细胞亚群。尽管存在较大的个体差异,但如果不按克隆数分类,对反应较差和反应较好的T细胞亚群,在SLIT前和SLIT后都看不到整体T细胞亚群的一致变化(图2A-B)。因此,作者重新分析了这些细胞,将它们分为形成单个克隆的独特细胞群和形成多个克隆的克隆群体。观察到独特细胞群和2-5克隆细胞群在SLIT前后没有明显变化,而>5的克隆细胞群显示Th2和Treg细胞只在反应良好的患者中扩增(图2C)。

接下来,作者比较了所有患者CDR3区TRA和TRB的氨基酸序列,以评估在SLIT前后TCR保留库的改变对抗原特异性的影响。克隆频率较高的前7个CDR区域的T细胞克隆在SLIT前后的重叠率为60% ~ 80%(图3A)。此外,如果克隆数量限制在>5,在SLIT前和后的样本中,TRA和TRB的CDR区域都有80%的重叠(图3B)。

图3 SLIT前和后的TCR保留库变化
3、SLIT前和后的Th2细胞和Treg细胞的功能性调节
由于前问结果提示,SLIT可诱导Th2和Treg细胞克隆扩增,并具有相同的抗原特异性,因此作者对SLIT后出现克隆扩增的Th2和Treg细胞进行免疫谱分析,并进行PCA分析以提高分辨度并重新评估免疫谱(图4A)。结果显示,根据IL-5、IL-13、PTGDR2 (CRTH2)、KLRB1 (CD161)的表达,Th2细胞可分为2个簇:一个高功能的Tpath2细胞群和一个功能受损的Th2细胞群(Trans Th2)(图4B)。接下来,进行轨迹分析,以确定这些细胞群的分化途径,并根据基因表达谱的相似性评估假时间,发现Th2细胞中存在由Tpath2细胞向Trans Th2细胞分化的轨迹(图4C),同时在Trans Th2细胞和Treg细胞群之间有连续的中间细胞,表明Trans Th2细胞向Treg细胞分化。此外,通过对这些SLIT前后的TCR克隆细胞群比较,发现对反应良好的多克隆细胞,尤其是>5克隆中,SLIT处理后,Treg细胞和Trans Th2细胞以及Tpath2细胞的克隆扩增减少(图4D-4E)。这些结果暗示了Trans Th2细胞克隆转分化为Treg细胞的可能性。
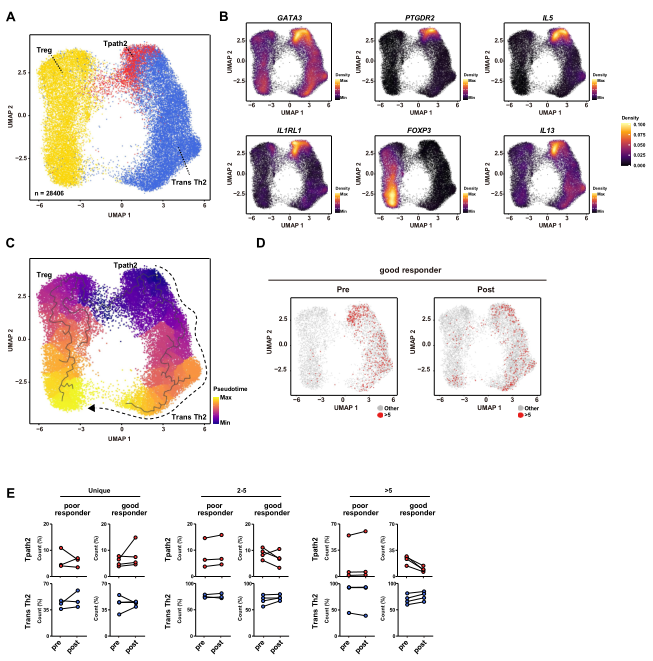
4、从Th2细胞到Treg细胞的遗传漂移
接下来,全面比较了每个细胞群体的基因表达谱,以寻找促进Trans Th2细胞介导向Treg细胞分化和SLIT后免疫耐受的功能分子。结果发现,与Tpath2细胞相比,在Trans Th2细胞中,抑制Th2细胞转录程序的转录因子musculin(MSC)和T细胞迁移抑制受体LPAR6的表达高度上调(图5A)。在Trans Th2细胞中,MSC在分化轨迹末端也有高特异性表达(图5B)。Trans Th2细胞和Treg细胞的比较显示,Treg细胞中FOXP3、抑制性细胞因子如TGF-β和IL-10RA以及抑制性免疫检查点因子CTLA4的表达更高。关于每个 T 细胞亚群中 SLIT 后的变化,MSC 和 IL-2 表达在 Trans Th2 中SLIT后上调,而TGF-β 表达在 Trans Th2和Treg细胞中SLIT后都上调(图5C)。
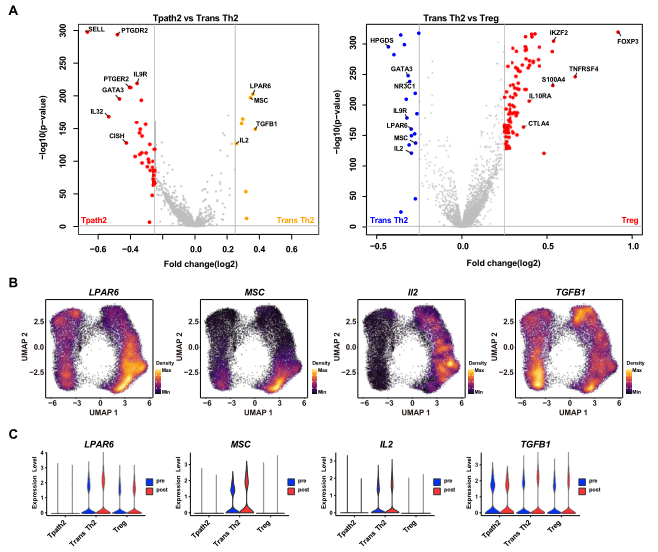
图5 比较功能性Th2细胞,功能抑制Th2细胞,Treg细胞间的基因表达
5、生物标志物的潜力
鉴于MSC和IL-2表达的这些变化,以及它们在Trans Th2细胞中的强表达,作者从抑制Th2细胞功能的角度,在之前的柳杉抗原的SLIT临床试验样本中,研究这些分子是否可以作为SLIT的生物标志物。为了评估它们作为生物标志物的实用性,通过PCR检测了抗原刺激后整个PBMCs中MSC和IL-2的表达。与安慰剂组在SLIT后MSC没有特别增加的样本相比,活性药物组在治疗开始后1年MSC显著增加(图6B),IL-2表达在治疗1年后也呈上升趋势(图6C)。此外,还分析了36例门诊患者,以确定MSC是否可以作为SLIT疗效的生物标志物。SLIT治疗前和治疗后1年培养的PBMCs中,反应良好的患者在SLIT后MSC表达明显增加(图7A)。然而,IL-2表达未见明显变化(图7B)。这些结果证明了评估 MSC在PBMC中的功效作为评估对SLIT的治愈反应的有用性。
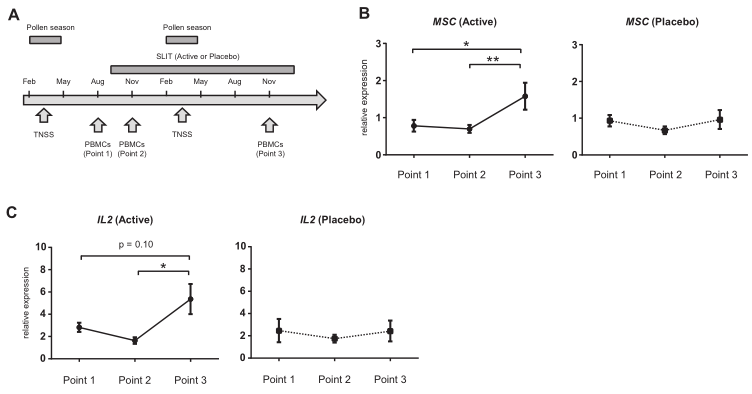
图6 2/3期临床试验标本中MSC和IL-2的分析
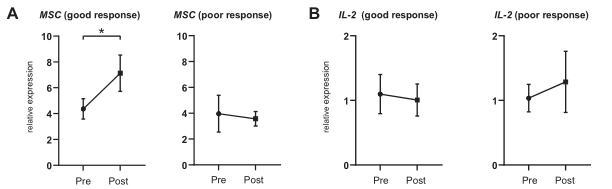
图7 从反应好的和反应差的患者标本中分析MSC和IL-2的表达
总之,本文通过结合单细胞分析和保留库分析描述了SLIT引起的症状减轻机制。 具体而言,促进 MSC 在 Tpath2 细胞中的表达可能通过抑制 Th2 细胞功能并允许它们分化成 Treg 细胞来促进 SLIT 诱导的症状减轻。目前正在设计各种过敏原特异性免疫疗法。由于MSC表达可用作其功效的标志,开发有效产生 MSC 的方法可以提高这种疗法的有效性。
参考文献:
Iinuma Tomohisa., Kiuchi Masahiro., Hirahara Kiyoshi., Kurita Junya., Kokubo Kota., Yagyu Hiroyuki., Yoneda Riyo., Arai Tomoyuki., Sonobe Yuri., Fukuyo Masaki., Kaneda Atsushi., Yonekura Syuji., Nakayama Toshinori., Okamoto Yoshitaka., Hanazawa Toyoyuki.(2022). Single-cell immunoprofiling after immunotherapy for allergic rhinitis reveals functional suppression of pathogenic Th2 cells and clonal conversion. J Allergy Clin Immunol, undefined(undefined), undefined. doi:10.1016/j.jaci.2022.06.024






