肠道生物失调促进前列腺癌进展和多西他赛耐药
据报道,肠道菌群参与了各种人类恶性肿瘤的进展和化疗耐药性。本研究旨在初步阐明肠道生态失调与前列腺癌的关系。首先,我们发现使用广谱抗生素干扰肠道菌群可以促进小鼠皮下和原位肿瘤的生长。粪便菌群移植可传递抗生素暴露对肿瘤生长的影响。然后,对小鼠粪便的16S rRNA测序表明,Proteobacteria在抗生素处理后的相对丰度显著升高。同时,随着肠通透性的升高,瘤内脂多糖(LPS)含量显著增加。体内和体外实验均显示,肿瘤内LPS激活NF-κB-IL6-STAT3轴促进前列腺癌增殖和多西他赛化疗耐药。最后,通过对患者粪便样本的16S rRNA测序发现,转移性前列腺癌患者中Proteobacteria富集,与血浆IL6水平、区域淋巴结转移状态、远处转移状态呈正相关。ROC曲线显示,Proteobacteria的相对丰度在预测前列腺癌远处转移概率方面优于前列腺特异性抗原水平。总之,这项研究证明了肠道失衡,其特征是由于抗生素暴露导致变形杆菌的富集,导致肠道通透性和瘤内LPS的提高,通过NF-κB-IL6-STAT3轴促进小鼠前列腺癌的发展。本研究于2022年6月发布于“Microbiome”(IF=16.837)上。
技术路线
结果
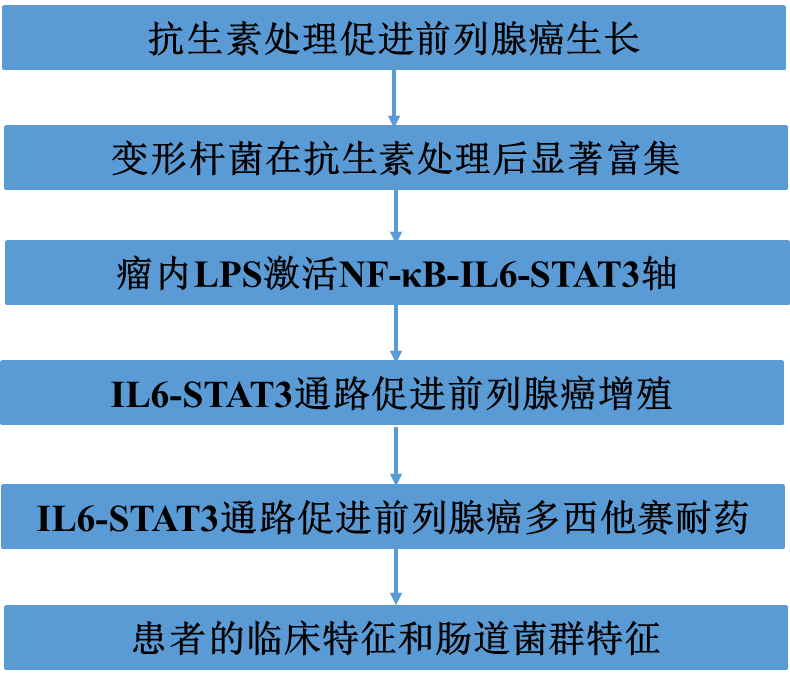
1)抗生素处理促进前列腺癌生长
通过口服抗生素建立小鼠肠道生态紊乱模型。C57BL/6J小鼠连续灌胃加广谱抗生素的水,包括氨苄西林、粘菌素、新霉素、万古霉素(以下简称Abx),随后用RM-1(小鼠CRPC细胞系)进行前列腺癌肿瘤移植(图1A)。饲养4-5周后,与阴性对照组(NC)相比,抗生素干预有效增加了皮下肿瘤体积和体重(图1B)。在原位移植肿瘤中也观察到了同样的结果(图1C)。此外,为了确定肠道菌群是否对其负责,我们进行了FMT(图1D)。结果显示,与FMT-NC组相比,FMT-Abx组皮下肿瘤体积和肿瘤重量增加(图1E)。肿瘤组织免疫组化分析显示,Abx和FMT-Abx组Ki-67阳性肿瘤细胞数量上调(图1F)。这些结果表明,抗生素处理促进小鼠前列腺癌的生长,这与扰乱肠道菌群有关。
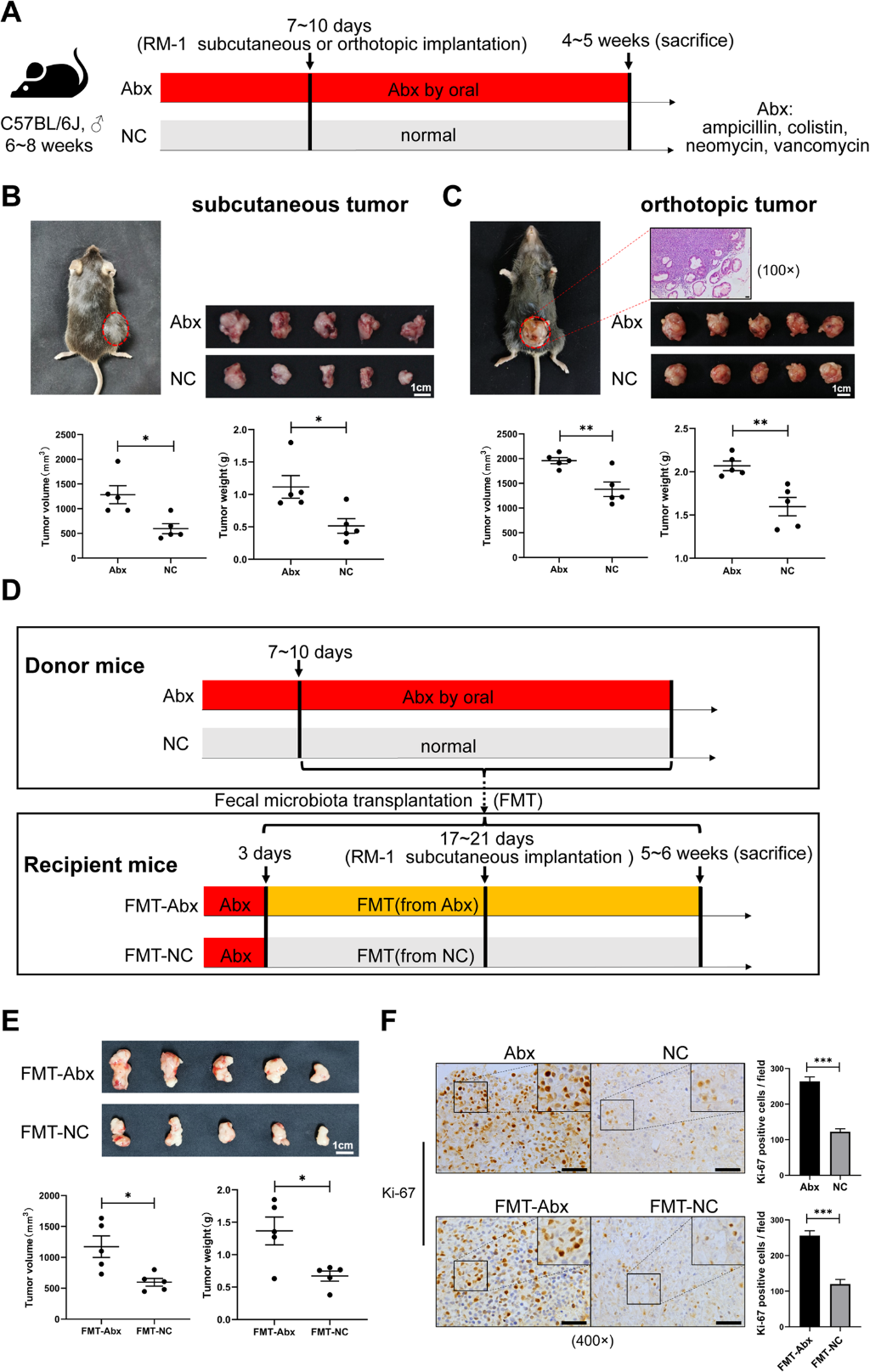
2)变形杆菌在抗生素处理后显著富集
为研究小鼠肠道菌群组成,收集Abx组、FMT-Abx组、NC组和FMT-NC组小鼠粪便样本,进行16S rRNA测序。结果显示Abx和FMT-Abx组以及NC和FMT-NC组之间存在相似的细菌群落组成(图2A)。接下来,在不同的分类水平上评估四个组的肠道菌群概况。我们发现,在门水平上,Bacteroidetes和Firmicutes的相对丰度在NC和FMT-NC组中占优势,而Proteobacteria的相对丰度在Abx和FMT-Abx组中显著富集(图2B)。在科水平上,Abx和FMT-Abx组的Muribaculaceae和Lachnospiraceae明显减少(图2C)。我们发现Proteobacteria在Abx和FMT-Abx组中得分最高(图2D)。总之,抗生素显著改变了肠道细菌群落的组成。变形菌门的相对丰度显著增加,这被认为是肠道生态失调的标志。
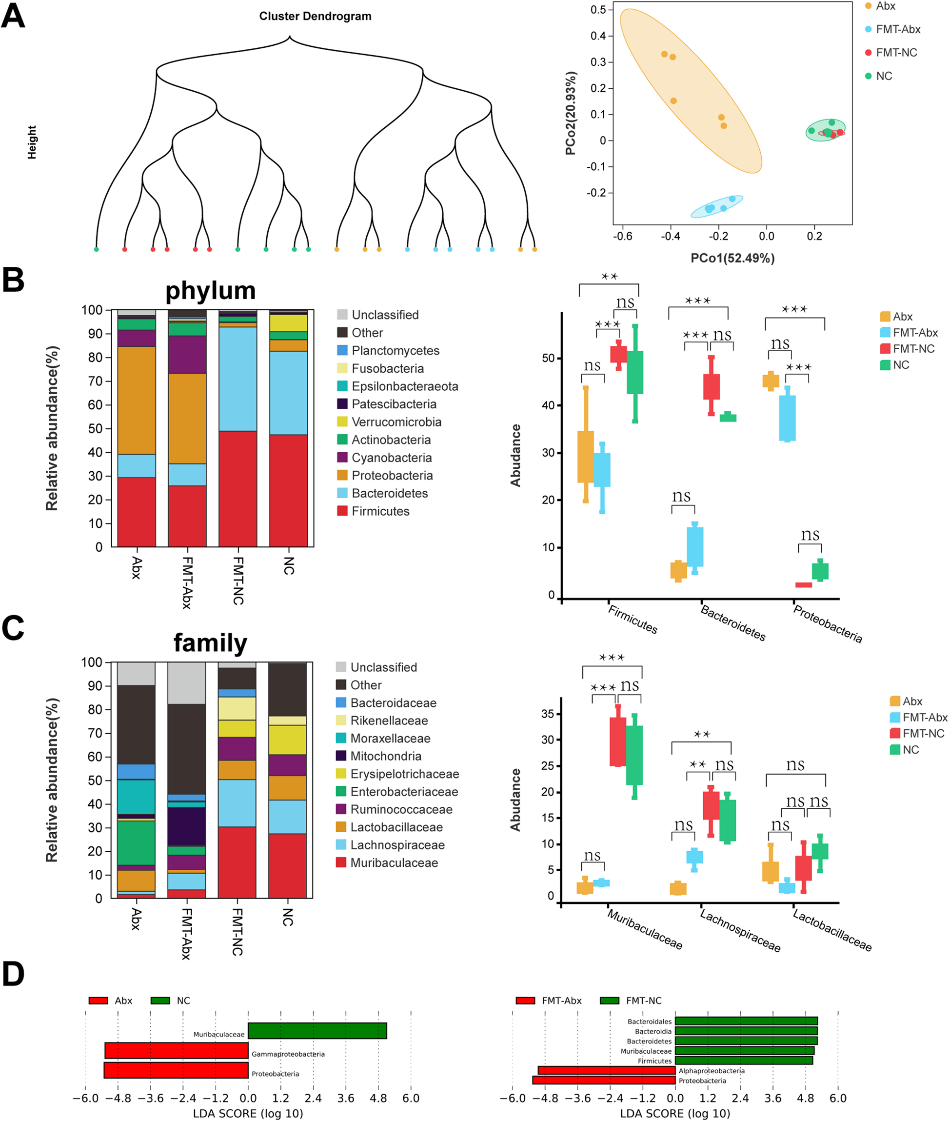
3)瘤内LPS激活NF-κB-IL6-STAT3轴
根据前述测序结果,我们假设肠道失衡(以Proteobacteria的富集为特征)破坏了肠道屏障,LPS被释放进入循环,到达肿瘤。为了证明这一点,我们进行了ELISA检测,结果显示NC组的粪便中LPS水平明显高于Abx组,但血清中LPS水平与Abx组相反。此外,Abx组结肠也有一定程度的损伤(图3A)。Abx组的肿瘤中LPS明显增加(图3B)。接着,我们采用大肠杆菌重组LPS进行细胞培养,通过RT-qPCR检测细胞因子转录水平。我们发现IL6的相对倍数变化明显高于其他细胞因子。随后,ELISA检测证实细胞上清中IL6蛋白水平也显著升高(图3C)。我们通过RPPA发现IL6与p-STAT3 (Tyr705)呈正相关,GSEA显示JAK-STAT通路上调。同时发现p-STAT3与p-p65的表达水平呈正相关(补充图,未展示)。相应地,我们发现p-p65和p-STAT3在LPS作用下在RM-1细胞核中增加(图3D),并且在体外呈剂量依赖性(图3E)。在p65磷酸化抑制剂的存在下,IL6的转录水平降低,p-p65和p-STAT3的蛋白水平也降低。为了进一步证实IL6的作用和作用方式,我们通过收集LPS培养肿瘤细胞产生的细胞上清,建立条件培养基(CM)。与CM相比,在CM中加入IL6抗体后p-STAT3减弱(图3E)。与此相一致的是,通过ELISA检测,与NC组相比,Abx组肿瘤组织裂解液和血清中IL6的浓度升高。通过western blot和免疫组化分析,p-p65和p-STAT3也得到了相同的结果(图3F, G)。总之,在肠道通透性上调的情况下,瘤内LPS升高,并在肠道失衡小鼠中激活NF-κB-IL6-STAT3轴。
4)IL6-STAT3通路促进前列腺癌增殖
IL6-STAT3通路已被证实能够促进多种恶性肿瘤的进展。我们选择RM-1和DU-145(人CRPC细胞系)进行体外实验。与上述结果一致的是,western blot结果显示,在CM培养的细胞中,p-STAT3升高,而在STAT3磷酸化抑制剂存在时,p-STAT3降低。STAT3下游增殖相关基因,如cyclin D1和c-myc,在RM-1和DU-145中都发生了相应的改变(图4A)。同时,采用Edu检测法和克隆形成法检测前列腺癌细胞体外增殖能力,结果表明抑制IL6-STAT3通路可抑制前列腺癌细胞系增殖(图4B, C)。在体内实验中,与Abx组相比,Abx+Stattic组肿瘤体积和重量显著降低(图4D)。肿瘤组织免疫组化分析显示,与NC组相比,Abx组中p-STAT3、cyclin D1、c-myc增强,而Abx+ Stattic组中p-STAT3、cyclin D1、c-myc降低(图4E)。
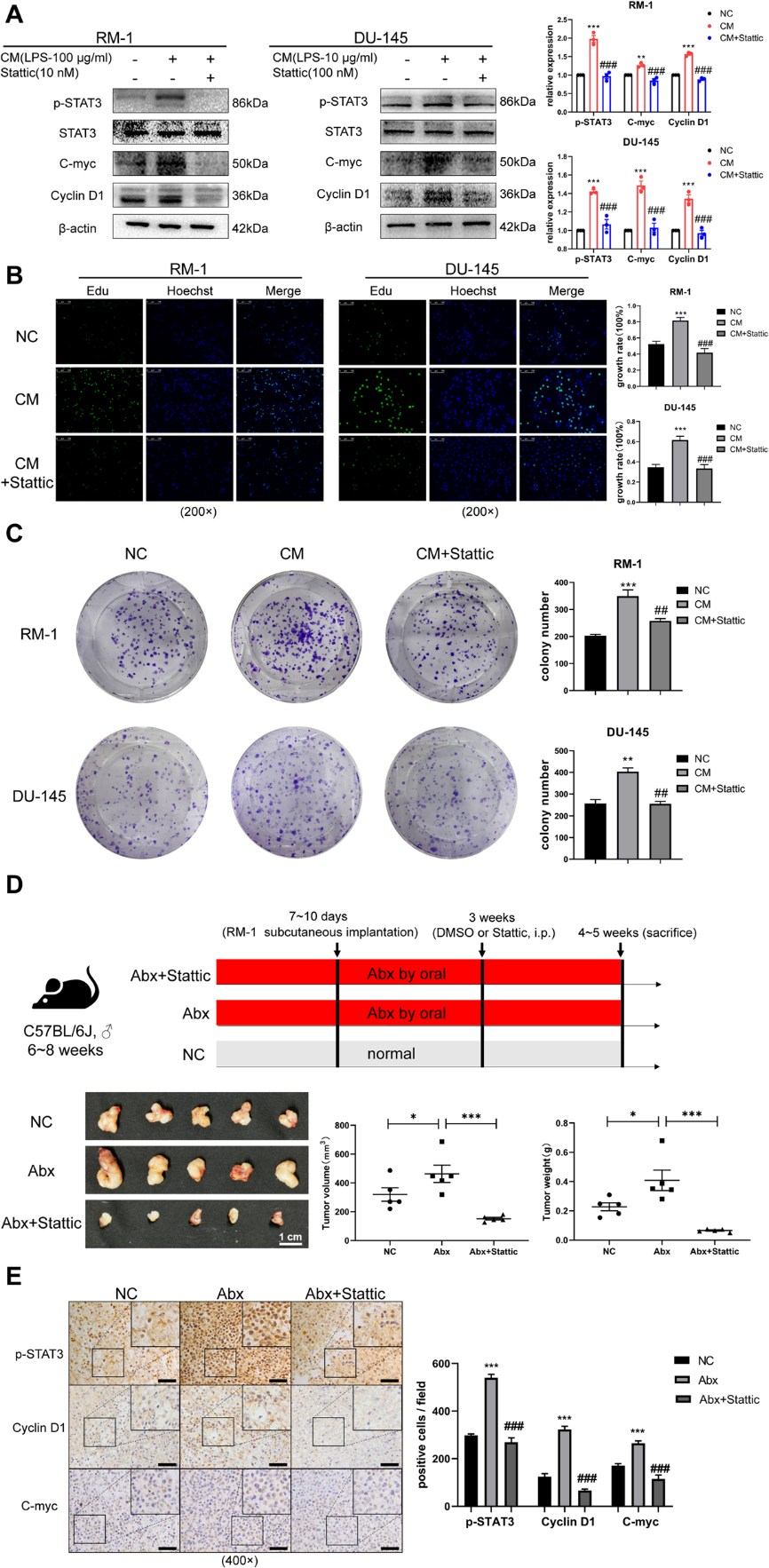
5)IL6-STAT3通路促进前列腺癌多西他赛耐药
多西他赛作为CRPC的一线治疗手段,在临床上不可避免地会导致耐药,其潜在机制之一可能是IL6-STAT3通路的激活。两株细胞RM-1和DU-145在空白、CM单独和CM加Stattic三种条件下培养24 h。在上述处理之后,我们将多西他赛添加到培养基中培养24小时。Western blot结果显示,来自CM培养系统的细胞中p-STAT3增加,但使用Stattic后降低。有趣的是,多西他赛治疗可能会增加这些水平(图5A)。细胞活力和TUNEL实验表明,抑制IL6-STAT3通路可以改善前列腺癌细胞对多西他赛的耐受性(图5B, C)。体内实验进一步证实了这一结论。多西他赛能显著降低正常喂养小鼠的肿瘤体积和体重,但对肠道生态失调小鼠没有效果。然而,联合使用多西他赛和Stattic可显著降低肿瘤体积和重量(图5D)。肿瘤组织免疫组化分析显示p-STAT3、Bcl-2、survivin发生相应变化(图5E)。这些结果表明,IL6-STAT3通路在肠道失衡小鼠肿瘤中被激活,促进前列腺癌的增殖和多西他赛耐药。
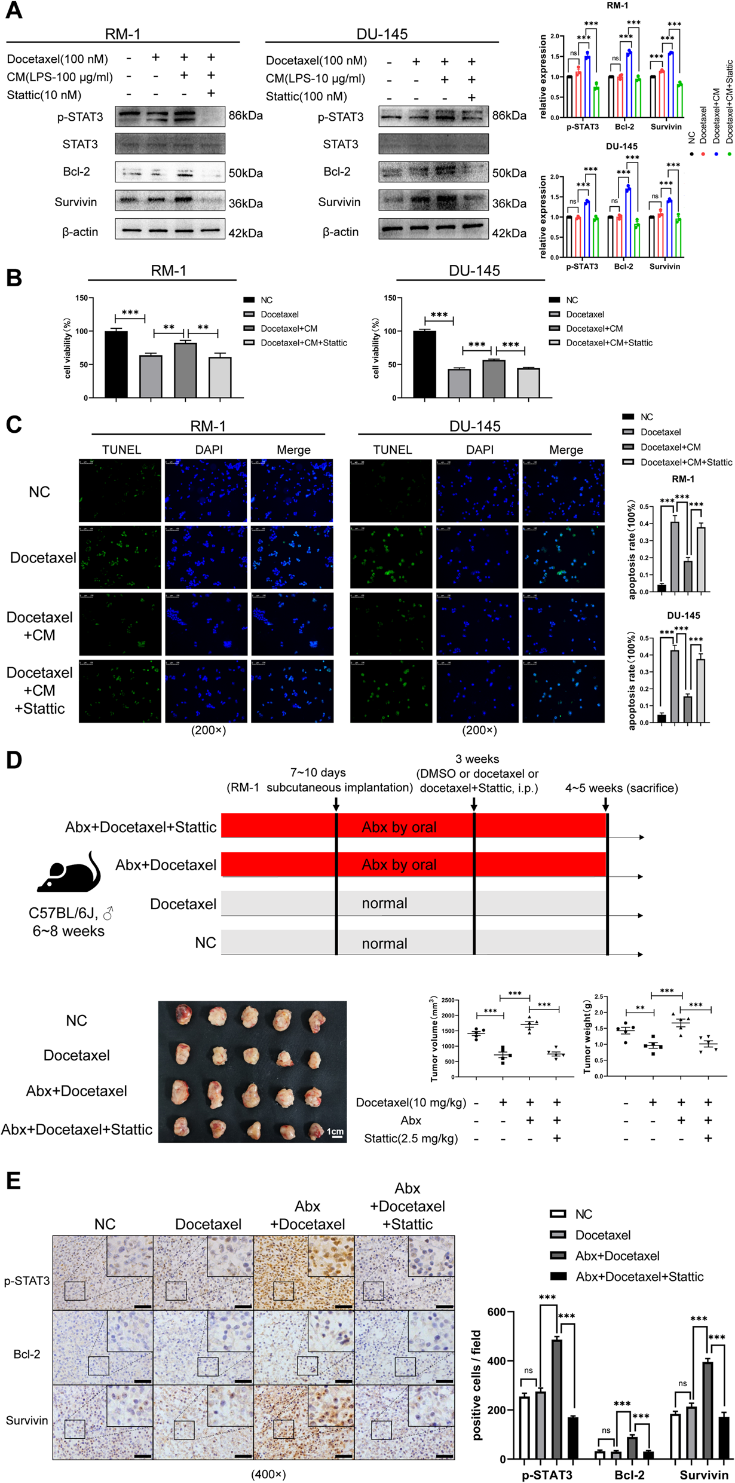
6)患者的临床特征和肠道菌群特征
了解肠道菌群对前列腺癌进展风险的影响需要从临床患者样本中获得进一步的证据。本研究招募了良性前列腺增生(BPH)、非转移性前列腺癌和转移性前列腺癌患者。对患者粪便样本进行16S rRNA测序,我们发现三组之间的α-和β-多样性无显著差异(图6A、B)。值得注意的是,在门水平上的细菌组成表明,转移性前列腺癌患者的Proteobacteria相对丰度高于非转移性前列腺癌或BPH患者,并且在前列腺癌和BPH患者之间也存在差异(图6C)。Proteobacteria的相对丰度与血浆IL6水平、区域淋巴结转移状况、远处转移状况呈正相关(图6D)。ROC曲线显示,虽然Proteobacteria不能区分前列腺癌和BPH,但它在预测远处转移方面比PSA水平更有潜力(图6E)。
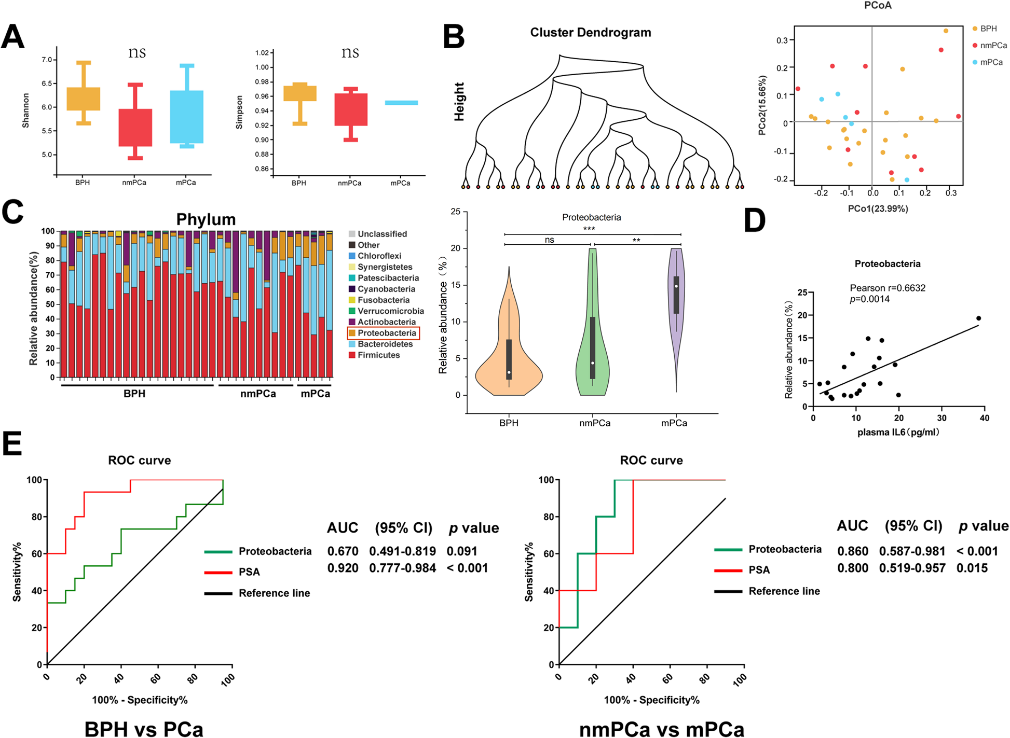
结论:抗生素有效促进前列腺癌的生长,这是由肠道菌群介导的。抗生素处理后,Proteobacteria的相对丰度较高,且随着肠通透性升高,瘤内LPS增加,通过NF-κB-IL6-STAT3轴在前列腺癌进展中发挥重要作用。此外,变形杆菌可能被用作进展性前列腺癌的肠道生物标志物。
参考文献:
Zhong W, Wu K, Long Z, Zhou X, Zhong C, Wang S, Lai H, Guo Y, Lv D, Lu J, Mao X. Gut dysbiosis promotes prostate cancer progression and docetaxel resistance via activating NF-κB-IL6-STAT3 axis. Microbiome. 2022 Jun 16;10(1):94. doi: 10.1186/s40168-022-01289-w.






