环状RNA Cwc27通过抑制Pur-α活性促进阿尔茨海默症发病机制
环状RNA(circRNAs)在参与各种生物过程和参考多种疾病方面受到越来越多的关注。虽然阿尔茨海默症(AD)中差异表达的circRNA已经建立,但与AD直接相关的关键circRNA在基因表达和疾病相关认知中的精确特征和功能尚不清楚。在此,作者筛选并鉴定了circCwc27这一与AD相关的新型circRNA。该研究于2022年2月发表在《Cell Death Differentiation》,IF:10.717。
技术路线:
主要研究结果:
1. CircCwc27在AD中上调
作者的目标是筛选AD早期有希望的circRNA,收集6月龄的APP/PS1转基因和WT对照小鼠海马体。共有131个circRNA显著失调,热图中显示了上调和下调最高的15个circRNA(图1A)。在这30个circRNA中,Rybak-Wolf等人鉴定出13个在人和小鼠之间保守的circRNA。APP/PS1小鼠和WT小鼠的海马体比较中,有4个circRNA显著上调,4个circRNA显著下调(图1B)。在APP/PS1小鼠的海马区观察到AD患者的颞叶皮质和血浆中检测到circCwc27(mmu_circ_0004423)明显升高(图1C),并且在海马区表达量最高(图1D)。
2. CircCwc27是一个丰富、稳定的circRNA,主要定位于神经元的细胞质中
在大脑皮层和海马体中观察到circCwc27高度表达,这是大脑中两个脆弱的区域(图1E)。此外,在APP/PS1小鼠和WT小鼠的大脑中,circCwc27主要表达在神经元而非神经胶质细胞中(图1F和G)。同时检测了circCwc27的绝对拷贝数,结果显示,每个人的海马神经元中平均有98个circCwc27拷贝,SH-SY5Y细胞中有78个circCwc27拷贝(图1H)。
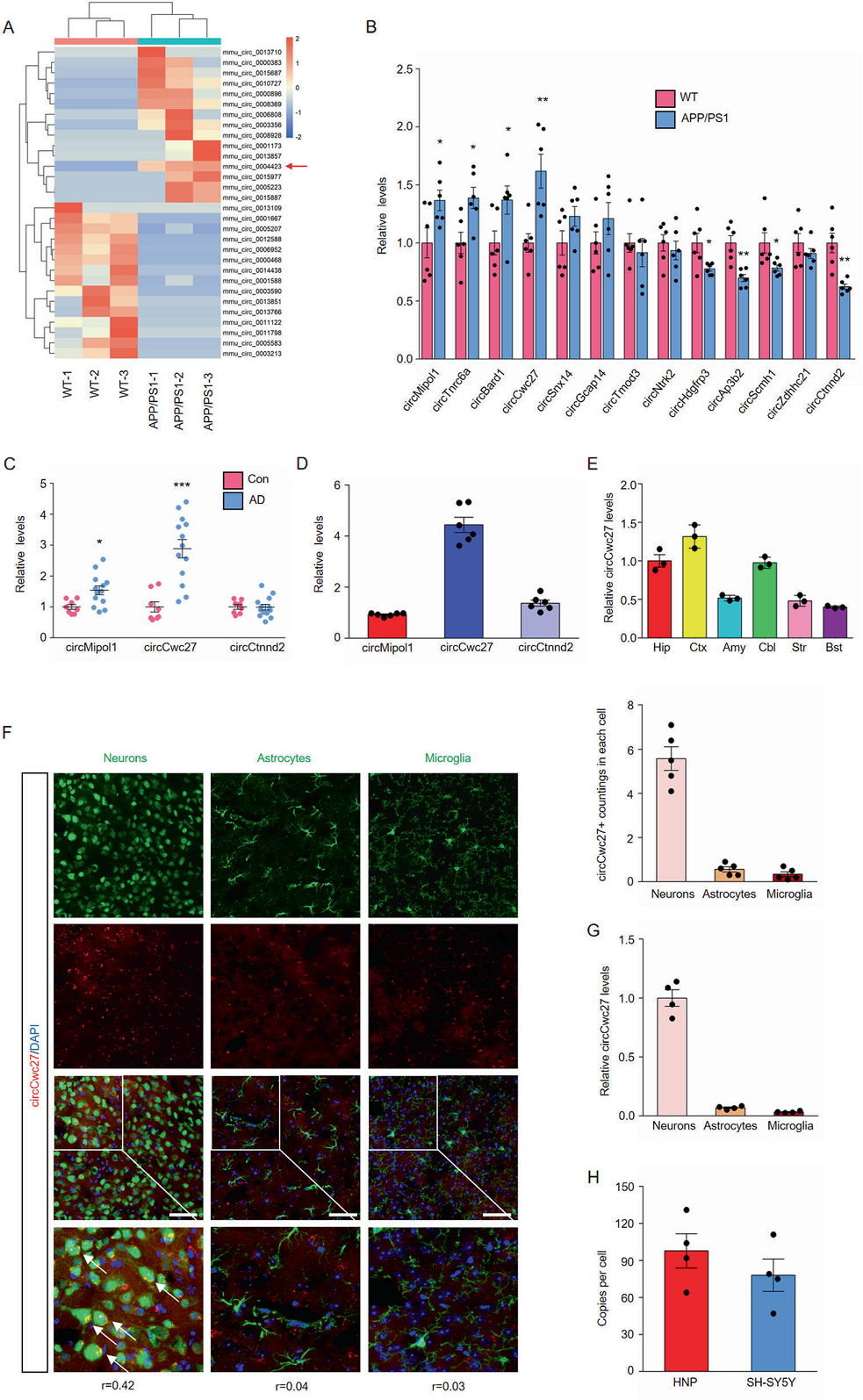
图1. CircCwc27是一个高度丰富且稳定的circRNA,在AD中表达上调
3. 在APP/PS1小鼠中敲除circCwc27可改善儿童的认知能力下降
将表达shRNA circCon-GFP(LV-sh-circCon)或shRNA circCwc27-GFP(LV-sh-circCwc27)的慢病毒微注射到9月龄小鼠侧脑室,2个月后分析小鼠的记忆和空间学习能力(图2A)。绿色荧光蛋白(GFP)信号主要分布在整个皮层和海马区,并与神经元共定位(图2B和C)。CircCwc27表达显著下调,慢病毒转导后Cwc27水平保持不变(图2D)。Y迷宫自发交替行为测试显示APP/PS1小鼠微注射LV-sh-circCon后,交替性明显下降,而抑制circCwc27则能显著阻止这种下降(图2E)。组间相同的条目数不支持运动功能缺损(图2F)。
在训练阶段,APP/PS1小鼠中微注射LV-sh-circCon,发现隐藏平台的潜伏期明显延长,而微注射LV-sh-circCwc27提高了学习能力(图2G和H)。在探针试验中,记忆保持是通过在包含隐藏平台的象限所花费的时间来衡量的。结果表明,下调circCwc27可以改善APP/PS1小鼠的空间记忆(图2I和K)。另外,所有组小鼠的游泳速度都相似(图2J)。综上所述,这些数据表明,敲除circCwc27在很大程度上改善了AD的认知衰退。

图2. 在APP/PS1小鼠模型中敲除circCwc27可改善空间学习记忆
4. 在APP/PS1小鼠中,下调circCwc27可防止Aβ沉积及相关神经退行性影响
应用Aβ抗体(NAB228)对APP/PS1小鼠脑组织进行染色,结果显示微注射LV-sh-circCwc27明显降低了斑块负荷(图3A)。注射LV-sh-circCwc27后,大脑皮层和海马区可溶性和不可溶性Aβ40和Aβ42水平均持续下降(图3B-E)。此外,观察到circCwc27的表达与APP/PS1小鼠组Aβ40(图3F)或Aβ42水平(图3G)成正相关。在小鼠海马中微注射LV-sh-circCwc27,Aβ与营养不良神经细胞共定位的区域显著减少(图3H)。WT小鼠微注射LV-sh-circCwc27不影响突触相关蛋白的表达,而APP/PS1小鼠明显抑制其下降(图3I)。APP/PS1小鼠微注射LV-sh-circCwc27可显著降低小胶质细胞和星形胶质细胞的活化(图3J)。上述结果表明,circCwc27基因的下调在AD的神经炎症和神经退行性作用中发挥了保护作用。

图3. 敲除circCwc27可改善APP/PS1小鼠的AD病理
5. CircCwc27直接与Pur-α蛋白结合并影响其分布
下一步的目标是阐明circCwc27引起AD病理的分子机制。通过RNA免疫沉淀(RIP),观察到内源性circCwc27没有在AGO2上富集(图4A)。因此,进行RNA下拉分析和质谱(MS)分析,在APP/PS1小鼠海马中寻找潜在的circCwc27相互作用的蛋白(图4B)。共有154个蛋白被circCwc27连接探针拉下,这些蛋白大多在大脑中富集。GO富集分析显示,这些蛋白大多与RNA/DNA结合相关(图4C)。
RIP检测结果表明,Pur-α抗体和HNRNPK抗体可拉低circCwc27,而不是SH-SY5Y细胞中的其他三个候选者(图4D)。RNA下拉结果也验证了circCwc27与Pur-α的直接相互作用(图4E)。再进一步验证了circCwc27与Pur-α的内源性共定位(图4F)。RIP检测结果显示,与circCwc27直接结合的只有PUR重复结构域(66-246aa),没有其他结构域(图4G)。
与WT小鼠相比,APP/PS1和APP/PS1-LV-sh-circCon小鼠海马区circCwc27介导的Pur-α水平显著上调(图4H)。敲除circCwc27在APP/PS1小鼠能显著降低circCwc27与Pur-α的结合(图4H)。在RIP测定中也得到了类似的结果(图4I)。免疫印迹结果显示,APP/PS1小鼠细胞核Pur-α表达明显降低,胞浆Pur-α表达增加(图4J和K)。注射LV-sh-circCwc27可显著促进Pur-α的核分布(图4J和K)。总之,结果表明,增加circCwc27与Pur-α相互作用并将其捕获在细胞质中,而敲除circCwc27可促进Pur-α的核转位。
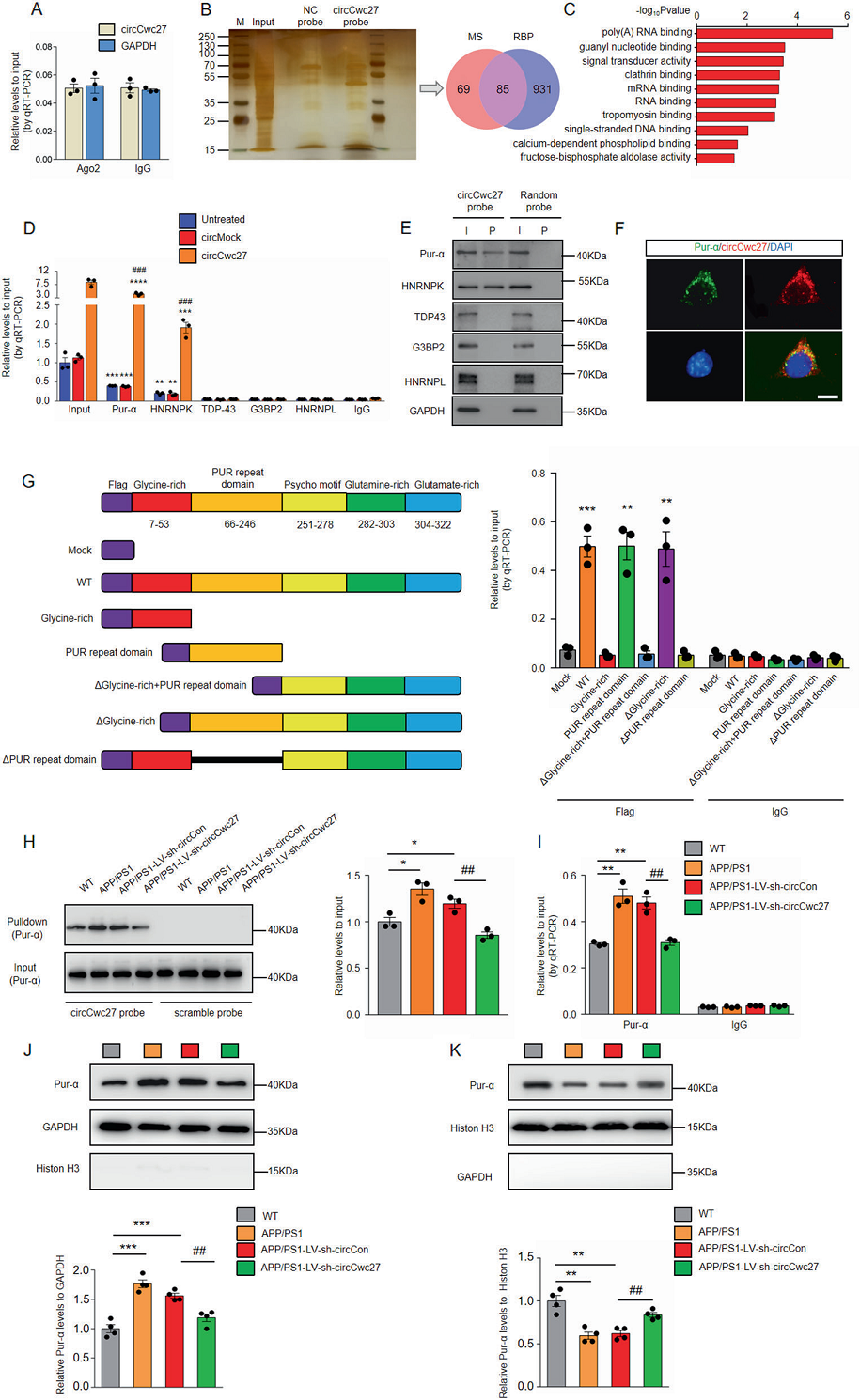
图4. CircCwc27与Pur-α蛋白相互作用并影响其分布
6. Pur-α降低Aβ负荷,防止AD患者认知能力下降
将携带Flag-labeled Control-GFP(Flag-AAV9-Control)或Pur-α(Flag-AAV9-Pur-α)的腺相关病毒制剂微注射到APP/PS1小鼠海马中,观察Pur-α对AD病理的影响。立体定向注射两个月后,海马区出现明显的绿色荧光和约42 kDa的Flag表达,表明有效的信号转导(图5A-C)。值得注意的是,在Pur-α过表达的大脑中,circCwc27的表达没有变化(图5D)。与对照组相比,过表达Pur-α可显著减少APP/PS1小鼠海马区Aβ沉积和促炎细胞因子(图5E和F)。微注射Flag-AAV9-Pur-α在很大程度上保护APP/PS1小鼠的记忆形成严重缺陷(图5G-I)。综上所述,这些结果表明Pur-α可以减少Aβ沉积,挽救空间记忆损伤。
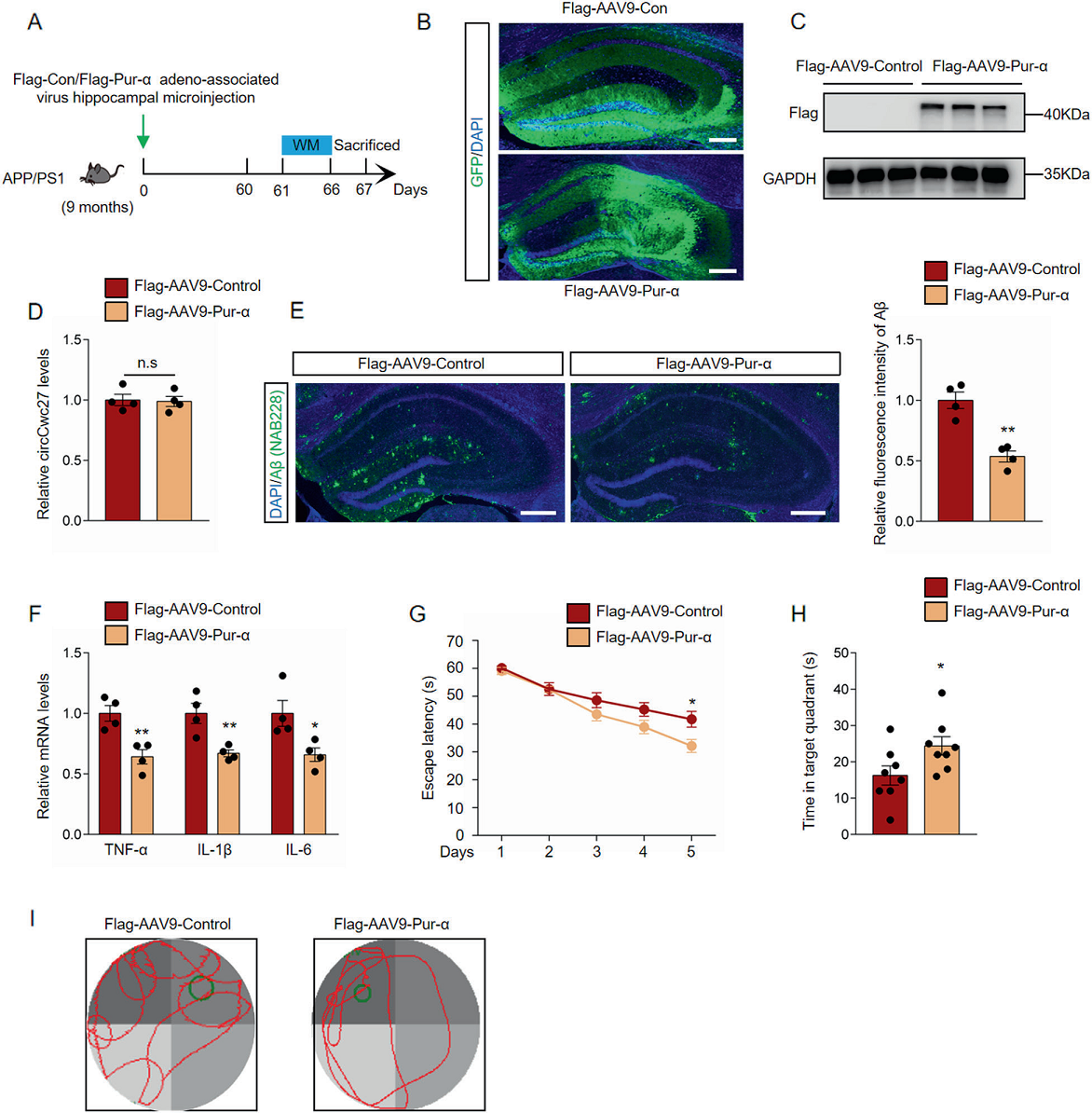
图5. Pur-α减少Aβ沉积,防止AD认知能力下降
7. CircCwc27通过与Pur-α结合调控AD基因的转录
对微注射LV-sh-circCon和LV-sh-circCwc27的APP/PS1小鼠海马区进行了RNA测序,鉴定出339个差异表达基因(图6A)。此外,学习和记忆基因富集显著上调(图6B-D)。在APP/PS1小鼠和AD患者中,大部分circCwc27调控的基因表达都发生了改变(图6E和F)。ChIP-qPCR验证了Pur-α直接结合到由circCwc27控制的AD异常基因的启动子上(图6G)。通过敲除circCwc27,Pur-α与这些基因启动子的结合降低被逆转(图6H)。总之,circCwc27通过与Pur-α结合,减少了Pur-α对AD相关基因启动子的招募。
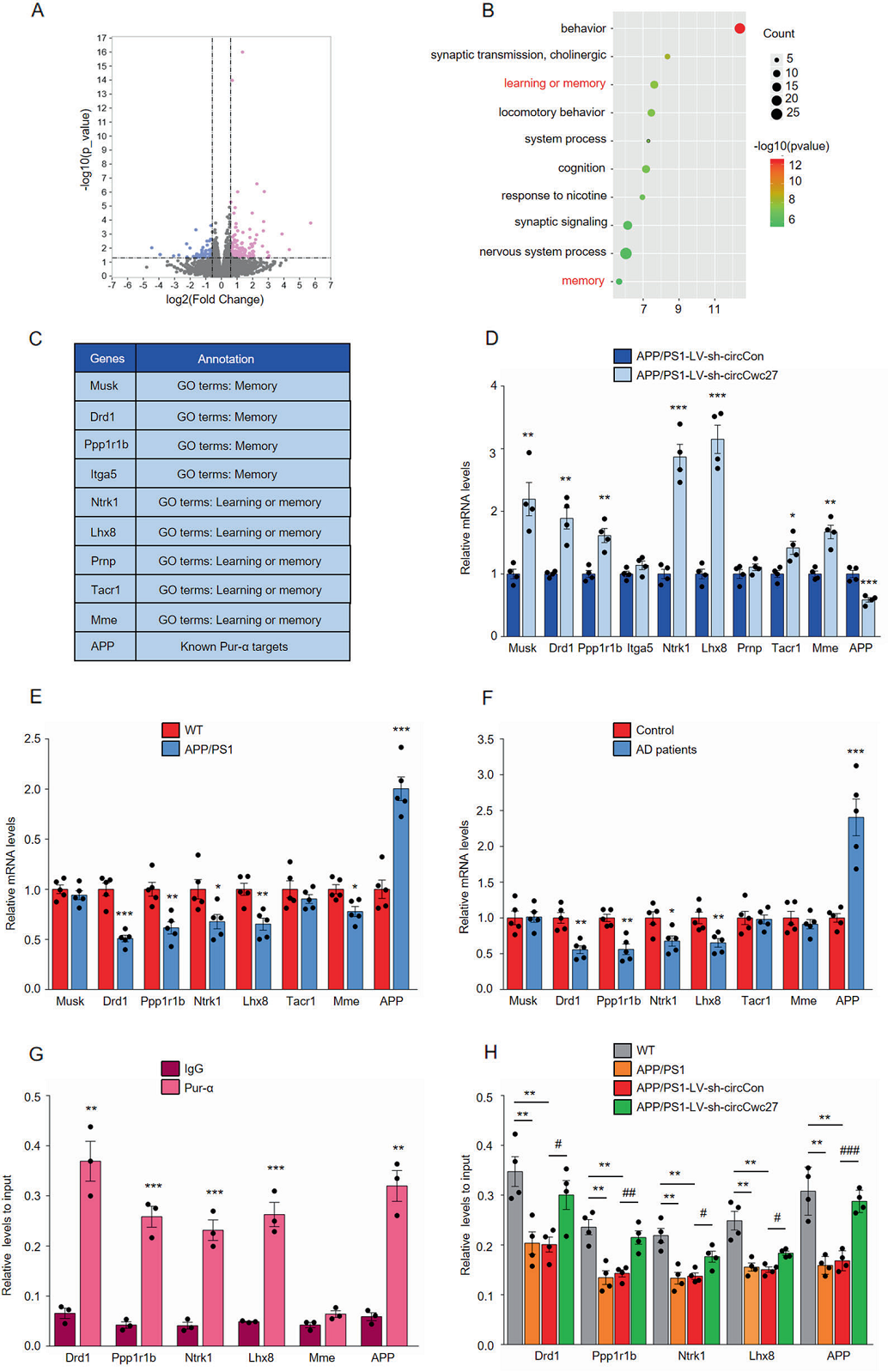
图6. CircCwc27通过与Pur-α结合调控AD基因的转录
结论:
总之,作者的研究结果表明,circRNA-蛋白相互作用的重要功能结果,即circCwc27通过与调控蛋白Pur-α结合,可能在AD发病过程中发挥关键作用,并代表了一个具有临床转化潜力的AD治疗靶点。






