多组学分析揭示了RNA剪接改变及其在肺腺癌中的生物学和临床意义
选择性RNA剪接是最重要的转录后基因调控机制之一,有助于真核生物蛋白质多样性的形成,其失调是肿瘤发病的一个关键机制。近日,有作者系统地研究了肺腺癌(LUAD)的RNA剪接改变,并揭示了它们的生物学和临床意义,为开发LUAD的剪接转换疗法奠定了基础。该研究发表在《Signal Transduction and Targeted Therapy》,IF:38.104。
技术路线:

主要研究结果:
1. LUAD中异常交替剪接事件的识别与统计
为了系统地揭示LUAD中的异常可变剪接事件(AASEs),作者收集了两个数据集。一种是他们的综合队列,包括285个肿瘤样本和145对高质量的癌旁样本。另一个是TCGA-LUAD队列,包括514例肿瘤和59例癌旁样本。主成分分析显示,作者的整合队列的肿瘤和邻接正常样本明显被分为两组(图1a),说明测序数据质量一致。基于这两个队列,确定了28774个选择性剪接事件(ASEs),它们影响8,726个基因,包括用于治疗肺癌的酪氨酸激酶抑制剂的靶点(如EGFR、RET和MET) (图1b)。这一结果支持了选择性剪接模式可能改变LUAD患者的药物反应的可能性。在该研究中,鉴定了7种不同类型的ASEs,包括保留内含子(RI)、相互排斥的外显子(ME)、外显子跳跃(ES)、交替终止子(AT)、交替启动子(AP)、交替受体位点(AA)和交替供体位点(AD)(图1c)。
此外,作者确定了影响2081个基因的3688个AASEs,其中AP和ES事件占绝大多数(图1d)。虽然一些基因同时受到多种类型(最多3种)AASEs的影响,但大多数基因只受一种类型AASEs的调节(图1e)。在LUAD患者中,7种AASEs的比例相似,大多数患者包含超过2,000种AASEs(图1f)。在这3688个AASEs中,有1670个AASEs在TCGA LUAD队列中也显著异常,且其中97%(1620/1670)在两个队列中具有相同的上调或下调方向,这表明作者发现的AASEs是稳健的。
在受AASEs影响的2081个基因中,有1981个基因属于蛋白质编码基因,表明AASEs对编码基因有明显的影响,可能对LUAD产生重大影响。此外,大多数AASEs至少在75%的LUAD样本中被鉴定出来(图1g),这意味着以AASEs为靶点的治疗可能会使许多LUAD患者受益。与相邻正常组织相比,LUAD中NUMB跳变外显子(NUMB PRRL)的包含量显著增加(图1h)。western blotting实验进一步验证了LUAD样品中NUMB PRRL / NUMB PRRS比值显著升高(图1i)。此外,生存分析显示,较高的NUMB PRRL / NUMB PRRS比值表明较差的总生存(OS)(图1j)。这些结果提示,NUMB的异常选择性剪接可能是LUAD恶性的原因之一。未来需要进一步研究该AASE在LUAD中的分子机制和干预价值。
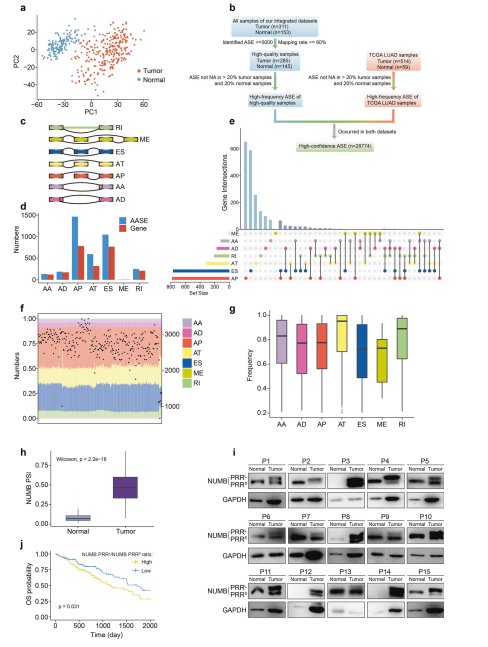
图1 LUAD中异常可变剪接事件(AASEs)及其相关基因概述
2. RNA结合蛋白(RBPs)对LUAD中AASEs的调控模式
ASAS最常见的调节因子之一是RBP, RBP的干扰会导致广泛的ASAS。作者检测到了100个差异表达的RBP,其中68个RBP在LUAD中表达上调,32个RBP表达下调(补充表2),即RBP在癌症中倾向于上调。此外, 88个差异表达的RBP与2505个AASES显著相关,产生了46704对RBP-ASE。约一半(47%)(2228 /46704)对为负相关(RBP水平越高,对应的替代外显子的包含水平越低),另一半为正相关,表明RBPS对AASES的调控在整体上是平衡的。基于RBPS和AASES之间的显著相关性建立了失调网络图。该网络表明,受差异表达RBP影响的AASES相关基因富集于肿瘤发生的关键过程和通路,如“RAS蛋白信号转导”、“NF - Κ B信号通路”、“WNT信号通路”,以及侵袭和转移的关键过程和通路,如“细胞-基质黏附”和“肌动蛋白丝运动”(图2A),提示这些差异表达的RBP通过引起LUAD的剪接改变在肿瘤发展中起关键作用。每个RBP调节的AASES数量在很大程度上是不同的,ALDH18A1、PDIA4和NUSAP1是调节AASES数量最多的RBP(图2B)。
为了测量AASE调节的RBP对LUAD中药物的影响,检测在LUAD细胞系中具有最高调节能力的前20个RBP的表达和药物活性之间的相关性。结果发现肺腺癌中4个上调的RBP与药物敏感性相关。其中,DARS2基因与CMK和PHA-665752药物的IC50值呈正相关,CNOT11基因与小白菊内酯和SELICICLIB药物的IC50值呈正相关,提示这些药物的作用可能被DARS2和CNOT11在LUAD中的高表达所抑制。此外,DKC1基因与GSK319347A (TBK1和IKKΕ的双重抑制剂)的IC50值呈负相关,PDIA4基因与PYRIMETHAMINE(具有抗癌和免疫刺激作用的STAT3抑制剂)的IC50值呈负相关24,这提示DKC1和PDIA4在LUAD中的高表达可能分别增加GSK319347A和PYRIMETHAMINE的敏感性(图2C, D)。
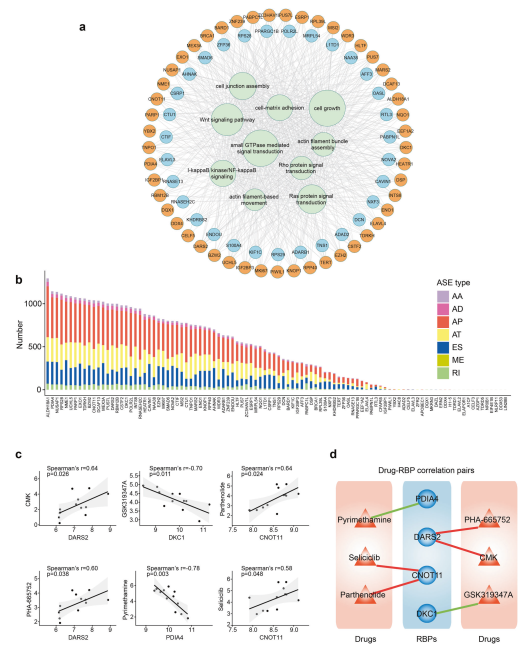
图2 RNA结合蛋白(RBPs)对AASEs的调控
为了直接调控ASEs,大多数RBP必须与剪接位点附近相应的基序结合。基于DeepBind的结果和显著的RBP-ASE对,作者构建了一个更稳健但更小的失调网络。该网络反映了三个RBP介导了LUAD中的438个AASEs,其中AT、AP和ES占最多(图3a)。在这些RBPs中,IGF2BP3介导的AASEs数量最多,受这些AASEs影响的基因在肿瘤侵袭转移过程中富集,如"细胞外基质组织"、"细胞连接组织"和"细胞-基质黏附"。由KHDRBS2调节的AASEs也在类似的生物学过程中富集(图3b)。作者对差异盒外显子两侧的转录序列进行基序扫描分析,并与非差异盒外显子进行比较。这些分析表明,IGF2BP3的保守结合基序在上游和下游剪接位点附近150 bp的上调的盒外显子区域和内含子区域中显著地过度表达。IGF2BP3保守的结合基序也在下调的盒外显子上游150-300 bp的内含子区域中显著过度表达(图3c)。对于KHDRBS2,结合基序显著富集于下调的盒外显子上游约150-300 bp的内含子区域,以及上调的盒外显子下游约150-300 bp的内含子区域(图3d)。作者还观察到YBX2结合基序在上调外显子内以及上调外显子下游约150 bp处显著富集。YBX2的保守结合基序也显著地在下调的盒外显子下游约0-150 bp的内含子区域中过度表达(图3e)。因此,基序搜索分析进一步证实了这三个RBP对AASEs的调控作用。综上所述,这些结果全面揭示了RBPs在肺腺癌中对AASEs的调控作用,提示RBPs干扰了肺腺癌中具有关键功能意义的选择性剪接谱,并为开发新的治疗策略提供了重要信息。
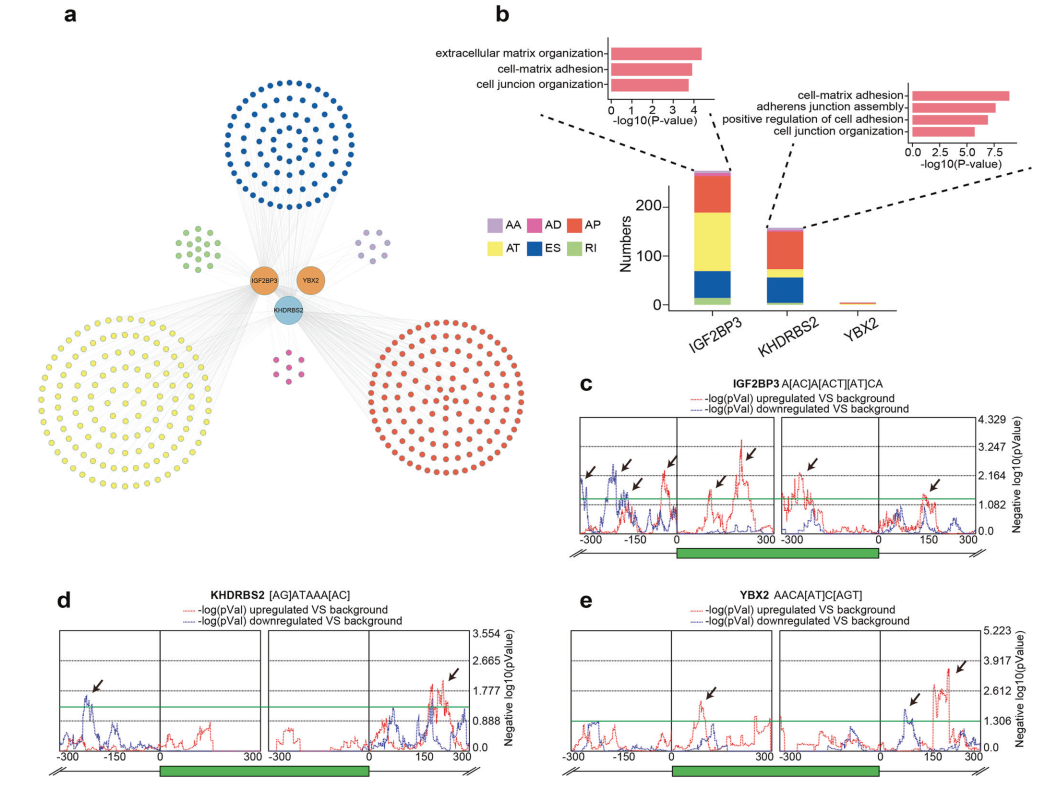
图3 RBP对AASEs的更强调控作用
3. LUAD中AASEs的DNA突变和甲基化调控模式
据报道,DNA突变也可能通过改变调节RNA序列、RBP结构或其他调节分子来影响ASEs。对ASEs具有调控作用的单核苷酸变异(SNV)被称为剪接数量性状位点(sQTL)。该文应用MatrixEQTL算法在LUAD中发现sQTL。一般来说,如果调控SNV在其相应的剪接位点附近100 Kbp范围内,这个SNV被定义为cis-sQTL;否则,它是反式sQTL。因此,只发现了1个顺式sQTL,其中TP53剪接位点的突变会增加外显子10的包含水平(图4a)。还发现36个反式sQTL在肺腺癌中调节广泛的ASEs。在LUAD中,trans-sQTLs不规则地定位于染色体上。trans-sQTL调控chr1上的200多个酶,而调控chr13、chr18和chr21上的不到50个酶(图4b)。这些结果全面揭示了sQTLs的模式,并帮助更好地理解肺腺癌复杂的遗传结构。
除了DNA突变之外,表观基因组学研究还揭示,DNA甲基化可能通过甲基化-CpG结合蛋白2和异染色质蛋白在剪接调控中发挥作用。为了研究AASEs是否部分由DNA甲基化水平紊乱引起,首先在可变剪接外显子边界处确定了1980个CpG位点(图4c)。将CpG位点在肺腺癌和癌旁正常组织之间进行比较后,确定了56个具有差异甲基化水平的CpG位点(图4d)。然后研究了这些差异甲基化的CpG位点对其对应的AASEs的调控作用,发现21个CpG位点与AASEs显著相关。除了一个CpG位点外,所有这些CpG位点都与其对应的AASEs呈负相关,并且这些AASEs都属于AP (alternative promoter,也称为alternative first exons)(图4e)。也就是说,替代第一外显子边界附近的CpG位点甲基化水平越高,替代启动子的使用率越低。为了研究这一规律是否在癌症中普遍存在,接着分析了30种其他类型癌症中CpG位点及其对应的ASEs之间的关系。结果发现,受CpG位点调控的ASEs绝大多数是AP事件(图4f),大部分AP事件的包含水平与相应CpG位点的甲基化水平呈负相关(图4g)。此外,对AP事件具有调控作用的CpG位点大多位于启动子区域,少部分位于基因体区域(图4h)。所有这些结果表明,DNA甲基化对ASEs在肿瘤中的主要作用是抑制替代启动子的使用。
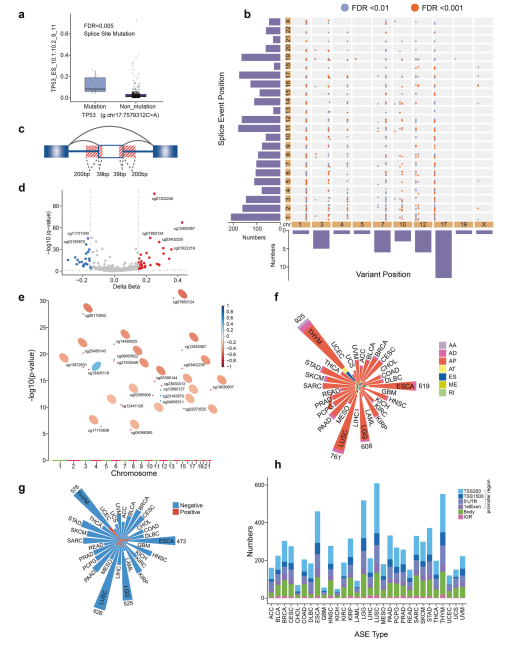
图4 LUAD中DNA突变和甲基化对AASE的调控模式
4. AASEs在LUAD中的功能意义
在本研究中,受AASEs影响的2081个基因中,大多数在转录水平和蛋白质水平都有不同的亚型。这些结果表明,这些基因的异常剪接可能导致相当大的功能变化(图5a)。为了进一步揭示AASEs对肺腺癌的生物学作用,对受AASEs影响的基因进行了基因本体论(GO)富集分析。结果发现,在7种类型的ASEs中,只有受异常AP和ES事件影响的基因在癌症相关的GO术语中显著富集。异常的AP事件主要影响促进肿瘤增殖的通路:“小GTP酶介导的信号转导”,如“Ras信号通路”和“Rho信号通路”。异常ES事件主要影响与肿瘤转移相关的生物学过程,如“纤毛组装”、“细胞连接组织”和“细胞-基质黏附”(图5b)。为了更深入地研究AASEs的功能意义,通过单样本基因集富集分析(ssGSEA)方法测量了14个肿瘤标记物的活化程度,并研究了AASEs与这些标记物活化程度之间的关系。AASEs影响最多的标记为“TGF β信号通路”、“细胞信号传导”、“细胞周期过程”和“Ras信号通路”。然而,“EMT过程”和“前体代谢物和能量的生成”几乎没有受到影响(图5c)。进一步研究与癌症特征相关的AASEs所富集的生物学过程,并利用蜂巢图展示了AASEs(左轴)如何与癌症特征(中轴)相关,以及受这些AASEs影响的基因(右轴)的功能富集。作者发现与许多标志相关的AASEs也在“细胞-基质连接组装”和“细胞-基质黏附”中显著富集(图5d)。这些结果进一步表明,肺腺癌中的AASEs在与肿瘤增殖和转移相关的生物学过程中具有实质性的功能意义。
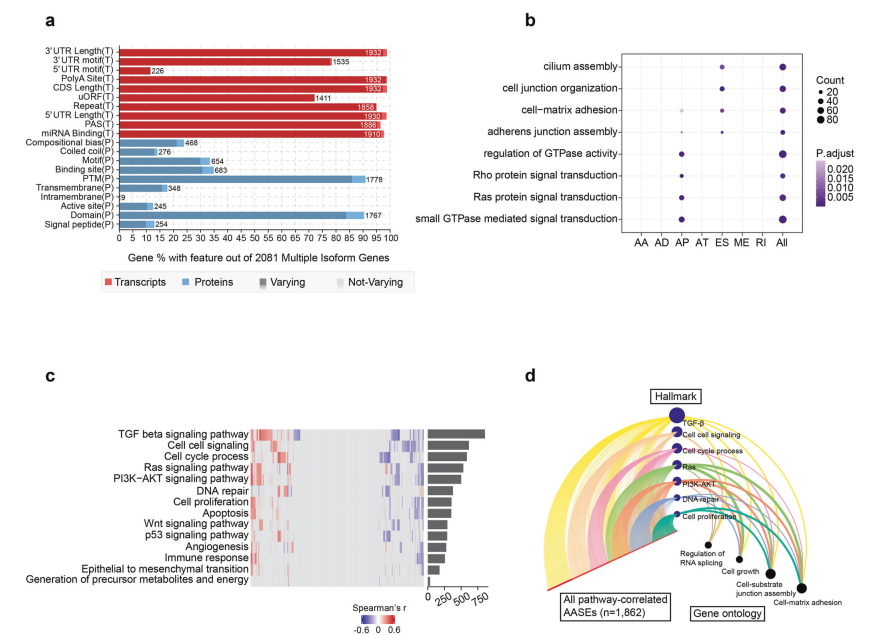
图5 AASEs的功能含义
5. 基于AASEs的LUAD亚型分类具有明显的生物学特征
基于RNA剪接模式的分子分型已被证明可对其他肿瘤类型中具有不同预后或治疗效果的患者进行分层,因此可用于改善LUAD的患者分层。基于3688个AASEs,通过共识聚类分析将514个TCGA LUAD样本分为3个亚型:G1 (n = 176, 34.2%), G2 (n = 130, 25.3%)和G3 (n = 208, 40.5%)。与G1和G2相比,G3的AASEs总数(AASEs频率)最高(图6a)。7种AASEs在3种亚型中的比例相似(图6b),此外,AASEs频率高表明肺腺癌中免疫细胞浸润程度高,预后好(图6c, d)。LUAD的三个AASE亚型具有特定的AASE特征和模式。例如,TRIM7、MLK4、ADNP和TRAP1等肿瘤相关基因的AP事件在G1中包含量较高。肿瘤相关基因如DDX17、PLCB2、SEMA6C的AASEs在G2中包含量较高。而肿瘤相关基因如ARMC3、TPM4和TNFRSF12A的AASEs在G3中包含量较高(图6e)。
进一步研究了这三种亚型的生物学特性,发现G1是一个快速增殖的亚型,富集的通路有“细胞周期”、“DNA修复”、“DNA复制”等(图6f)。G1也是一个高代谢亚型,通路富集在“氧化磷酸化”、“葡萄糖代谢”、“蛋白质代谢”、“核苷酸代谢”等(图6f),提示G1可能从传统的靶向高增殖细胞的化疗中获益更多。G3具有特定的代谢模式,其特征是偏好脂肪酸代谢(图6f)。此外,G3是一个具有高细胞黏附分子、高PD1信号(图6f)和低干性指数、低端粒酶活性(图6g)的亚型。此外,在CpG岛启动子区域收集了719个用于鉴定LUAD甲基化亚型的最可变的DNA甲基化特异性探针,根据这些探针,G2为高甲基化,而G3为低甲基化(图6h, i)。
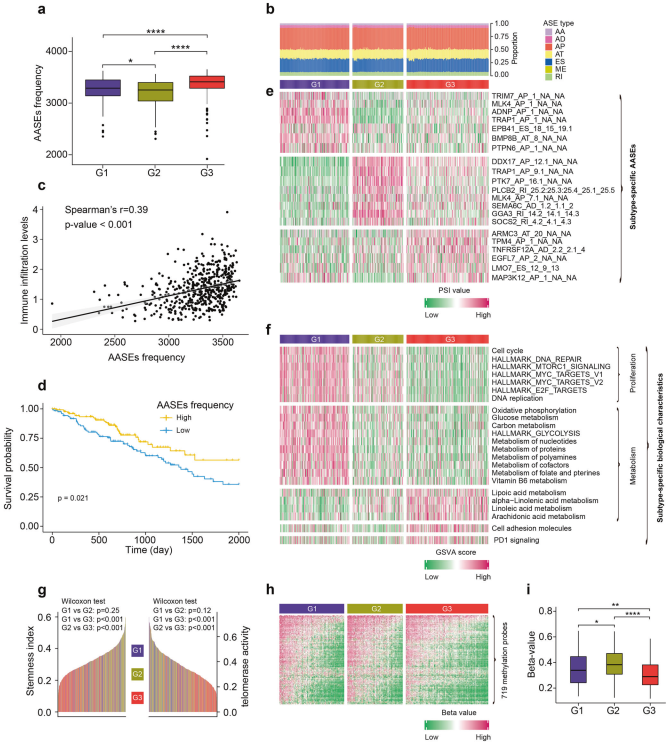
图6三种LUAD亚型的AASEs及其生物学特性
6. AASE亚型LUAD具有明显的免疫特性
由于AASEs频率与免疫细胞浸润水平呈正相关,进一步深入表征了AASEs亚型的免疫特征。首先,评估并比较了三种亚型中22种免疫细胞的浸润水平。结果显示,11种细胞类型显示出显著差异,包括7种固有免疫细胞和4种适应性免疫细胞(图7a)。大多数细胞类型在G3亚型中表现出最高的浸润水平,例如CD4 +记忆静息T细胞和髓样树突状细胞(图7b)。所有免疫细胞的浸润水平在G3中也是最高的(图7c)。
通过ssGSEA分析量化了每个肿瘤样本中17条免疫通路的激活程度,发现有16条通路在3种亚型中表现出显著差异(图7d)。许多对抑制肿瘤生长至关重要的免疫通路在G3中持续上调,如“抗原处理和呈递”、“NK细胞细胞毒性”和“TCR信号通路”(图7e)。与免疫细胞的浸润水平一致,肿瘤微环境中所有免疫通路的激活水平在G3中最高(图7f)。
为了使免疫微环境的评估更加全面,进一步检测了每个肿瘤中的78种免疫调节剂,发现19种免疫调节剂的表达水平在3种亚型之间存在显著差异(图7g)。大多数差异表达的免疫调节剂在G3亚型中最高,包括重要的共刺激分子(CD28和CD80)和抗原呈递基因(HLA-DPA1和HLA-DRA)(图7h)。G3中78种免疫调节剂的总表达量也是最高的(图7i)。HE染色显示,G3中浸润的免疫细胞比例最高,提示G3确实是“热”肿瘤(图7j, k)。IHC染色和组织评分(H-score)分析发现,CD8和PD-L1是免疫治疗疗效的关键免疫标志物和预测因子,在G3中最高(图7j, k)。
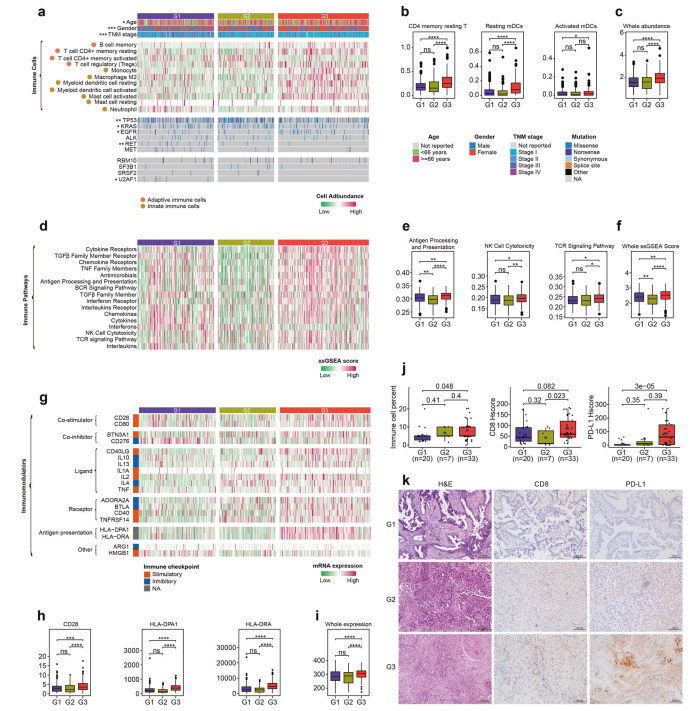
图7 LUAD AASE亚型的免疫特性
7. LUAD AASE亚型的临床意义
免疫原性微环境意味着良好的预后和对免疫检查点阻断剂的良好应答率。由于G3亚型的免疫浸润始终较高,其G3级预后最好,可作为独立预后因素(图8a)。此外,这三种LUAD亚型对靶向不同通路的不同药物敏感,但它们都对HSP抑制剂敏感,如AT-13387和诺米林(图8b)。通过细胞增殖实验,证实两种药物均能显著抑制肺腺癌细胞株A549、NCI-H2347、NCI-H441的增殖(图8c),且这两种药物对细胞生长的影响通过集落形成实验进一步证实(图8d)。这些结果一致表明,AASE亚型不仅可以反映肿瘤实质的转录组学特征,而且可以反映肿瘤免疫微环境。

图8 LUAD AASE亚型的临床意义
结论:
总之,改研究系统地研究了AASEs在LUAD中的应用,并从多个角度揭示了AASEs及其调控因子的生物学相关性。阐明了剪接调控异常对肿瘤免疫微环境的影响,为设计LUAD的剪接切换治疗方法奠定了基础,有助于进一步认识LUAD的分子特征,促进LUAD的基础研究和精准医疗。






