姜黄烯醇通过lncRNA H19/miR-19b-3p/FTH1轴触发肺癌细胞铁死亡
肺癌是最常见的癌症类型之一,是全球癌症相关死亡的主要原因。尽管现有药物在晚期肺癌的治疗中取得了许多进展,但由于其相关的严重不良反应、剂量限制性毒性、耐药和较差的选择性,其治疗效果有限。因此,迫切需要开发新的治疗策略或新的有效药物来治疗肺癌。姜黄烯醇是温瘀金的有效成分,已被报道在几种肿瘤中发挥其抗肿瘤潜力。然而,姜黄烯醇在肺癌中的作用和分子机制尚不清楚。该研究发表于《Bioactive Materials》,IF:12.91。
技术路线:

主要研究结果:
1. 姜黄素诱导肺癌细胞死亡,抑制肺癌细胞增殖
为了评估姜黄烯醇对肺癌的抗癌潜力,研究者在人肺成纤维细胞(CCD19),人正常肺上皮细胞(BEAS-2B)和肺癌细胞(H1299和H460)中使用不同浓度的姜黄烯醇处理24小时。研究者发现,姜黄烯醇在肺癌细胞中以浓度依赖性方式抑制细胞存活,但在正常肺细胞中毒性相对较小(图1A和B)。表明莪术醇对肺癌细胞有选择性的细胞毒性。克隆形成实验检测姜黄烯醇对细胞增殖的影响;如图1C和D所示,与对照组相比,莪术醇以剂量依赖性方式显著抑制肺癌细胞的集落形成。采用Annexin V-FITC/PI双染流式细胞术检测姜黄烯醇对H1299和H460细胞死亡的影响。与对照组相比,姜黄烯醇处理后的肺癌细胞中死亡细胞的百分比较高。然而,总体的细胞凋亡较低(图1E和F),这可能是由于凋亡不是姜黄烯醇诱导的细胞死亡的主要模式。综上所述,这些数据表明姜黄烯醇降低肺癌细胞的活力并诱导细胞死亡。
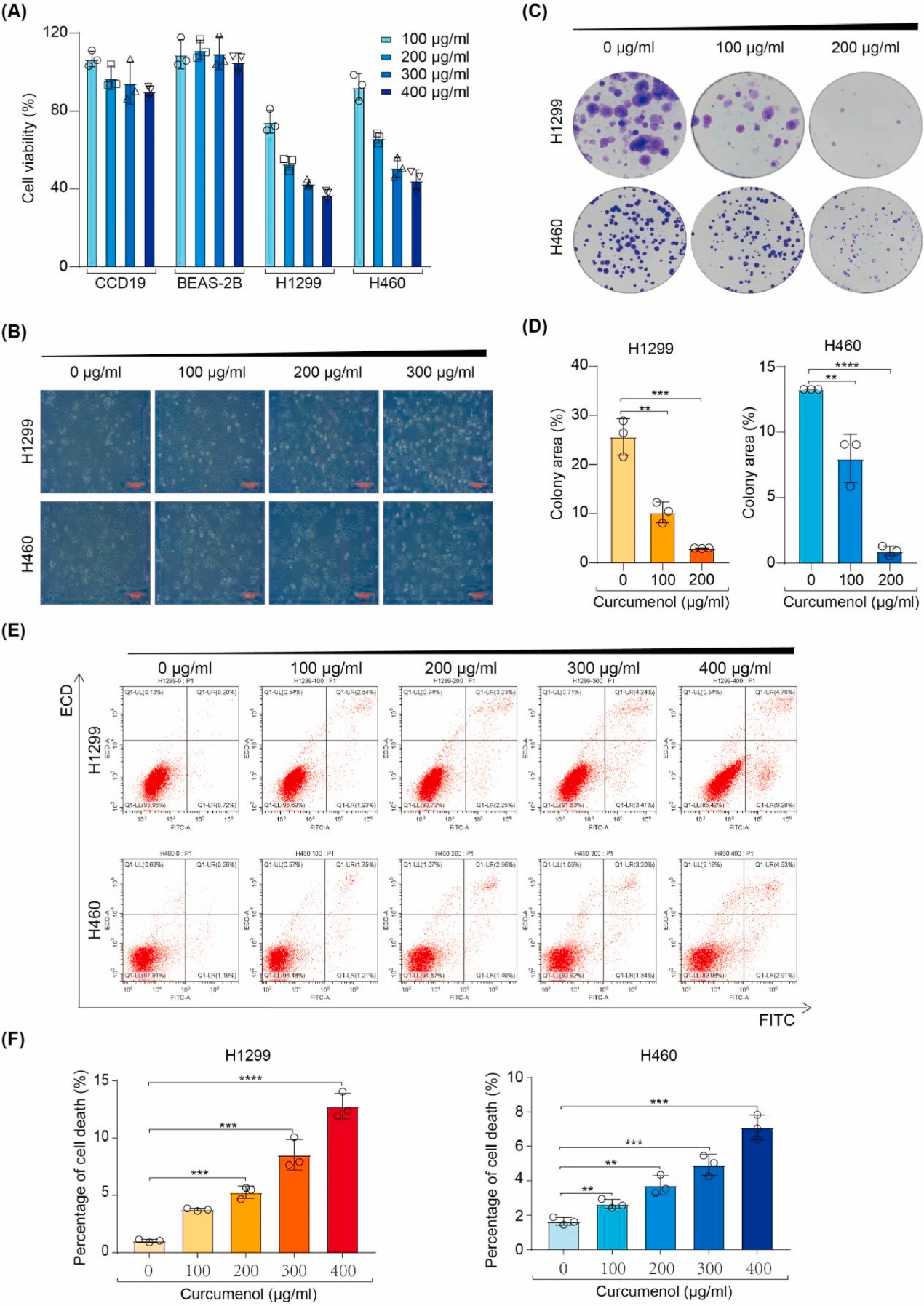
图1 姜黄烯醇处理H1299和H460细胞后检测细胞活力
2. 铁死亡是姜黄素诱导肺癌细胞死亡的主要方式
采用程序性坏死抑制剂Nec-1、自噬抑制剂氯喹、泛caspase抑制剂Z-VAD以及铁死亡抑制剂去铁胺(DFO)、Ferrostatin (Fer-1)和liprostatin -1 (Lip-1)评估姜黄烯醇诱导的主要细胞死亡程序。结果表明,Nec-1, Z-VAD和CQ不能明显抑制姜黄烯醇在H1299和H460细胞中引起的细胞死亡(图2A-C)。然而,铁死亡抑制剂DFO、Fer-1和Lip-1显著挽救了姜黄烯醇诱导的细胞死亡(图2D-F)。这些结果证明,铁死亡可能是姜黄烯醇诱导的主要细胞死亡程序。
为进一步确定姜黄烯醇是否通过铁死亡诱导细胞死亡,western blot检测铁死亡相关蛋白。研究者的数据显示姜黄烯醇处理显著增加了肺癌细胞中血红素加氧酶1 (HO-1)和转铁蛋白的表达水平,但降低了谷胱甘肽过氧化物酶4 (GPX4)、溶质载体家族40成员1 (SLC40A1)、溶质载体家族7成员11 (SLC7A11)、铁蛋白重链1 (FTH1)、核因子e2相关因子2 (NRF2)和谷氨酰胺酶的表达水平(图3A)。此外,铁螯合剂DFO可以挽救姜黄烯醇诱导的铁死亡蛋白的表达(图3B)。
在随后的实验中,研究者进行了RNA测序,以研究姜黄烯醇处理后的差异转录组反应。采用数字基因表达谱技术筛选并鉴定差异表达基因。进一步对差异表达基因进行基因本体论(GO)分类和京都基因与基因组百科全书(KEGG)通路分析。因此,在H1299细胞中确定了1,665个上调基因和1,232个下调基因。在H460细胞中确定了1,484个上调基因和759个下调基因。GO富集分析显示,氧化还原过程和氧化还原酶活性得到富集。同时,KEGG分析发现铁死亡通路被富集(图3C和D)。这些结果表明姜黄烯醇处理后肺癌细胞发生了铁死亡。
众所周知,活性氧(ROS)蓄积、还原型谷胱甘肽(GSH)耗竭、脂质过氧化和氧化还原活性铁过载是铁死亡过程中的关键事件。检测细胞内活性氧(ROS)、还原型谷胱甘肽(GSH)、氧化应激标志物丙二醛(MDA)和细胞内螯合铁水平。正如预期的那样,姜黄烯醇处理后观察到ROS水平增加(图4A)和GSH水平降低(图4B和C)。此外,铁螯合剂DFO可以消除姜黄烯醇引起的GSH耗竭(图4D和E)。同时,姜黄烯醇处理上调了肺癌细胞中的MDA水平(图4F)。此外,铁敏感荧光团Phen Green SK被用来监测细胞内螯合铁,铁结合后被淬灭。正如预期的那样,与对照组相比,姜黄烯醇处理降低了Phen Green sk阳性细胞的比例,而铁螯合剂DFO可以消除这一现象(图4G),表明铁死亡被触发。因此,这些结果表明铁死亡是姜黄烯醇触发肺癌细胞死亡的主要机制。
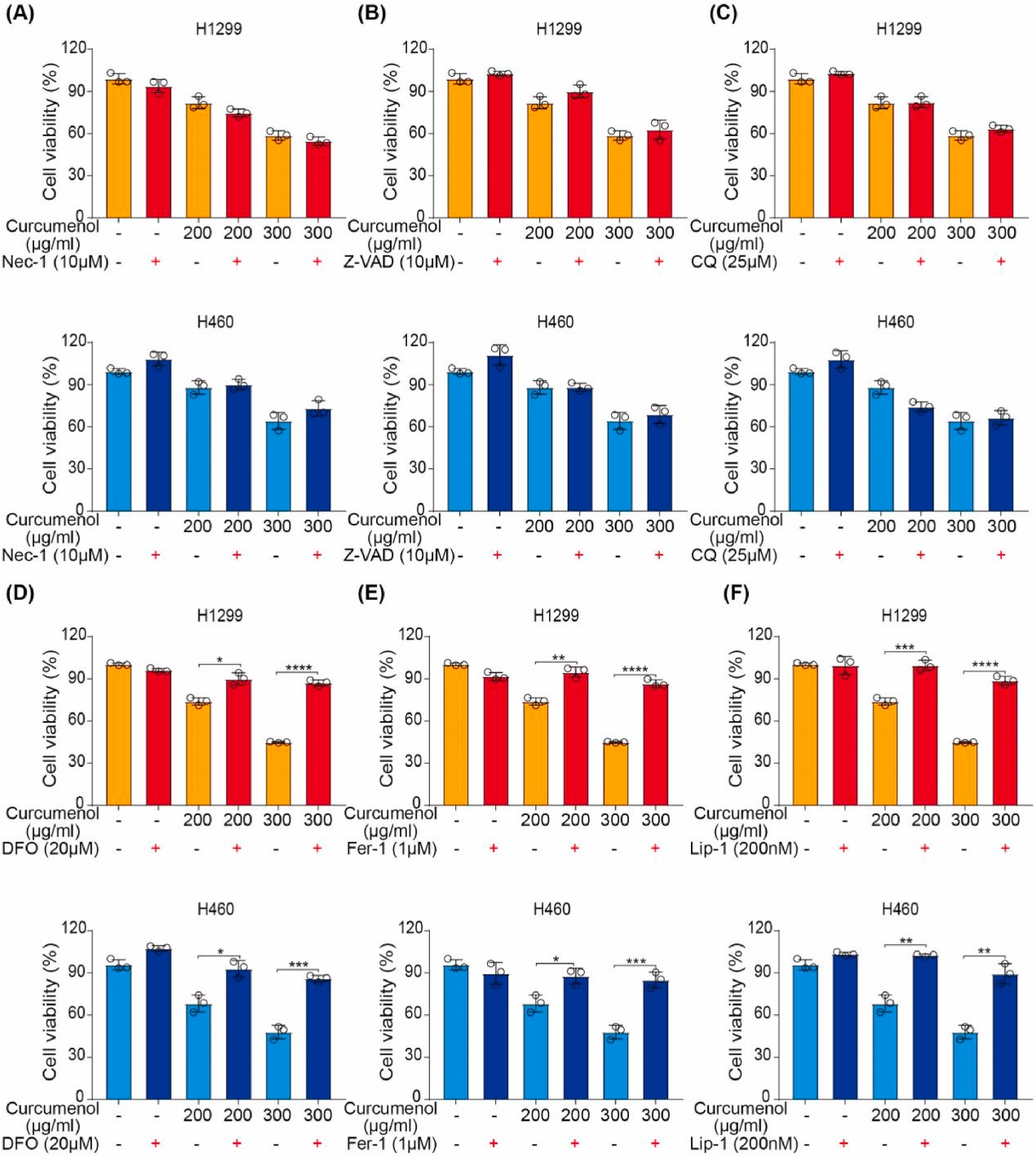
图2 姜黄烯醇单独或联合不同细胞死亡抑制剂对肺癌细胞活力的影响
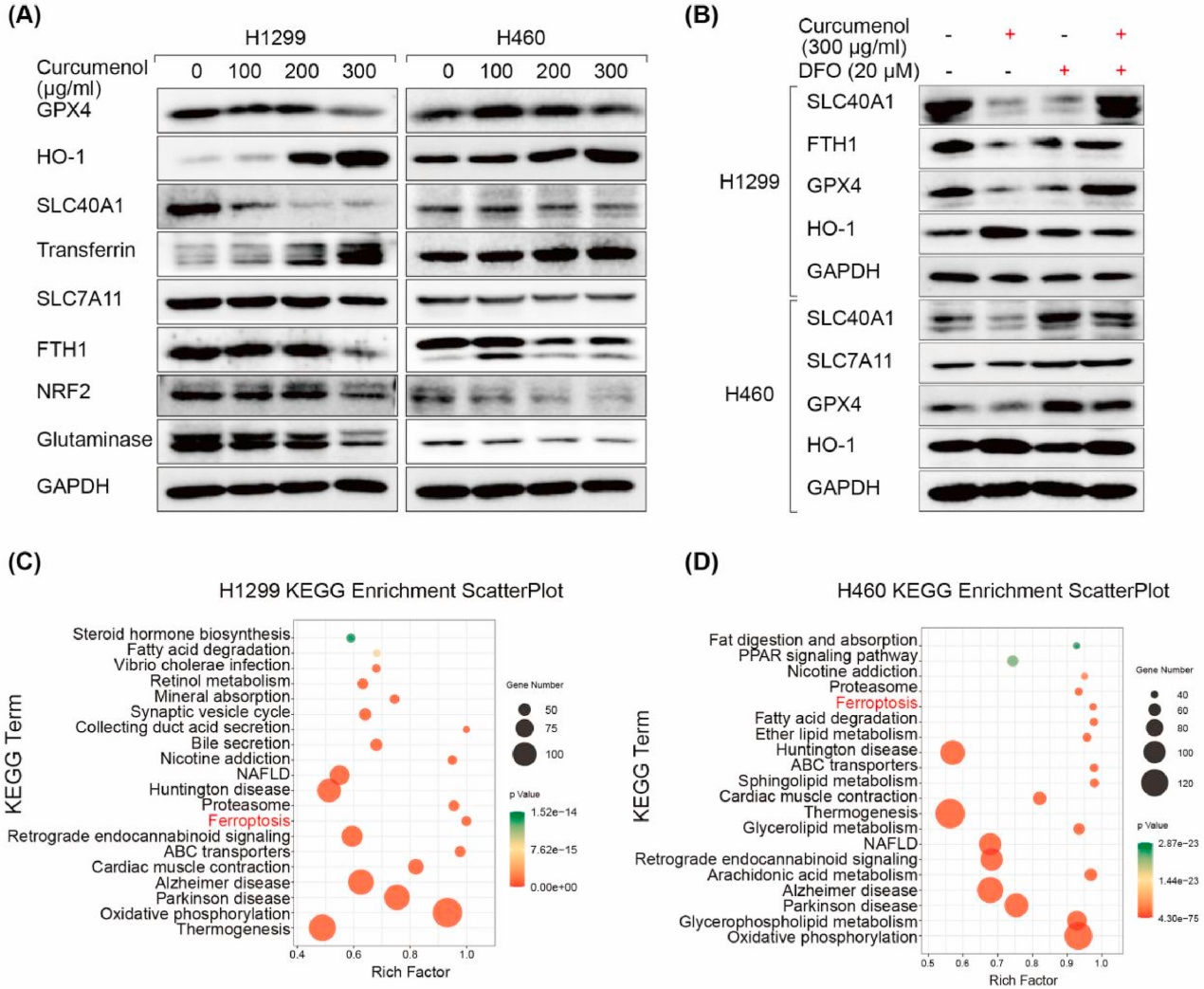
图3 姜黄烯醇诱导肺癌细胞发生铁死亡
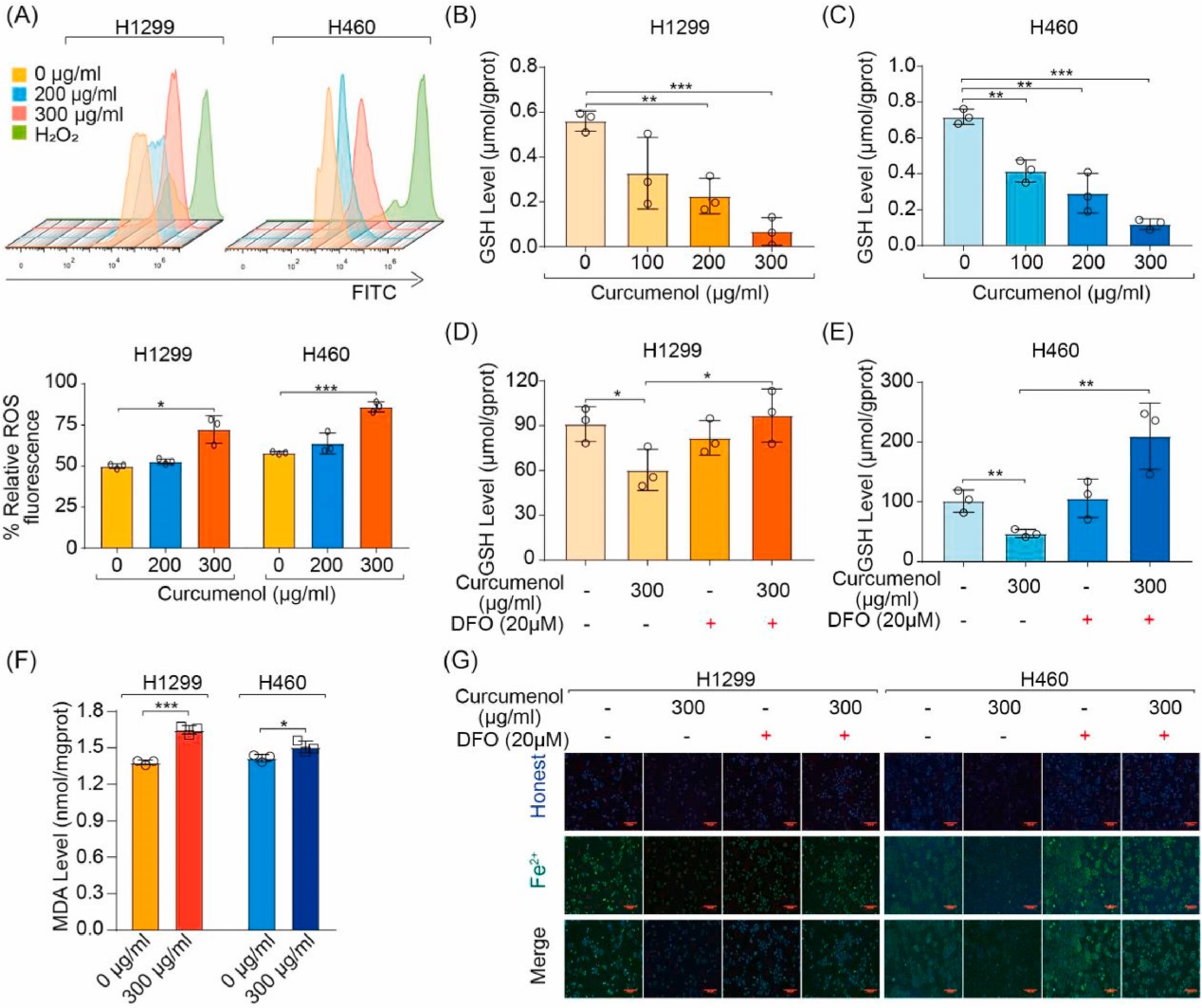
图4 铁死亡促进了姜黄烯醇诱导的肺癌细胞死亡
3. 姜黄烯醇在肺癌异种移植模型中引发铁死亡
建立肺癌皮下移植瘤模型,评价莪术醇的体内抗肿瘤作用。皮下移植瘤体积达80 ~ 100 mm3后,将裸鼠随机分为溶剂组、莪术醇组(200 mg/kg/d)、去铁胺组(100 mg/kg/d)和药物联合组。研究者的数据显示,姜黄烯醇显著抑制了异种移植瘤的生长,并且姜黄烯醇的抗肿瘤作用可以被铁死亡抑制剂DFO消除(图5A和B)。然而,对照组和姜黄烯醇处理组的体重没有统计学差异(图5C),表明姜黄烯醇没有明显的毒性。在进一步的研究中,研究者通过免疫组织化学(IHC)研究了姜黄烯醇对铁死亡的影响。姜黄烯醇处理后,GPX4, FTH1和SLC7A11的水平降低,HO-1和转铁蛋白的表达增加,表明姜黄烯醇触发铁死亡。此外,与铁螯合剂DFO共处理后,姜黄烯醇诱导的细胞死亡几乎被消除(图5D)。综上所述,研究者的结果表明姜黄烯醇在体内诱导肺癌细胞发生铁死亡。
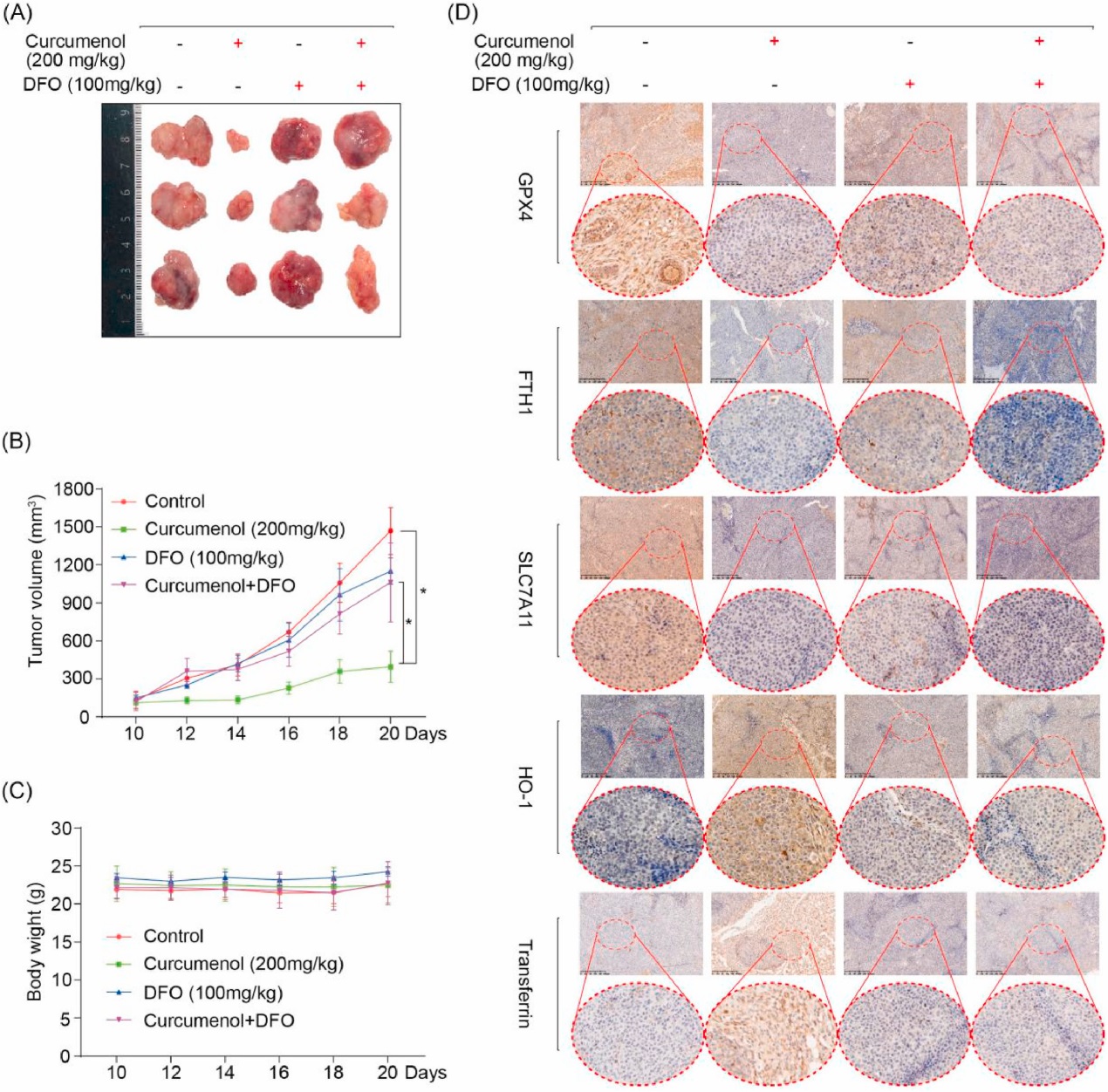
图5 姜黄烯醇在肺癌异种移植模型中触发铁死亡
4. lncRNA H19表达与姜黄烯醇诱导铁死亡的相关性
为了确定lncRNA在姜黄烯醇抗癌作用中的作用,研究者进行了RNA测序。研究者发现,与未处理的细胞相比,姜黄烯醇处理的肺癌细胞中lncRNA H19显著下调(图6A)。类似的结果通过qRT-PCR进一步证实(图6B)。为了研究lncRNA H19在姜黄烯醇诱导的铁死亡中的生物学功能,研究者在H1299和H460细胞中分别通过转染过表达质粒和shRNA来过表达或敲低lncRNA H19。lncRNA H19过表达显著增加了铁死亡负调控因子(NRF2、GPX4、FTH1和SLC7A11)的表达水平(图6C-E)。相比之下,lncRNA H19敲低显著降低了铁死亡负调控因子(NRF2、GPX4、FTH1和SLC7A11)的表达水平(图6F-H)。因此,研究者的结果表明lncRNA H19参与了姜黄烯醇诱导的铁死亡。
为了研究lncRNA H19对姜黄烯醇诱导的铁死亡的影响,研究者在H1299和H460细胞中转染过表达质粒或shRNA。克隆形成实验和CCK-8结果显示,lncRNA H19过表达显著消除了姜黄烯醇对H1299和H460细胞的抑制作用(图7A-F)。相反,lncRNA H19敲低显著抑制了H1299和H460细胞的克隆形成,增强了姜黄烯醇对这些细胞的抗癌作用(图7G-L)。综上所述,这些数据表明lncRNA H19是姜黄烯醇诱导铁死亡的关键决定因素。
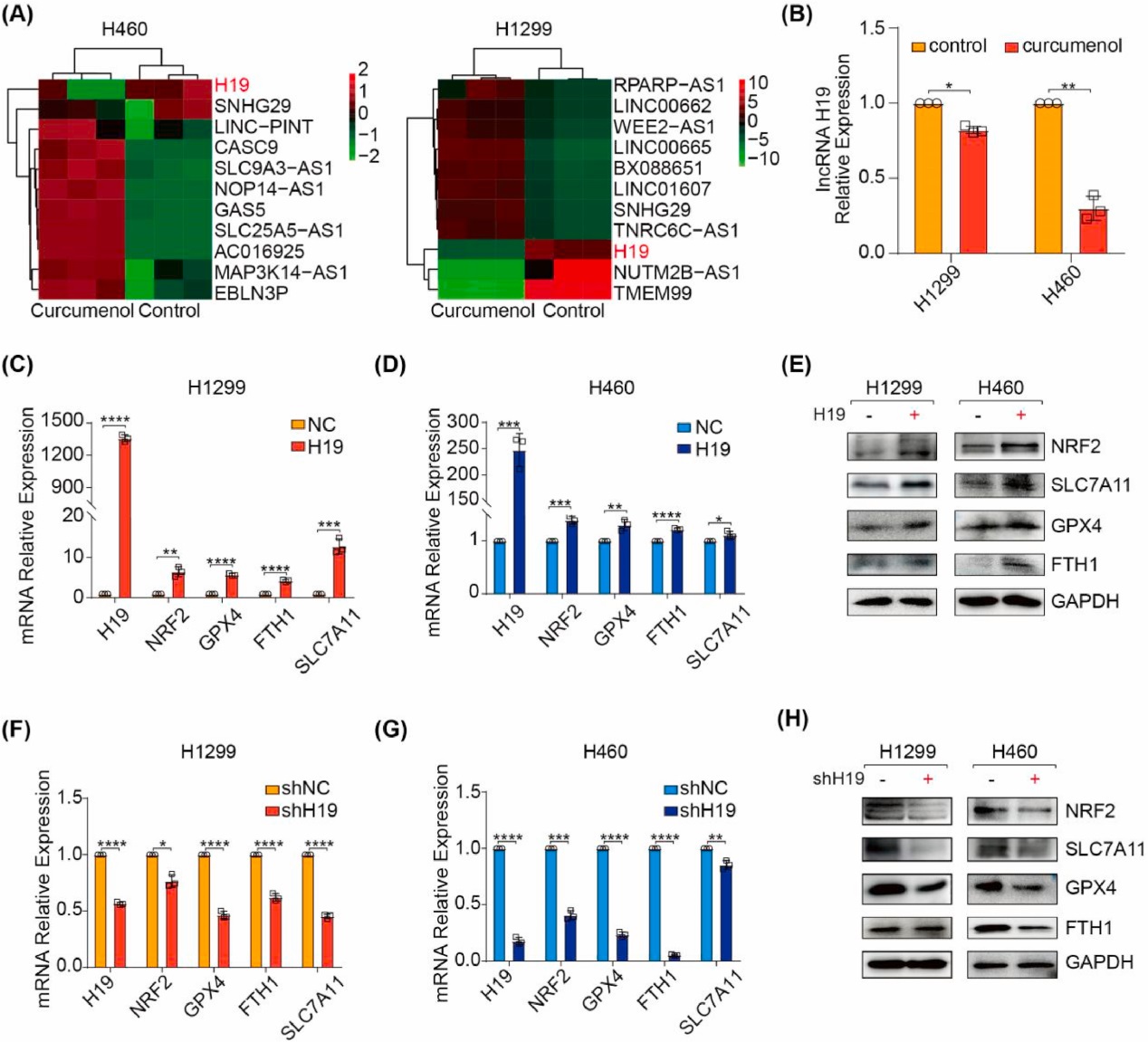
图6 lncRNA H19表达与姜黄烯醇诱导铁死亡的相关性
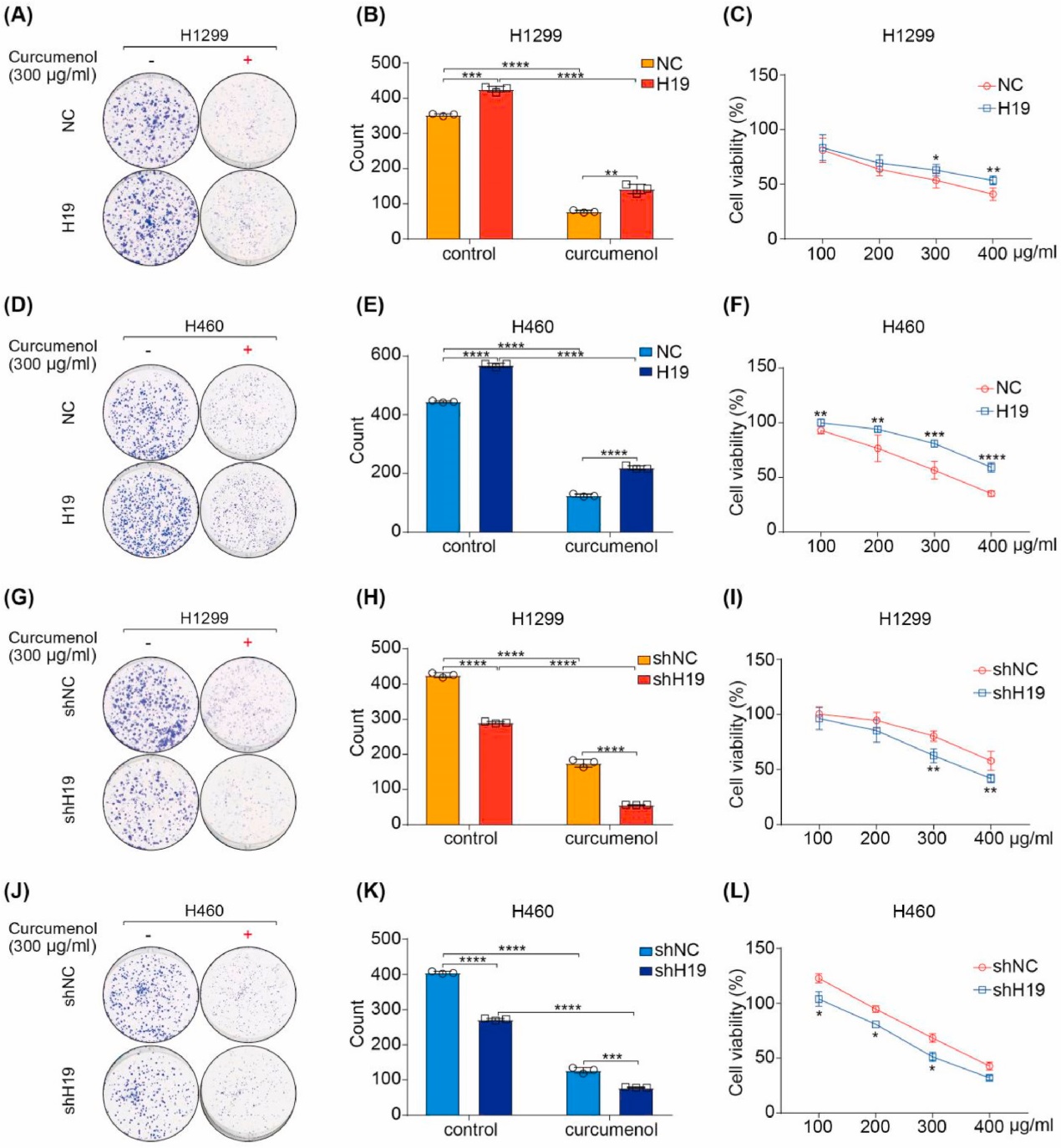
图7 lncRNA H19对姜黄烯醇诱导铁死亡的影响
5. 姜黄素通过lncRNA H19/miR-19b-3p/FTH1轴诱导肺癌细胞铁死亡
越来越多的证据表明,lncRNA可以作为ceRNA或与RNA结合蛋白相互作用来调控靶基因的表达。因此,研究者基于生物信息学数据库(Starbase)中lncRNA- miRNA和miRNA-mRNA的相互作用构建了ceRNA网络,发现lncRNA H19可能靶向miR-181a-5p、miR-19b-3p、miR-200b和miR-675。在4个候选miRNA中,与对照组相比,经莪术醇处理后,H1299和H460细胞中miRNA-19b-3p的表达水平显著升高(图8A-C)。有趣的是,在泛癌分析中,miR-19b-3p与FTH1在肺鳞状细胞癌(图8D)和腺癌中呈负相关。由于研究者已经证明lncRNA H19可以调控H1299和H460细胞中FTH1的表达(图6C-H),研究者有理由推测lncRNA H19通过靶向miR-19b-3p调控FTH1水平。结果显示,lncRNA H19过表达抑制H1299和H460细胞中miR-19b-3p水平(图8E)。相比之下,lncRNA H19敲低增强了H1299和H460细胞中miR-19b-3p的表达(图8F)。同时,研究者发现miR-19b-3p mimics降低了FTH1的表达,但增加了姜黄烯醇在H1299和H460细胞中的抗癌活性(图8G-L)。相反,miR-19b-3p抑制剂增加了FTH1的表达,但减弱了姜黄烯醇在H1299和H460细胞中的抗癌活性(图8M-R)。这些数据表明姜黄烯醇通过lncRNA H19/miR-19b-3p/FTH1轴触发肺癌细胞的铁死亡。
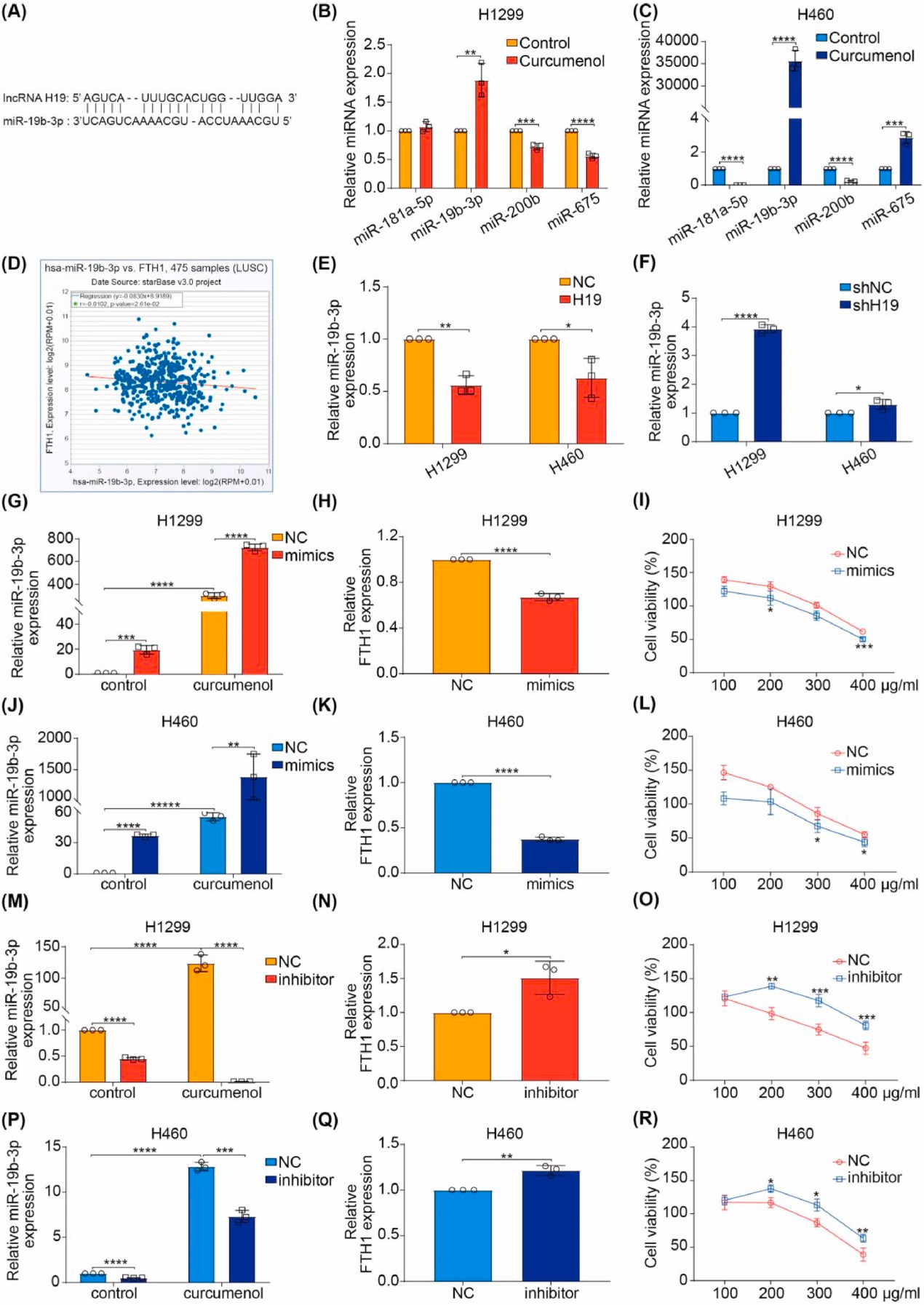
图8 姜黄烯醇通过lncRNA H19/miR-19b-3p/FTH1轴诱导肺癌细胞铁死亡
结论:
该研究表明,天然产物姜黄烯醇通过触发铁死亡发挥其抗肿瘤作用,并且lncRNA H19/miR-19b-3p/FTH1轴在姜黄烯醇诱导的铁死亡细胞中发挥重要作用。本研究有望为肺癌患者提供潜在的治疗药物。
参考文献:
Ruonan Zhang, Ting Pan, Yu Xiang, et al. Curcumenol triggered ferroptosis in lung cancer cells via lncRNA H19/miR-19b-3p/FTH1 axis. Bioactive Materials. Volume 13, 2022, Pages 23-36, ISSN 2452-199X, https://doi.org/10.1016/j.bioactmat.2021.11.013.






