ALKBH5可能通过降低PHF20 mRNA甲基化抑制结直肠癌进展
m6A是最广泛的mRNA修饰,被甲基转移酶和去甲基酶动态地、可逆地调控。ALKBH5是一种主要的去甲基化酶,在癌症的进展中起着至关重要的作用。然而,ALKBH5在结直肠癌(CRC)中的作用和机制尚不清楚。我们发现,在CRC中,ALKBH5的下调与CRC患者预后不良密切相关。在功能上,敲低ALKBH5可增强LOVO和RKO细胞的增殖、迁移和侵袭能力,而过表达ALKBH5可抑制这些细胞的功能。结果还表明,敲除ALKBH5可促进LOVO在体内的皮下肿瘤发生,而过表达ALKBH5可抑制这种能力。在机制上,MeRIP-seq和RNA-seq的联合分析结果表明,PHF20 mRNA是一个受ALKBH5介导的m6A修饰调控的关键分子。进一步的实验表明,ALKBH5可能通过去除PHF20 mRNA 3'UTR的m6A修饰来抑制PHF20 mRNA的稳定性。总之,ALKBH5通过降低PHF20 mRNA甲基化抑制CRC进展。ALKBH5介导的PHF20 mRNA的m6A修饰有望成为CRC的干预和治疗策略。本文于2022年6月发布于“Clinical and Translational Medicine”(IF=8.554)上。
技术路线

结果:
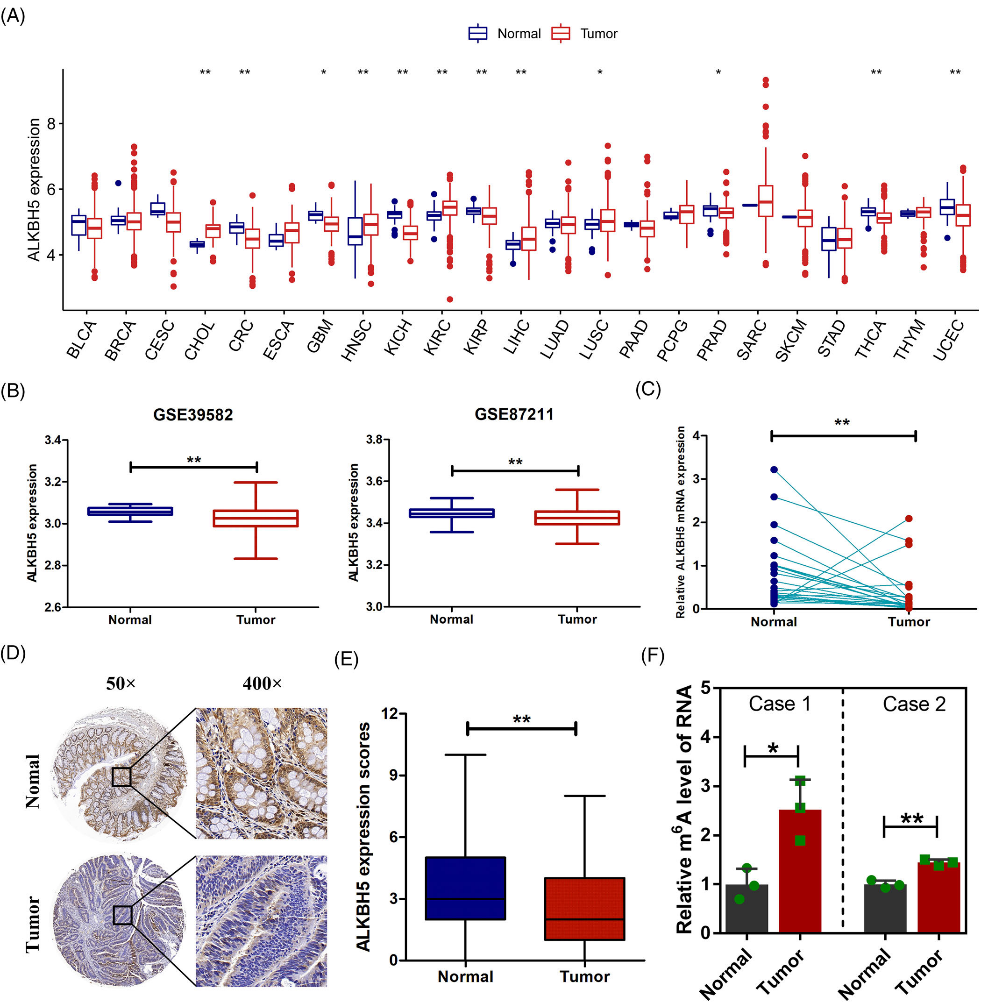
1)ALKBH5在CRC中表达下调
为了评估ALKBH5在癌症中的表达,我们初步检测了TCGA数据集中23个实体癌症中ALKBH5的mRNA表达。在12例实体癌中,与相邻正常组织相比,ALKBH5明显失调(图1A)。与相邻正常组织相比,ALKBH5在7种实体癌(CRC、GBM、KICH、KIRP、PRAD、THCA和UCEC)中显著下调,在5种实体癌(CHOL、HNSC、KIRC、LIHC和LUSC)中上调。我们发现,与相邻正常组织相比,TCGA-CRC队列中肿瘤组织中的ALKBH5明显减少。我们还从GEO数据集中下载了CRC的RNA测序数据。结果证实了CRC组织中ALKBH5 mRNA的减少(图1 B)。RT-qPCR结果显示,CRC组织中ALKBH5 mRNA表达明显低于相邻正常组织(图1C)。我们还评估了ALKBH5蛋白在CRC中的表达。免疫组化检测结果显示,CRC组织中ALKBH5蛋白表达明显降低(图1D,E)。此外,mRNA的m6A 定量分析表明,CRC组织中mRNAs的m6A修饰水平较高(图1F)。
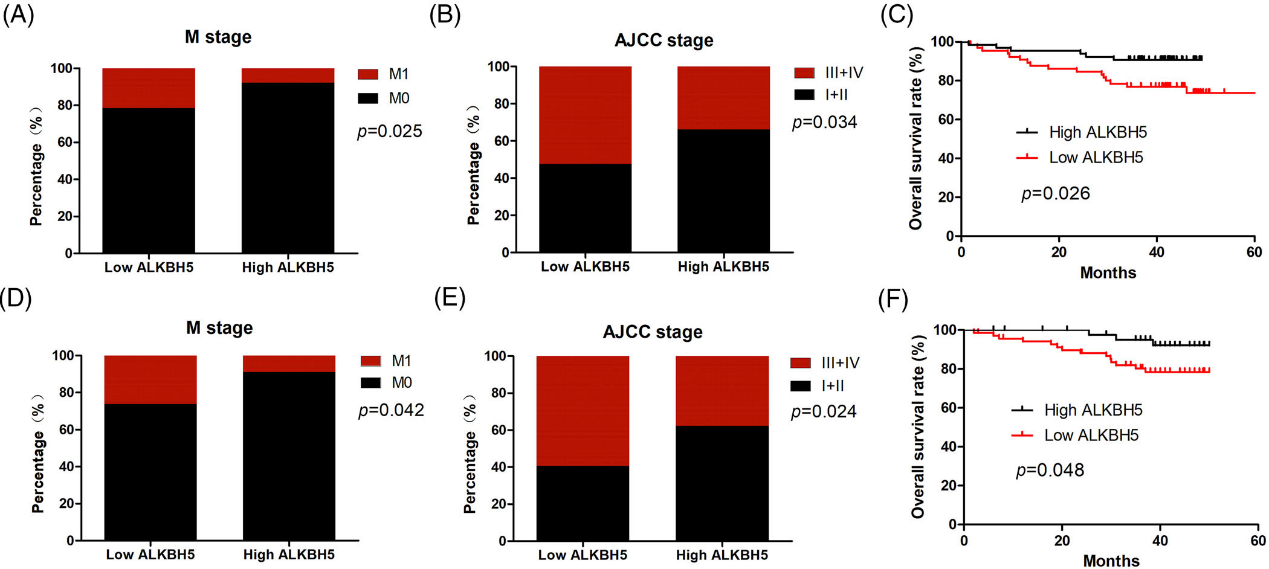
2)ALKBH5缺失预示CRC患者预后较差
为了探讨ALKBH5的临床价值,我们从mRNA和蛋白水平分析了ALKBH5与CRC患者临床病理特征的相关性。结果表明,在mRNA水平上,下调ALKBH5与远处转移和临床晚期显著相关(图2A, B)。一致地,在蛋白水平上,下调的ALKBH5与远处转移和临床晚期显著相关(图2D, E)。Kaplan-Meier分析表明,缺失ALKHB5的CRC患者在mRNA(图2C)和蛋白(图2F)水平上的总生存期都较短。
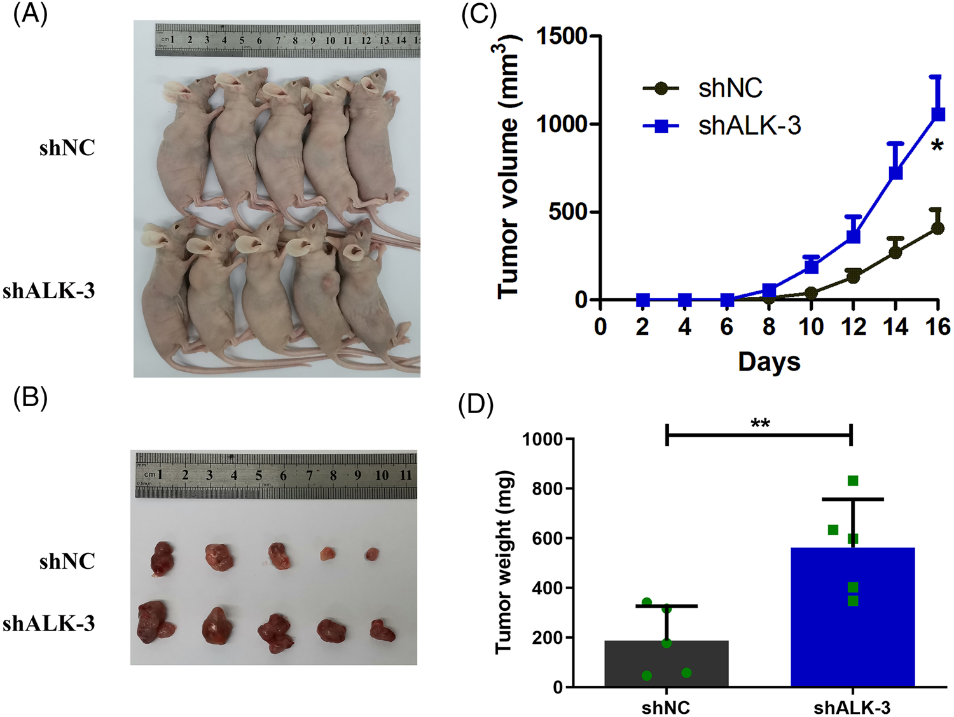
3)敲除ALKBH5可促进结肠癌细胞的生长和转移
我们探索了ALKBH5对结肠癌细胞功能的影响。我们初步鉴定了五种结肠癌细胞中ALKBH5的mRNA表达,并注意到与其他结肠癌细胞系相比,LOVO和RKO细胞中ALKBH5表达升高(图3A)。在LOVO和RKO细胞中使用三种特定的siRNA敲除ALKBH5(图3B,C)。利用敲除效率高的两个siRNA (siALKBH5-2, siALKBH5-3)构建敲除质粒(shALKBH5-2, shALKBH5-3),用于后续实验。我们使用两个独立的ALKBH5敲除慢病毒构建了两个稳定的细胞系。在mRNA和蛋白水平上验证敲除效率(图3D-F)。随后,CCK-8实验显示,ALKBH5敲除显著增强了细胞生长,以及LOVO和RKO细胞的活力(图3G)。通过克隆形成实验证实,敲除ALKBH5可显著提高LOVO和RKO细胞的克隆形成能力(图3H)。此外,我们使用transwell实验评估了LOVO和RKO细胞的迁移和侵袭能力。结果表明,敲除ALKBH5可显著提高细胞迁移和侵袭能力(图3I,J)。为了进一步确定ALKBH5在体内是否影响结肠癌细胞功能,我们建立了异种移植瘤模型。我们发现,当ALKBH5敲低的LOVO细胞植入时,肿瘤生长速度更快(图4C),肿瘤体积和重量增加(图4A,B,D)。

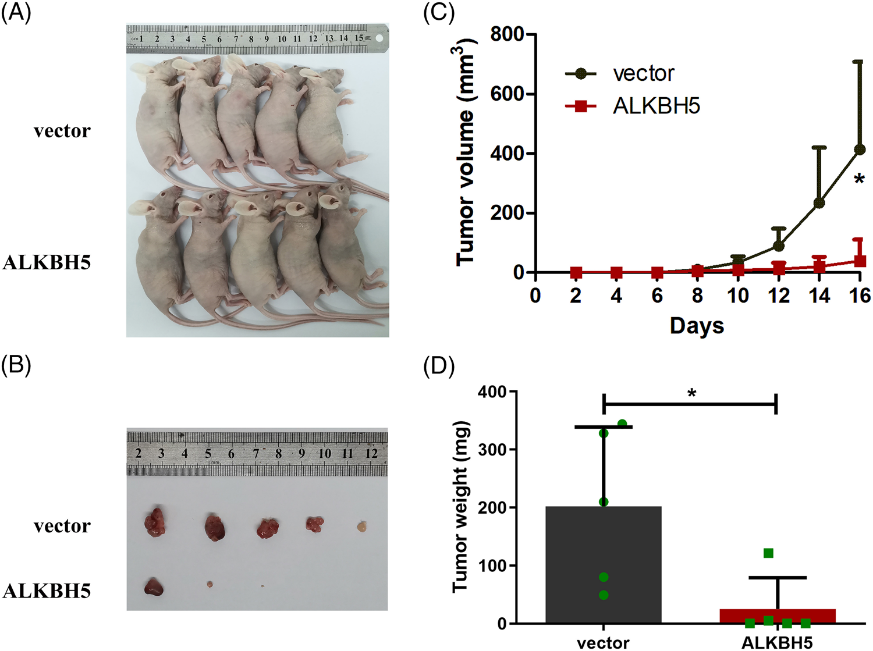
4)过表达ALKBH5可抑制结肠癌细胞的生长和转移
我们还利用慢病毒载体构建了过表达ALKBH5的稳定转染细胞系,RT-qPCR和Western blot实验验证了过表达效率(图5A-C)。CCK-8实验显示,过表达ALKBH5显著抑制细胞生长和LOVO和RKO细胞的活力(图5D)。集落形成实验证实,过表达ALKBH5导致LOVO和RKO细胞集落形成能力显著降低(图5E)。此外,通过transwell分析,过表达ALKBH5大大削弱了细胞迁移和侵袭能力(图5F,G)。然后,我们的肿瘤异种移植模型的结果表明,当移植过表达ALKBH5的LOVO细胞时,肿瘤生长速度较慢(图6C),肿瘤体积和重量降低(图6A,B,D)。

5)ALKBH5靶向PHF20
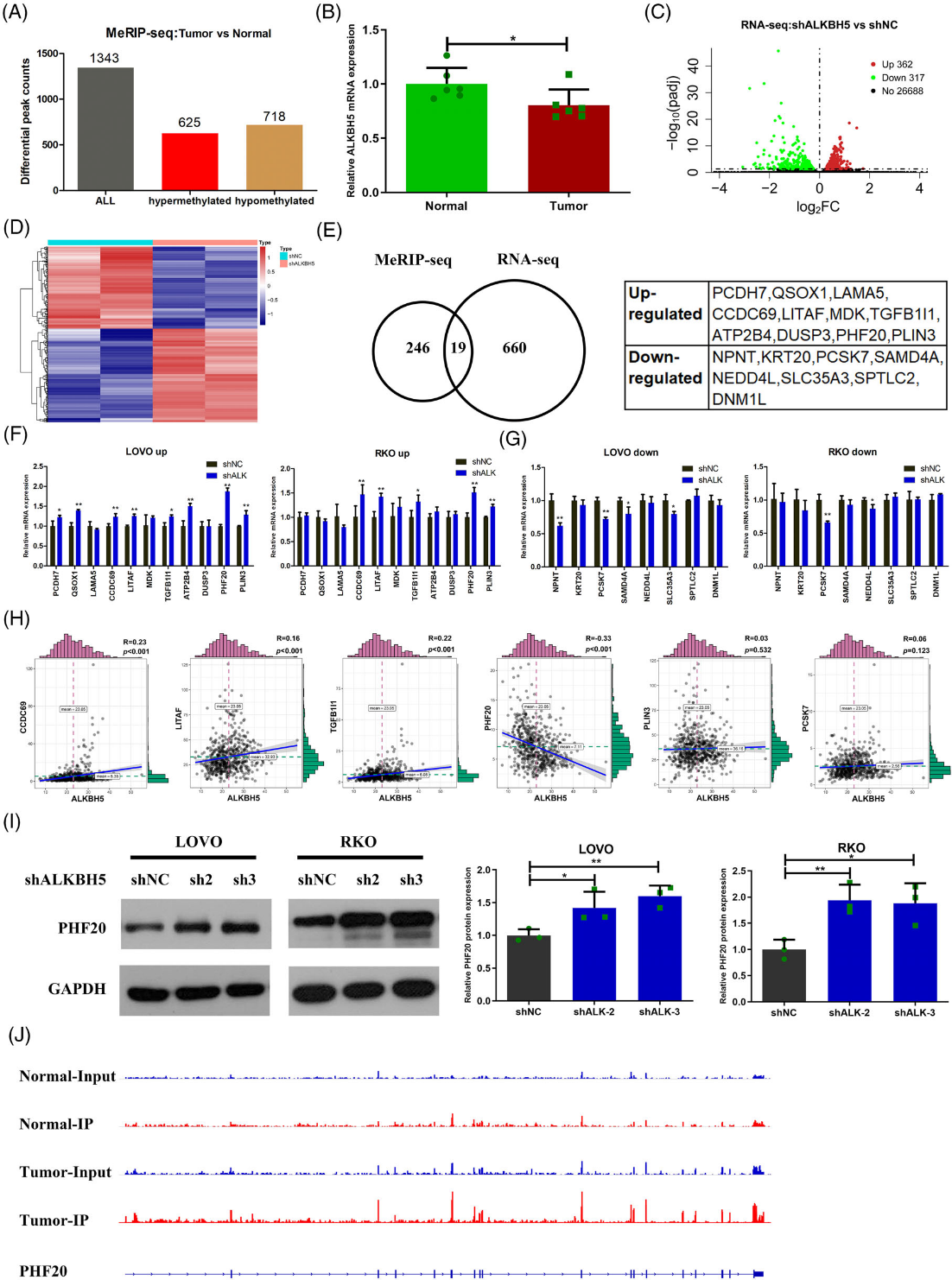
为了鉴定m6A修饰的靶点,我们收集了六名CRC患者的肿瘤组织和正常组织,用于MeRIP-seq。我们通过MeRIP-seEq在六对组织中鉴定了1343个调节失调的m6A峰(图7A)。其中,625个m6A峰在肿瘤组织中被高甲基化,而718个m6A峰在肿瘤中被低甲基化(图7A)。接下来,625个高甲基化m6A峰分布在265个基因的转录本中,718个低甲基化m6A峰分布在311个基因转录本中。有趣的是,我们发现,在MeRIP序列的六对组织中,肿瘤组织中ALKBH5的表达明显低于正常组织中的表达(图7B)。我们假设这265个基因的转录由ALKBH5调控。为了进一步探索由ALKBH5调控的m6A修饰靶点,我们在ALKBH55敲除的LOVO细胞和对照细胞中进行了RNA序列分析。结果表明,ALKBH5敲除后,679个基因差异表达,包括362个上调基因和317个下调基因(图7C,D)。结合MeRIP-seq和RNA-seq,我们发现19个基因通过m6A修饰潜在地受ALKBH5调控,包括11个上调基因(PCDH7、QSOX1、LAM5、CCDC69、LITAF,MDK, TGFB1I1, ATP2B4, DUSP3, PHF20和PLIN3) 和8个下调基因(NPNT、KRT20、PCSK7、SAMD4A、NEDD4L、SLC35A3、SPTLC2和DNM1L)(图7E)。然后,我们检测了这19个基因在ALKBH5敲除后的表达情况。RT-qPCR结果显示,11个上调基因中,5个基因(CCDC69、LITAF、TGFB1I1、PHF20和PLIN3)在ALKBH5基因敲除的LOVO和RKO细胞中均上调(图7F)。此外,我们发现,在8个下调基因中,只有PCSK7在ALKBH5敲除的LOVO和RKO细胞中下调(图7G)。接下来,我们检查了ALKBH5与TCGA数据库中六个候选基因之间的相关性。我们的结果表明,在CRC中,只有PHF20与ALKBH5呈负相关(图7H)。我们还通过Western blot检测验证了与对照细胞相比,ALKBH5敲除细胞中PHF20蛋白表达的升高(图7I)。此外,可视化分析表明,与正常组织相比,PHF20 mRNA的m6A峰在肿瘤组织中更为丰富(图7J)。因此,PHF20可能是通过m6A修饰由ALKBH5调节的关键分子。
6)ALKBH5的缺失增加了PHF20 mRNA的稳定性,进而促进结肠癌的进展
作为去甲基酶,ALKBH5能够从mRNA中去除m6A修饰。mRNA的m6A定量分析表明,ALKBH5缺失显著增加了mRNA的m6A修饰水平(图8A)。MeRIP qPCR分析表明,ALKBH5缺失显著增加了PHF20 mRNA的m6A修饰水平(图8B)。接下来,我们利用SRAMP数据库和和BEMP数据库预测PHF20 mRNA的m6A位点。我们发现PHF20 mRNA上的m6A甲基化位点主要位于3′UTR,并且有8个可能的m6A甲基化位点。根据PHF20 mRNA上的m6A甲基化位点,我们构建了荧光素酶报告载体(图8C)。荧光素酶报告分析表明,ALKBH5缺失显著增强野生型PHF20 3’UTR质粒的表达,但对具有m6A突变位点的PHF20 3’UTR质粒没有显著影响(图8D)。为了评估ALKBH5对PHF20 mRNA稳定性的影响,我们用放线菌素D处理结肠癌细胞,发现ALKBH55缺失改善了PHF20的稳定性并延长了其半衰期(图8E)。然后我们进行拯救实验,以确定ALKBH5是否通过调控PHF20影响结肠癌细胞的生物学功能。结果显示,PHF20敲除抑制了shALKBH5介导的LOVO和RKO增殖、菌落形成、迁移和入侵的增强(图8F-I)。

结论:
我们确定ALKBH5表达在CRC中下调,并起到关键的肿瘤抑制作用。机制上,ALKBH5通过去除m6A修饰抑制PHF20 mRNA的稳定性。我们的研究为ALKBH5介导的m6A修饰的抗癌作用提供了新的见解,并表明靶向ALKBH5介导的PHF20 mRNA的m6A修饰可能是一种有希望的结肠癌干预和治疗策略。
参考文献:
Zhang Z, Wang L, Zhao L, Wang Q, Yang C, Zhang M, Wang B, Jiang K, Ye Y, Wang S, Shen Z. N6-methyladenosine demethylase ALKBH5 suppresses colorectal cancer progression potentially by decreasing PHF20 mRNA methylation. Clin Transl Med. 2022 Aug;12(8):e940. doi: 10.1002/ctm2.940.






