通过单细胞RNA和ATAC测序揭示灵长类中间神经元发育过程中进化保守和非保守的调控网络
灵长类动物和啮齿类动物大脑在大小和功能上的差异,以及兴奋/抑制平衡紊乱与许多神经发育障碍之间的关系,凸显了研究灵长类神经元嵴(ganglionic eminences, GEs)发育的重要性。单细胞RNA-seq (Single cell RNA-seq, scRNA-seq)已应用于发育神经科学的研究。传统的批量RNA-seq产生组织的混合表达数据,与此相比,scRNA-seq可以提供单细胞的转录谱具有如此高分辨率的技术可以区分不同的细胞类型,并促进对复杂神经系统的研究在小鼠中进行的单细胞研究揭示了胚胎发育过程中GE中间神经元的分子和转录特征的多样性。然而,关于灵长类GE发育过程中抑制性神经元产生的研究报道很少,而且由于缺乏转录分析或转录分析的质量,啮齿类和灵长类之间的保守性和异质性仍然有限此外,在复杂的细胞增殖,空间区分,谱系决定和中间神经元迁移的复杂调控网络仍然不清楚。该研究发表于《Cell Research》,IF:46.297。
技术路线:
主要研究结果:
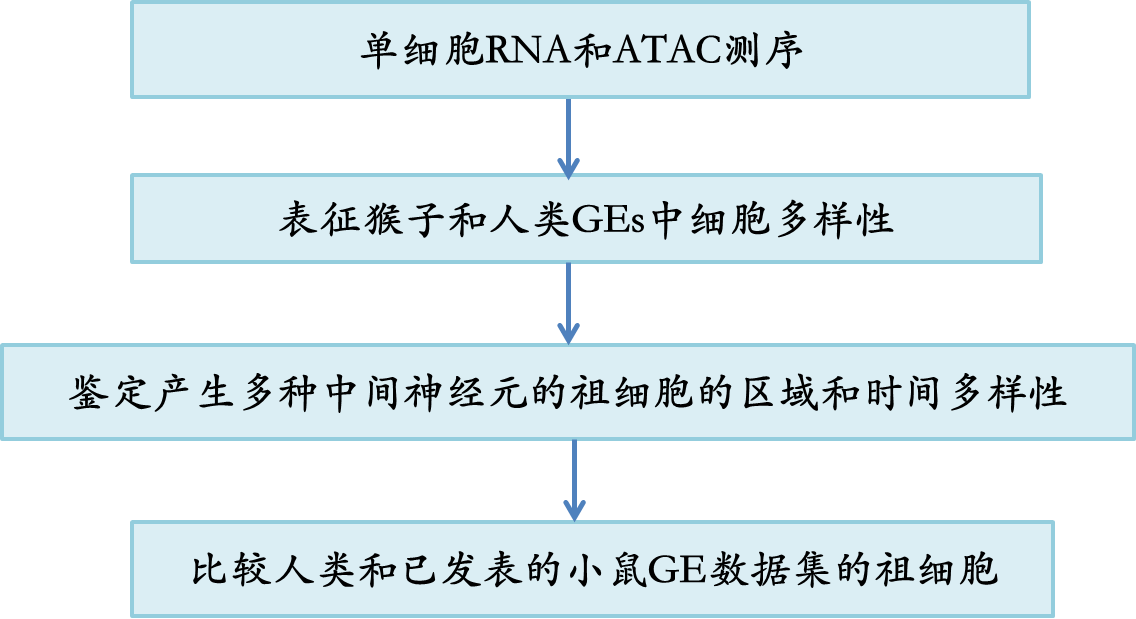
1. 灵长类胚胎发育早期阶段的细胞多样性
作者对三个食蟹猴和两个人类胎儿的胚胎进行了基于微滴的单链RNA测序,以解剖和比较灵长类胚胎的发育特征。猕猴的样本来自胃周7、10和12,此时GEs仍处于早期发育阶段。人类样本来自孕9和13周,可能处于类似的发育窗口期(图1a)。经过测序、图谱绘制和质量控制,作者获得了来自人类的13,782个细胞和来自猕猴的29,269个细胞。然后通过Seurat3.0.45将两个物种的数据进行整合,使用Unsupervised方法将不同的细胞聚类(图1b),作者检测到21个细胞簇。每个簇都用那些细胞分类的知名标记进行注释(图1b)。作者从表达NRN1和SLA46,47的相邻大脑皮层中移除了两个兴奋性神经元簇。作者还发现了由其相应标记CX3CR1和SLC4A148,49识别的小胶质细胞和血细胞簇,这些细胞簇也被移除。在剩余的GE来源细胞中,作者可以通过差异基因表达分析区分细胞与GE祖细胞和有丝分裂后细胞。神经祖细胞包括放射状胶质细胞(radial glia cells, RGCs)和中间祖细胞(intermediate progenitor, IPCs)在GEs中高表达NES, VIM或ASCL1, DLL150(图1c, d)。细胞周期中的增殖细胞可以用TOP2A51标记(图1c, d),有丝分裂后细胞可以进一步用区域特异性标记(图1c)。MGE由特异性表达NKX2-1和LHX6的细胞组成,而LGE由MEIS2和ISLR2组成,CGE由NR2F1和NR2F2组成(图1d)。然后作者计算了每一种细胞类型中人和猕猴细胞的归一化细胞比例,并在河流图中可视化,表明人和猕猴GE细胞分区之间没有显著差异(图1e)。基于人类和猕猴不同细胞类型之间基因表达的相似性分析也证明了两种物种数据整合的准确性(图1f)。为了展示灵长类GEs的细胞发育轨迹,作者进行了RNA速度分析(scVelo) 52,53,这是一种通过重建转录变化的发育序列来推断轨迹的方法。正如预测的那样,来自GE祖细胞的细胞增殖并产生IPCs 54,然后在MGE、LGE和CGE中分化为各种谱系(图1g)。综上所述,作者的分析证实了猕猴和人类之间基本的进化保守性,揭示了人类和猕猴GEs细胞的多样性和发展轨迹。

图1 胚胎灵长类GEs的转录谱
2. 灵长类GE祖细胞的特异性细胞特性
在哺乳动物发育中的大脑中,神经元是由大脑皮质和GE中位于脑室区(VZ)的RGCs和位于脑室下区(SVZ)的IPCs产生55,56。作者将来自人类和恒河猴GE的神经祖细胞分为亚群,包括RGCs和IPCs(图2a)。通过HES1、VIM和NES的高表达来区分RGCs,而通过ASCL1、HES6和dlx250,57的表达来区分IPC(图2b)。在所有的RGCs中,作者观察了不同GE祖细胞的区域一致性。NKX2-1, PAX6和NR2F2的表达分别代表MGE, LGE和CGE祖细胞(图2c)。
对大脑皮质的研究表明,在灵长类新皮质中,SVZ/VZ外有一个特殊的增殖区域,称为室管膜下区(outer subventricular zone, oSVZ) 56位于oSVZ的外放射状胶质细胞(oRGs)不同于位于VZ的RGCs,它们被认为是灵长类动物,尤其是人类脑容量扩张的主要贡献者值得注意的是,作者根据FAM107A、HOPX和TNC58的集中和特异性表达,在GEs的RGCs中识别出了灵长类动物特异性的外放射状胶质细胞(oRGs)(图2a, b)。作者对HOPX进行了免疫染色,并证实了HOPX在GW13人类和GW12猕猴LGE的VZ和SVZ以及远离VZ的区域的表达,与皮质中的表达相似(图2d)。然而,作者在小鼠GE或皮质中未观察到任何阳性信号。这表明在灵长类动物大脑发育过程中,oRGs不仅存在于大脑皮层,也存在于大脑GEs中。
然后,作者试图发现灵长类动物和小鼠之间的GE祖细胞的差异。作者将灵长类动物的数据与已发表的小鼠GE数据集集成,并对祖先集群进行子集。针对HES1+ RGCs,作者进行了不同物种之间的差异基因表达分析(图2e)。作者确定了一组在人类和猕猴中高度表达的基因(图2e)。在这些差异表达基因(DEGs)中,有一些是之前报道的在人类RGCs中特异性表达的基因,如MOXD1和TCIM58-60(图2e和补充信息图S2c),这验证了作者的发现。其他增殖相关基因如CLU61和VEPH1,62也可能导致物种差异(图2e)。
RGCs到IPCs以及有丝分裂细胞到有丝分裂后细胞的转变在脑发育过程中细胞的发育和分化中起着重要作用。IPCs分析显示,在灵长类和小鼠中,G蛋白耦联受体信号级联的调节因子RGS16在刚刚进入有丝分裂后期的细胞中特异性表达(图2f)。通过scATAC-seq进行的基因调控网络显示,RGS16受几个增殖相关基因的调控,如PAX6、GLI3和HES565-67(图2f)。此外,区域特异性标记物,如MGE中的NKX2-1, CGE中的NR2F2和LGE中的ISL1开始表达与RGS16表达减少相关。这些模式表明RGS16可能作为IPCs和细胞命运决定的前体细胞之间的过渡因子。
以上结果表明,oRGs存在于灵长类发育中的大脑和大脑皮层中,这可能是灵长类和啮齿类动物物种差异的原因之一。
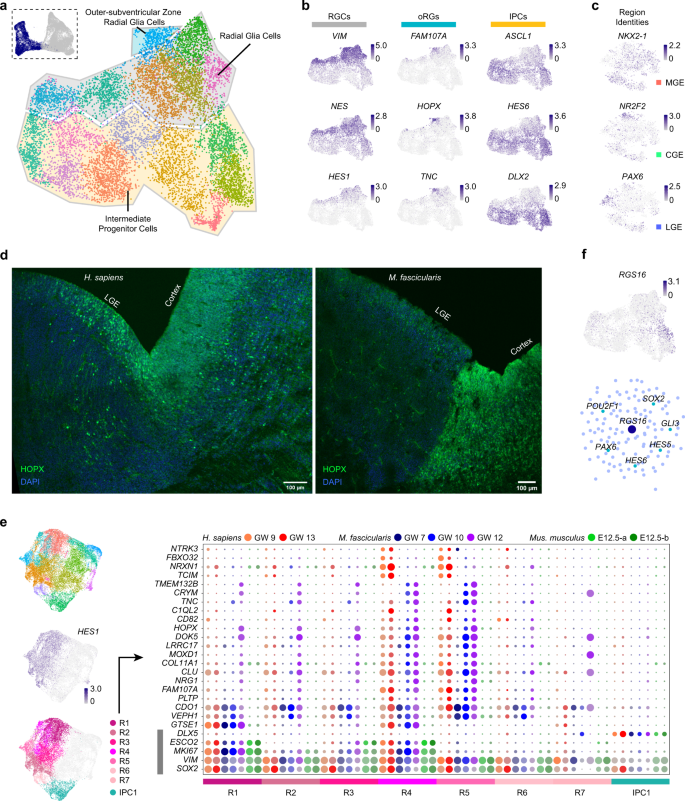
图2 灵长类GE祖细胞的特征和人类与小鼠的比较
3. MGE和CGE中细胞命运的决定
为了描绘MGE中的发育谱系,作者选取了LHX6表达组进行进一步的差异基因表达分析和轨迹重建(图3a)。作者检测到四种不同的细胞类型,其中一种根据它们的基因表达谱推测是前体。其他三个分支分别由表达SST、LHX8和CRABP1的细胞组成(图3b, c)。
MGE前体由转录因子NKX2-1、TOX3和PLS3的表达确定(图3b),这些转录因子在细胞成熟过程中逐渐表达。所有在MGE中推测的更成熟的细胞都表达NRXN1和CHL1,根据生物过程基因本体,它们的功能与细胞黏附和轴突投射相关(图3d)。
在整个SST+中间神经元谱系中,ZEB2和PLS3与ERBB4和CXCR4等基因一起表达(图3b)。已有研究报道ERBB4和CXCR4调控小鼠GE中间神经元向大脑皮层的切向迁移。这些模式提示,来源于MGE的SST+中间神经元会迁移到大脑皮层。
LHX8+细胞是MGE衍生的胆碱能投射神经元,定位于基底端脑。大部分LHX8+细胞在人类GW9和猕猴GW7的MGE中被检测到,但在三个较老的样本中几乎没有检测到(图3f)。同样,在小鼠MGE中,E11和14时检测到的LHX8+细胞比E17时多得多。这表明LHX8+胆碱能投射神经元可能在灵长类动物大脑发育的早期产生,这与小鼠的发现一致。
作者还发现了一小群与LHX8+细胞一起特异性表达CRABP1和ANGPT2的细胞(图3b-e)。作者对这两组细胞进行了独立分析,以便找到更多关于它们的细节。特征图显示ANGPT2的表达与LHX8完全分离,而CRABP1在一小部分LHX8+细胞中表达(图3e)。
对DEGs的进一步检查发现,ANGPT2+组中有ST18和ETV1表达。ST18和ETV1被描述为皮质小白蛋白(PV)中间神经元前体的标志物17作者假设这些细胞会在大脑发育过程中迁移到大脑皮质,并代表皮质PV中间神经元的前体。
以上结果表明,MGE中细胞分化较早,细胞谱系呈时间依赖性多样化,Monocle370构建的伪时间分析也体现了这一点(Fig. 3g, h)。
CGE主要产生5HT3aR+皮质中间神经元。作者提取了CGE细胞,以检查其细胞多样性。几乎所有的CGE细胞都高表达NR2F1和NR2F2。在这一发育阶段,作者检测了CALB2和CCK的表达,它们可能代表了成人大脑皮质中的一组双极和多极中间神经元。然而,在作者的数据中,其他经典的CGE衍生的中间神经元标志物(如RELN和VIP)几乎不表达。这些结果表明,在灵长类CGE中,CCK+和CALB2+的中间神经元可能比RELN+和VIP+的中间神经元更早被指定。
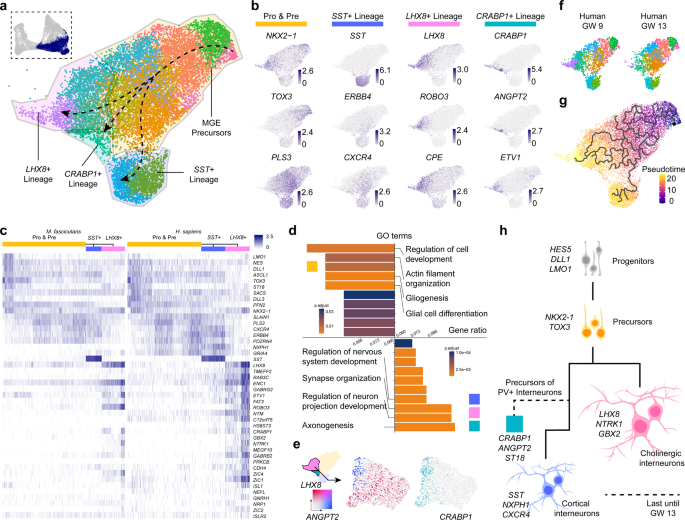
图3 灵长类动物MGE发育分析
4. 细胞命运决定着LGE的发展
LGE被认为是纹状体MSNs和嗅球中间神经元的起源。为了揭示其发育轨迹,作者从灵长类动物的合并数据中选择了LGE谱系。在无监督聚类后,在灵长类动物发育中的LGE中检测到7种不同的细胞类型(图4a)。作者发现,纹状体MSN前体可以根据FOXP1的表达分为背侧LGE (dLGE)和腹侧LGE (vLGE)。在dLGE中,大多数细胞是TSHZ1+纹状体黑质(D1) MSN。在vLGE中,有两种类型的中间神经元,纹状体黑质(D1) MSNs表达PDYN,纹状体苍白球(D2) MSNs表达PENK74-76(图4 b)。
然后作者进行了OB谱系和其他三个纹状体谱系之间的差异基因表达分析。火山图显示,OB谱系细胞高水平表达干细胞相关基因,如TOX3、CHD7和ID277-79(图4c)。对这些DEGs的基因本体分析支持嗅球中间神经元前体细胞存在于LGE的证据(图4d)。不同时间的细胞分布表明,在人类和猕猴中,大多数OB谱系细胞都是在GE的后期阶段检测到的。这些结果表明,嗅球中间神经元前体细胞在LGE中产生的时间晚于纹状体MSN前体细胞,然后会迁移到嗅球进一步增殖。
有趣的是,作者还发现一组细胞共享一些不同于纹状体MSNs的MGE标记,如LHX8, NKX2-1和LHX6,以及包括ZFHX3和ISLR280的LGE标记(图4e)。这些细胞中MEIS2的表达缺失进一步表明它们与LGE来源的细胞不同。为了弄清楚这些细胞的身份和来源,作者发现它们的特异性标记在其他典型的LGE或MGE簇中不表达(图4e)。NRP1编码Semaphorin信号通路中的受体Neuropilin-1。81、82个NRP1在这些细胞中集中表达,而SEMA3A主要在共表达EBF1的典型LGE MSNs中表达(图4e)。因此,作者假设这组细胞可能来源于MGE,并在SEMA3信号通路的调控下沿着发育中的纹状体迁移到皮质CellChat分析83(这是一种可以通过预测主要信号输入和输出来计算集群间细胞-细胞信号通路的工具)表明,SEMA3信号通路在LGE组中高度激活。在该通路中,SEMA3A表达细胞可能会释放信号,并且NRP1表达细胞会对SEMA3A产生反应(图4f)。另一个在这些细胞中高表达的基因,PEG10,引起了作者的注意。PEG10可以产生长链非编码RNA (long noncoding RNA, lncRNA)和PEG10蛋白,两者都可以促进癌细胞的迁移。之前的研究表明,MIR7-3HG作为竞争性内源RNA从microRNA27 - a -3p释放PEG10 RNA 86MIR7-3HG在来自人类样本的这些细胞中也高水平表达,这可能调节PEG10的表达。此外,作者下载了Sun 's group80提供的原位测序数据,并将信号转换为图像。在人GW12时,一组NKX2-1+和LHX8+细胞位于远离MGE的位置。这些结果表明,一组来自MGE的LHX8+中间神经元会沿着LGE迁移,并在GE发育过程中受到SEMA3A-NRP1信号通路和MIR7-3HG-PEG10通路的调节(图4g)。结合伪时间分析,作者对LGE的研究揭示了区域遗传调控模型(图4h)。

图4 LGE发育和可能迁移细胞的特征
5. 人类基因的转录调控网络
作者还对GW9的人类GE进行了scATAC-seq分析,以更详细地研究人类发育中的GE的转录调控网络。利用对scATAC-seq数据的两次技术重复进行的单细胞分析,作者获得了240,672个可访问峰的一致集,这些峰代表潜在的顺式调节元件。作者通过ArchR87整合了人类scATAC-seq数据和作者的GW9 scRNA-seq数据,发现两组数据之间有4种主要的细胞类型匹配(图5a)。作者使用基因评分,这是一种基于调控元件可及性的基因表达预测工具,在UMAP图上将GE祖细胞、MGE、LGE和CGE的典型标记基因表达水平可视化(图5b)。作者基于人类scRNAseq数据建立了四种主要细胞类型的标记基因列表。在标记列表中,ZNF503和LHX8是LGE和MGE谱系的代表性标记。作者在LGE中发现了ZNF503上游的两个特异性可及基因组区域(开放染色质峰),在MGE中发现了LHX8上游的一个独特的峰(图5c)。根据UCSC浏览器中的UCSF脑甲基化数据库(http://genome.ucsc.edu), LHX8的这个独特的峰包含一个高H3K4Me3修饰区域,以及一个预测的PRX2结合位点。与ZNF503相关的两个峰均包含预测的MEIS1靶motif, MEIS1是LGE80的标记物。这些结果提示了LHX8在MGE中的表达和ZNF503在LGE中的表达的潜在调控机制。
然后,作者使用Tu实验室开发的方法将远端顺式调控元件连接到单个基因,从而生成基因调控网络(GRN),以识别候选转录因子(TFs)和调控因子。在捕获的所有调控对中,作者选择了那些都在Cytoscape88显示的标记列表中的上游tf和下游基因(图5d)。每一组细胞都显示出其特定的和共享的调控网络。例如,除了众所周知的转录因子NKX2-1和LHX6, MGE还与CGE共享ARX和MEF2C,而NR2F2和NFIB则专门调控CGE的发育。LGE似乎有一个相对独立的调控网络,主要由ISL1、FOXP1和ZFHX4组成(图5d)。作者基于蛋白-蛋白相互作用(PPI)从三个GE亚区中提取hub基因,得到了类似的结果(图5e)。
接下来,作者试图寻找可能在GE发育过程中发挥重要作用的未知基因。microRNA9-1的宿主基因MIR9-1HG(又名C1orf61)在作者的研究中脱颖而出。它参与了祖细胞和MGE的发育(图5d)。作者通过寻找MIR9-1HG的潜在上游基因,以了解其调控机制。结合MIR9-1HG周围开放的染色质峰和TFs的潜在结合基序,作者从8个候选TFs中选择了3个TFs, MAZ, TCF4和ASCL1(图5f)。有报道称MAZ是一种转录激活因子结合蛋白89,这表明MAZ支持MIR9-1HG的表达。TCF4是一个参与神经分化起始的TF 90,91,其结合基序被映射到MIR9-1HG转录起始位点周围的开放染色质峰(图5)。不同细胞类型的基因表达水平之间的相关性分析显示,在作者的数据中,在所有类型的细胞中,TCF4和MIR9-1HG之间均呈显著正相关(图5g)。这表明MIR9-1HG的表达受到TCF4的正调控。接下来,作者发现ASCL1结合基序位于MIR9-1HG下游的开放染色质峰,尤其是在祖细胞簇中(图5h)。在前体细胞中,ASCL1与MIR9-1HG呈显著负相关,而在MGE和LGE中,ASCL1与MIR9-1HG呈正相关(图5g)。作者假设ASCL1可能抑制MIR9-1HG在祖细胞中的表达,而不是在MGE中。作者进一步检测了MIR9-1HG潜在的下游基因。由于MIR9-1HG是一个lncRNA, microRNA9-1可以从其剪接或生成,作者在三个不同的数据库中搜索hsa-mir-9-1的靶基因,TargetScanVert, miRDB和TargetMiner。在所有数据库中,共有4个基因同时受到hsa-mir-9-1-3p和5p的调控。其中两个先前被描述为LGE特异性tf, ZFHX4和ID4。这两个基因的表达水平在MGE和LGE中均与MIR9-1HG呈显著负相关(图5g)。在MGE中,MIR9-1HG高表达,而ZFHX4和ID4几乎不表达,而在LGE中基因表达模式相反。综上所述,这些结果提出了一个新的MIR9-1HG受ASCL1和TCF4调控的调控通路。mir-9- 1hg编码的hsa-mir-9-1可抑制ZFHX4和ID4的表达。这可能解释了在人类早期大脑发育过程中,MGE和LGE的不同命运是如何决定的。
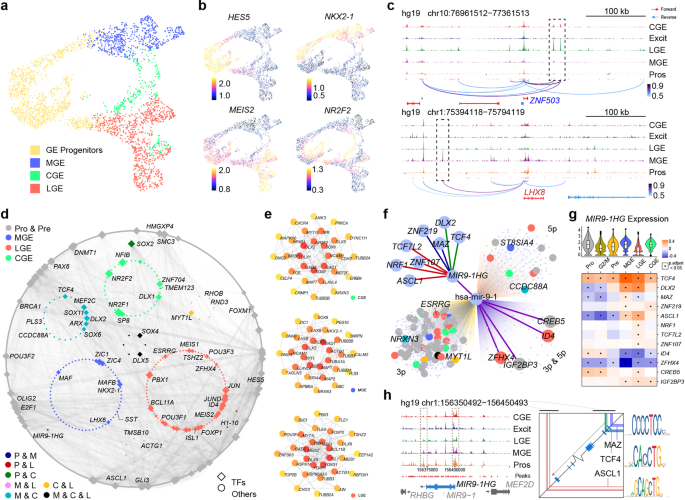
图5 MGE和LGE的scATAC-seq分析和调控异质性
结论:
该研究证明了人类和食蟹猴在GEs中细胞多样性和谱系特征的高度保守。研究者发现了人类和小鼠GE祖细胞之间的一些DEGs,并发现了灵长类GE中存在的oRGs。此外,该研究验证了基因调控网络在发育中的灵长类GE中的保守性,并探索了涉及不同GE区域的细胞迁移和命运决定的新机制。
参考文献:
Zhao, Z., Zhang, D., Yang, F. et al. Evolutionarily conservative and non-conservative regulatory networks during primate interneuron development revealed by single-cell RNA and ATAC sequencing. Cell Res 32, 425–436 (2022). https://doi.org/10.1038/s41422-022-00635-9






