不一样的研究视角——乳酸受体HCAR1促进神经细胞增殖改善新生儿脑卒中
新生儿脑缺氧缺血(HI)是新生儿死亡和残疾的主要原因,目前唯一的治疗方法是低体温疗法。然而,仍需要新的药物来保护大脑,并在受伤后促进其恢复。对小鼠的研究发现,乳酸可能有助于大脑恢复。乳酸还可以作为一种信号分子,与细胞表面HCAR1结合。然而,人们对HCAR1在大脑中扮演的角色以及它是否有助于大脑从缺氧缺血性损伤中恢复知之甚少。为此,Kennedy等比较了WT和HCAR1敲除的经历HI脑损伤的新生小鼠。结果发现虽然HCAR1并不能保护小鼠免受HI的伤害,但它确实能帮助大脑恢复,即通过启动与免疫系统和细胞周期有关的基因,导致新的脑细胞形成,以重新填充受伤的区域。相比之下,缺乏HCAR1的小鼠的脑组织几乎不产生任何新细胞。本研究于2022年8月发表在《eLife》IF:8.713期刊上。
技术路线:

主要实验结果:
1、HI后脑组织再生需要HCAR1
为了研究HCAR1在应激诱导的神经元损伤和随后的神经发生中的作用,作者在9天龄的HCAR1 KO和WT小鼠中诱导HI。HI后,采用TTC染色检查急性脑组织损伤,HCAR1 KO和WT小鼠在HI后24小时显示同侧半球全面损伤,两组间的TTC百分比无显著性差异(Figure 1A–B),表明HCAR1不能影响大脑的急性损伤。在HI急性期后,有一个神经发生和组织修复的阶段。为了评估HCAR1在组织修复中的潜在作用,测量了HI后42天的组织损失。结果显示,WT小鼠的脑组织丢失占到17%,而HCAR1 KO小鼠的脑组织丢失高达31%,极显著高于WT小鼠,这表明HCAR1在HI后诱导神经发生和组织修复中具有重要作用。综上,HCAR1不能保护大脑免受脑HI后的急性组织损伤,但能促进脑组织再生。
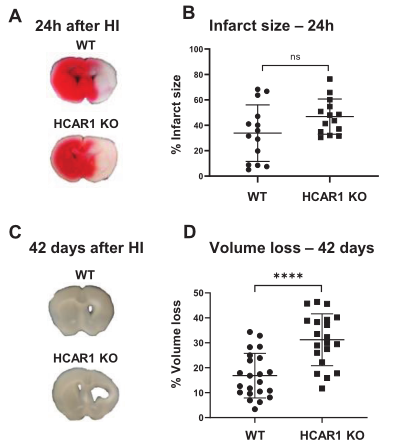
图1 HCAR1不能保护大脑免受脑HI后的急性组织损伤,但能促进脑组织再生
缺血性损伤后的组织修复是通过增加神经祖细胞的增殖和分化来实现的。为了测试HCAR1对神经前体细胞增殖和细胞命运的影响,对来自HCAR1 KO和WT小鼠前脑的球进行了神经球实验。结果发现来自HCAR1 KO小鼠的神经球与来自WT小鼠的神经球相比发展出更少的细胞集落(Figure 2A–B and G)。两种基因型的球体平均大小差异不显著(Figure 2A–B and H)。这说明HCAR1 KO神经前体细胞的自我更新能力较低,增殖能力较弱。为检测HCAR1是否影响细胞命运,将神经球分离,在分化培养基中培养5天,用神经元标志物Tuj1和星形胶质细胞及神经前体细胞标志物GFAP进行免疫标记,结果显示与WT组比较,HCAR1 KO组Tuj1+阳性神经元比例显著下降(Figure 2C–D,I),而GFAP无差异(Figure 2E–F,I)。这表明HCAR1可能会引导神经前体细胞走向神经元的命运,但还需要更多的实验来研究其对细胞分化的影响。
由于神经球数据提示神经前体细胞增殖受损,所以随后检测了HCAR1 KO和WT小鼠HI后的体内细胞增殖。小鼠于HI后4-7天注射增殖标记物BrdU,第7天处死。本文集中分析纹状体室下生态位,因为这是一个包含大量缺氧缺血后细胞增殖的神经前体细胞的区域,但由于室管膜下层区域(SVZ)的HI反应存在区域差异,所以作者分析了两个独立的室下生态位区域,即心室毗邻室下区(V-SVZ)和更侧位脑室的下-中间区(SVZ-IZ)(Figure 2J)。在SVZ-IZ中,受HI影响的同侧半球的总体细胞密度比WT小鼠的对侧半球增加了47%,而在KO小鼠中(Figure 2K–L and O),细胞总体密度没有影响(Figure 2M–O),并且相比于KO组,HI后WT组的总体细胞密度显著更高(Figure 2O)。此外,WT小鼠的HI受损同侧细胞增殖的BrdU +细胞比例增加了一倍,而KO小鼠无显著改变,HI后WT组的BrdU +细胞也显著高于KO小鼠(Figure 2P)。总之,这些数据表明HCAR1 KO小鼠在HI后不能完全激发细胞增殖。然后观察HI诱导的双皮质素阳性(DCX+)神经元前体细胞的增殖。HI后,在同侧SVZ-IZ中两种基因型小鼠的DCX+ / DAPI +细胞比例都增加了一倍以上,表明HCAR1 KO小鼠中有完整的反应性神经发生(Figure 2K–N and Q),然而DCX +BrdU +的神经前体细胞比例的增加只在WY小鼠中观察到,KO小鼠则没有显著差异(Figure 2K–N and R)。综上所述,这些数据表明HCAR1 KO小鼠在HI后不能增加神经前体细胞的增殖,提示HCAR1需要刺激神经细胞增殖来诱导缺血损伤后的组织修复。
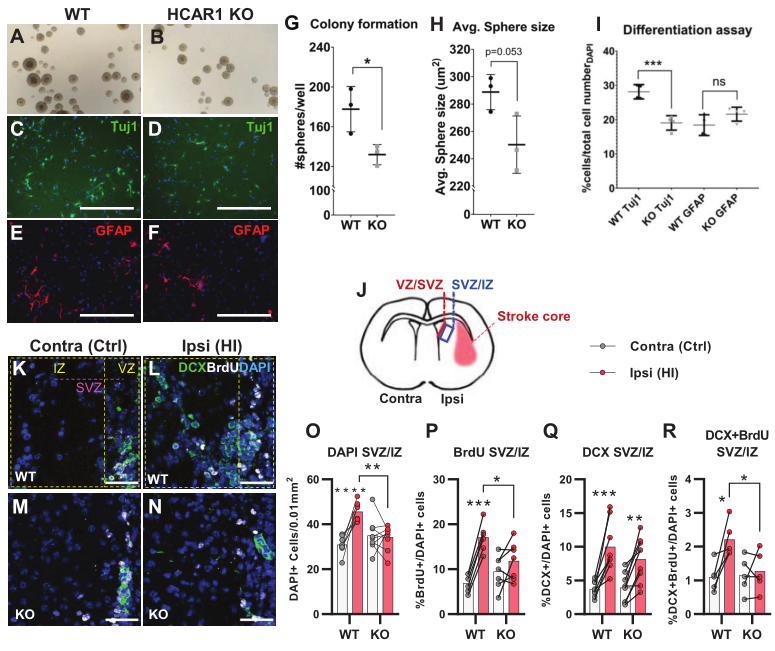
3、HCAR1 KO小鼠的小胶质细胞增殖和激活受损
在大脑HI之后,小胶质细胞被招募到受伤的部位,在那里它们清除死细胞的碎片,以促进修复过程,这过程需要增加小胶质细胞的增殖、活化和迁移。与前述只有WT小鼠在HI后总细胞密度增加的脑室下生态位相反,两种基因型小鼠梗死周围区域的细胞密度都有增加(Figure 3A–E)。WT组HI同侧小胶质细胞比例增加,HCAR1 KO组小胶质细胞比例增加不明显(Figure 3F)。如预期的,与对侧相比,WT小鼠HI同侧半球增殖的小胶质细胞比例明显增加,然而,在HCAR1 KO小鼠中未检测到增加(Figure 3G)。以上HCAR1 KO导致表明小胶质细胞增殖受损。
然后评估了小胶质细胞的激活情况。激活的小神经胶质细胞有更大的细胞体和更少的分支,即它们有更短和更少的分支。在WT小鼠中,HI同侧半球的小胶质细胞比对侧的小胶质细胞体积更大,分支更少,这表明其表型被激活(Figure 3A–B,H-I),而在KO组则无显著差异,表明HCAR1 KO导致小胶质细胞激活缺陷。

图3 HCAR1 KO小鼠HI后小胶质细胞活化和增殖缺陷
鉴于以上数据表明HCAR1对于HI后的神经元和小胶质细胞增殖非常重要,所以作者进一步探究了HCAR1是否也参与了其余脑细胞如星形胶质细胞和少突胶质细胞的增殖。用GFAP和增殖标记物BrdU进行免疫标记,显示WT小鼠HI同侧半球的GFAP+细胞和增殖的GFAP+虽然GFAP可以标记非反应性星形胶质细胞和反应性星形胶质细胞,但需要注意的是,并非所有非反应性星形胶质细胞都是GFAP阳性,而反应性星形胶质细胞的特征是GFAP水平高细胞的比例的显著增加,但在HCAR1 KO小鼠中没有增加(Figure 4A–F)。虽然GFAP可以标记非反应性和反应性星形胶质细胞,但需注意的是,并非所有非反应性星形胶质细胞都是GFAP阳性,而反应性星形胶质细胞的特征是GFAP水平高。因此,GFAP +细胞的增加主要代表反应性星形胶质细胞增生,这发生在梗死周围区域。
随后用Olig2标记少突胶质细胞,该标记可以标记所有发育阶段的少突胶质细胞。HCAR1 KO和WT小鼠HI后梗死灶周围少突胶质细胞或增殖少突胶质细胞的比例均无明显变化(Figure 4G–L)。但WT小鼠梗死区域Olig2+BrdU+标记的增殖性少突胶质细胞的密度显著增加,而KO小鼠则无变化(Figure 5C-D),暗示HCAR1可能参与少突胶质细胞的增殖。
最后,通过使用APC标记成熟和前少突胶质细胞(不是少突胶质细胞前体),发现HCAR1 KO和WT小鼠的中HI后同侧半球的细胞比例都显著降低了(Figure 4M–Q),APC细胞密度也都显著下降(Figure 5E)。
以上结果表明HCAR1影响梗死区周围的反应性星形胶质细胞和少突胶质细胞的增殖。

图4 HI后星形胶质细胞和少突胶质细胞增殖
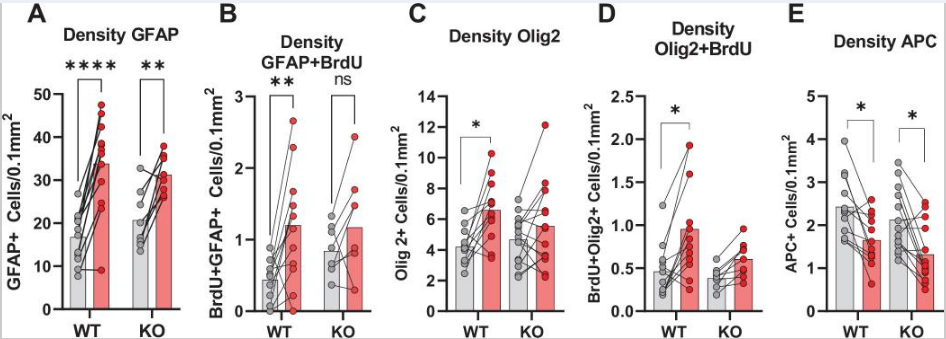
图5 梗死周围GFAP、Olig2和APC的密度测定
5、HCAR1 KO小鼠SVZ对HI的转录反应较弱
为研究HCAR1参与脑组织再生的机制,通过RNA测序对大脑HI后小鼠受影响的同侧和对侧(对照)半球的SVZ区域进行了全转录组分析。PCA显示来自WT小鼠同侧半球的组织样本远离对侧半球的样本,表明对HI有很强的转录反应(Figure 5A)。来自HCAR1 KO小鼠对侧半球的样本与WT对侧样本具有相似的基因表达模式。值得注意的是,HI同侧HCAR1 KO样本也与WT和KO对侧样本聚在一起。表明HCAR1 KO脑室对HI的转录反应似乎严重受损。
然后,对SVZ样本进行GSEA分析,以识别该区域两种基因型之间的差异调控通路。多个通路在HCAR1 KO和WT的HI同侧SVZ样本中有差异表达(Figure 5B)。有趣的是,HCAR1 KO的细胞周期通路强烈下调。四个不同实验组中差异调控细胞周期基因的相对表达情况如Figure 5C所示。与野生型相比,HCAR1 KO细胞周期基因的下调可能是HI后HCAR1 KO细胞增殖不足的原因。为在蛋白水平上验证转录组结果,选择两个表达差异的Cyclin D2和B1进行Western blot验证。结果显示,HCAR1 KO中Cyclin D2蛋白水平仅为WT的67%,B1水平无统计学差异(Figure 5F-H)。因此,HI后HCAR1 KO细胞周期基因转录的降低在一定程度上可以在蛋白水平上得到证实。
与WY小鼠比较,HCAR1 KO同侧半球补体和凝血级联(complement and coagulation cascade)通路下调(Figure 5B and D)。有趣的是,补体系统参与了小胶质细胞的激活,所以HCAR1 KO中小胶质细胞的反应减弱可能是上述小胶质细胞激活下降的原因。与WT组比较,HI后HCAR1 KO中大量的小胶质细胞激活标记物也显著下调(Figure 5E),这再次支持了该猜想。
总之,HCAR1 KO小鼠的SVZ区域对HI表现出强烈的转录反应受损。这可以解释HI后细胞增殖和小胶质细胞活化受损,提示HCAR1是缺血后组织修复的关键转录调控因子。
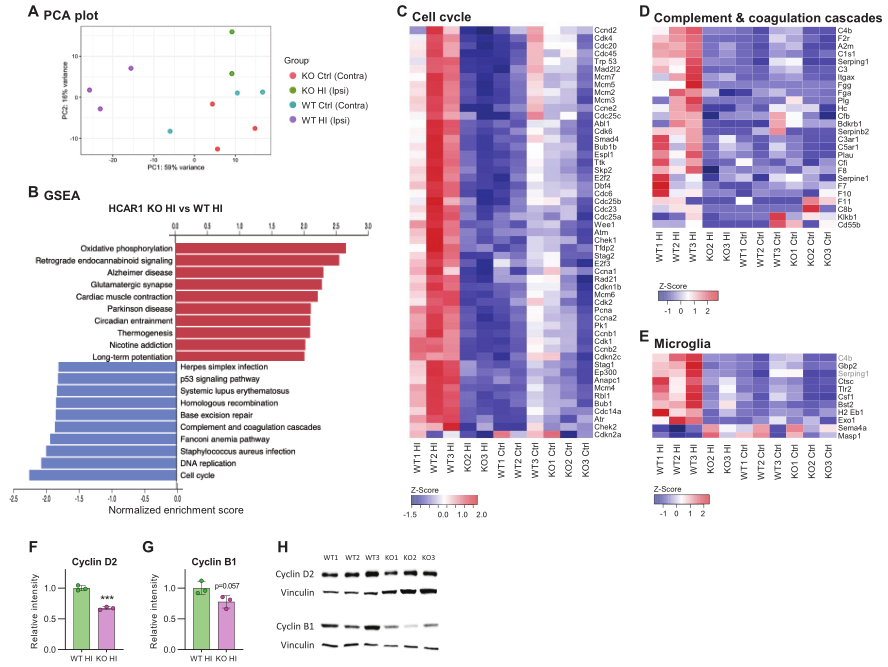
图5 HCAR1调控缺血的转录反应,包括细胞周期和补体通路
参考文献:
Kennedy Lauritz., Glesaaen Emilie R., Palibrk Vuk., Pannone Marco., Wang Wei., Al-Jabri Ali., Suganthan Rajikala., Meyer Niklas., Austbø Marie Landa., Lin Xiaolin., Bergersen Linda H., Bjørås Magnar., Rinholm Johanne E.(2022). Lactate receptor HCAR1 regulates neurogenesis and microglia activation after neonatal hypoxia-ischemia. Elife, 11(undefined), undefined. doi:10.7554/eLife.76451






