缺氧诱导外泌体circPDK1通过调控miR-628-3p/BPTF轴和降解BIN1激活c-myc以促进胰腺癌糖酵解
circRNA已被证实在多种肿瘤的发生发展中发挥关键作用,然而,缺氧诱导的外泌体circRNA在胰腺癌中的生物学功能和分子机制仍不清楚。近日,有研究发现CircPDK1在胰腺癌(PC)肿瘤组织和血清外泌体中高度丰富,并与不良生存相关。相关机制发现,HIF1A通过调控miR-628-3p/BPTF轴并降解BIN1在转录水平激活circPDK1。该研究发表于《Journal of Hematology & Oncology》,IF:14.136。
技术路线:
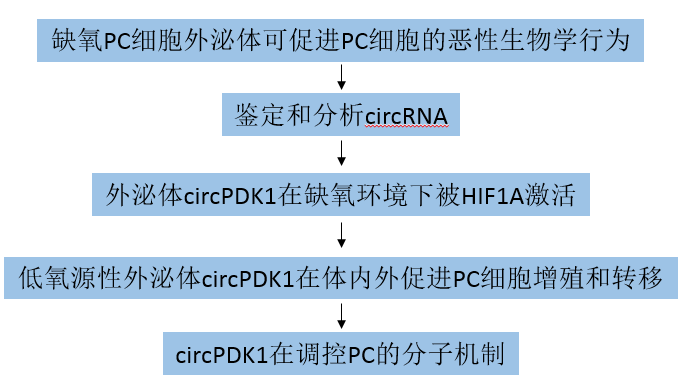
主要研究结果:
1. 体外培养的缺氧PC细胞外泌体可促进PC细胞的恶性生物学行为
缺氧是PC的重要特征,缺氧可增加缺氧PC细胞的外泌体的分泌。通过克隆形成实验、EdU实验、CCK-8实验和transwell实验检测常氧外泌体和缺氧外泌体处理后PC细胞的恶性生物学行为。结果表明,与PBS对照或常氧外泌体相比,缺氧PC细胞来源的外泌体显著改善MIA PaCa-2和PANC-1细胞的增殖和迁移(图S1E-H)。与常氧外泌体处理的PC细胞相比,低氧外泌体处理后E-cadherin被显著抑制。相反,N-cadherin和vimentin蛋白水平升高(图S1I)。这表明缺氧PC细胞来源的外泌体可以促进PC细胞的活力和迁移。
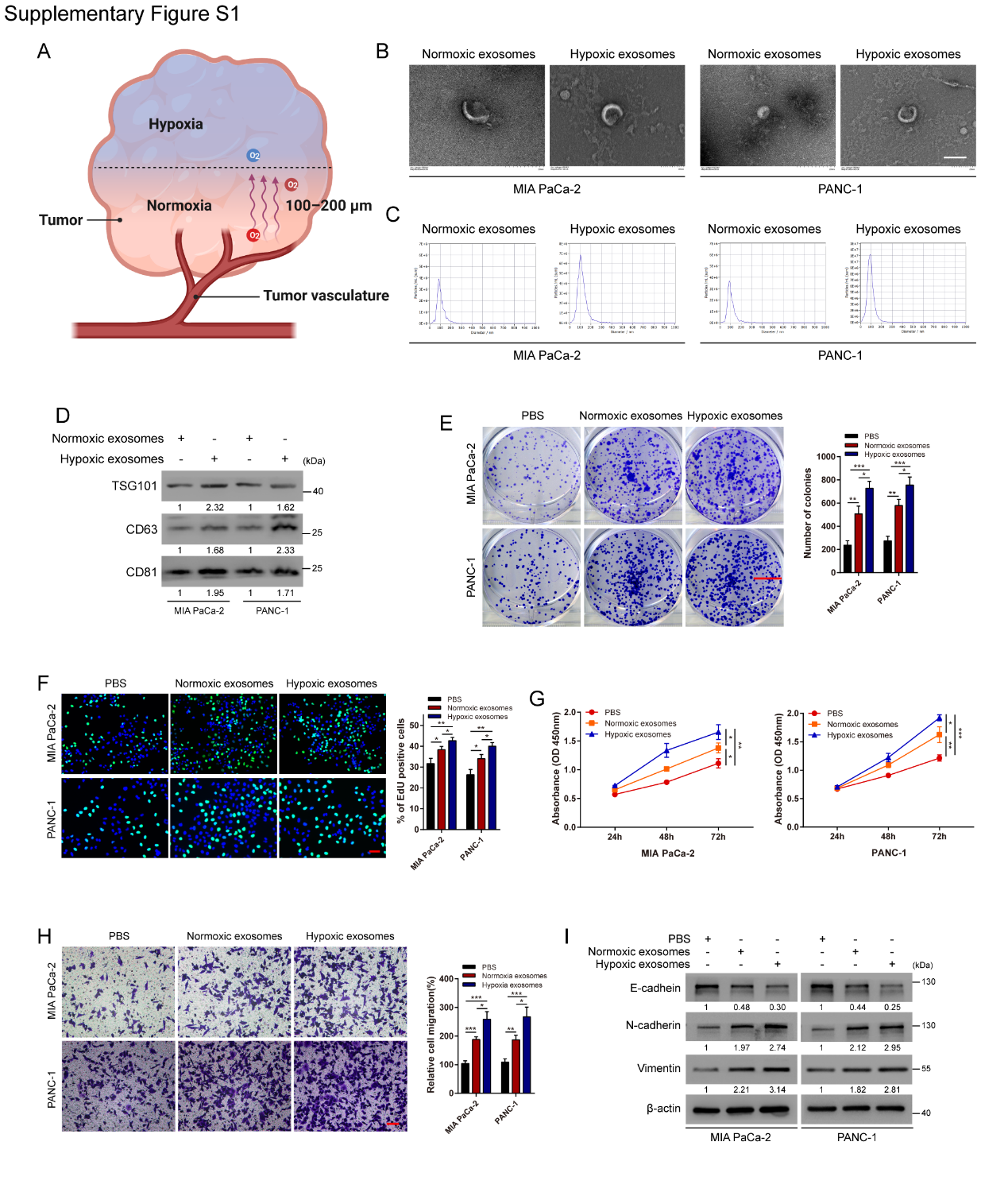
图S1体外培养的缺氧PC细胞外泌体可促进PC细胞的肿瘤发生
2. 通过RNA-seq鉴定缺氧PC细胞外泌体中的circRNA
circRNA在外泌体中大量稳定存在,是癌症的关键调控因子。为了阐明低氧诱导的外泌体环状RNA可能影响肿瘤发生的作用,使用RNA测序检测从常氧和低氧PC细胞中纯化的外泌体。在低氧外泌体和常氧外泌体之间共鉴定出78个差异表达的环状RNA(FC (fold change) ≥ 1.5, P < 0.05)(图1A,B)。
3. circPDK1在PC中高表达
用qRT-PCR分析正常组织和PC瘤组织中前5个上调和下调的环状RNA。结果发现circPDK1是PC中上调最多的circRNA(图1C)。然后,用组织芯片中进行ISH检测。结果显示,circPDK1在肿瘤组织中比在配对的正常组织中更丰富(图1D), circPDK1的高表达可能与病理阶段的晚期有关(图1E)。扩大临床样本检测,circPDK1在PC中显著上调,且与淋巴结转移、晚期病理分期和不良预后呈正相关(图1F-I)。CircRNA是血清外泌体中潜在的肿瘤标志物。在我们的结果中,来自血清外泌体的circPDK1在PC患者中大量表达,而在健康对照组中几乎不存在(图1J)。此外,血清外泌体中circPDK1的表达水平与PC肿瘤中一致(图1K),这使得检测血清样本中circPDK1的表达成为可能。综上所述,这些数据揭示了circPDK1在PC肿瘤组织中显著上调,并可在血清外泌体中稳定传递和富集。此外,circPDK1的高表达与PC的不良预后相关,这使其成为一种潜在的有前途的早期诊断PC的生物标志物。
4. circPDK1在PC细胞中的表达
从PDK1的第7 ~ 10外显子中获得circPDK1 (hsa_circRNA_102854, has_circ_0057104, chr2: 173433468-173457776),长度为401 nt。通过Sanger测序验证circPDK1的后剪接位点(图1L)。通过PCR分析,circPDK1的差异引物可以从cDNA而不是gDNA中扩增出来 (图1M)。与线性PDK1 mRNA相比,RNase R或放线菌素D处理表明circPDK1在PC细胞中是稳定的(图1N, O)。亚细胞分离和FISH检测结果表明,circPDK1主要定位于细胞质(图1P, Q)。总之,这些结果表明,circPDK1在PC中是一个丰富的、稳定表达的细胞质circRNA。
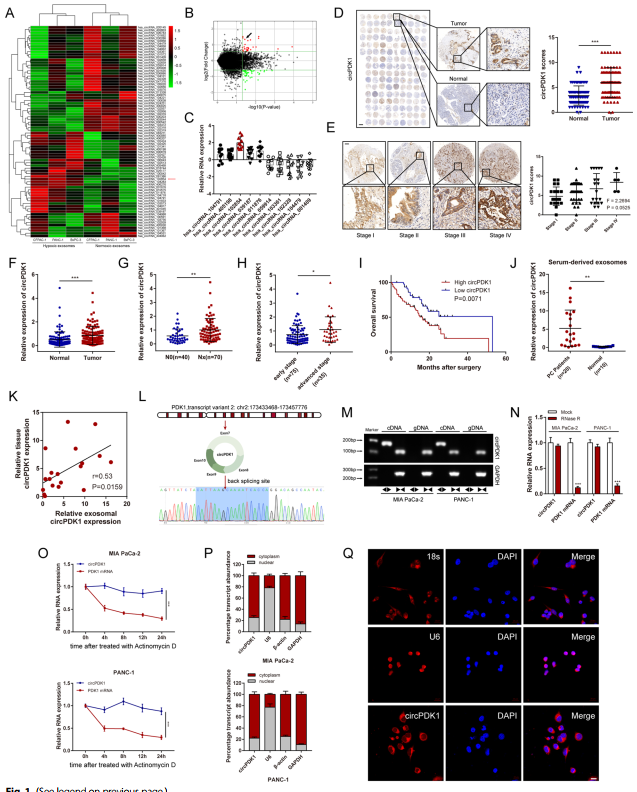
图1 circPDK1作为PC的外泌体生物标志物的鉴定和circPDK1的特征
5. 外泌体circPDK1在缺氧环境下被HIF1A激活
研究表明,在缺氧条件下,大量的circRNA被HIF1A转录激活,其宿主线性基因将由相同的pre-mRNA产生。在本研究中,circPDK1表达水平与其宿主线性基因PDK1表达水平呈正相关(图2A)。此外,circPDK1的表达在7个PC细胞系中无显著性差异(图2B)。在缺氧期间,circPDK1的表达水平在细胞和外泌体中均以时间依赖性方式显著过表达(图2C, D)。qRT-PCR和IHC证实circPDK1表达与HIF1A表达呈正相关,HIF1A蛋白水平在PC中上调(图2E-G)。利用启动子序列分析工具,在circPDK1启动子区域的宿主基因中验证了两个潜在的缺氧反应元件(HREs) (图2H)。双荧光素酶报告实验证实,在含有两个单独野生型HREs的报告基因中,荧光素酶活性增强,而含有突变型HREs的报告基因对缺氧或HIF1A敲除无反应(图2I)。此外,ChIP分析表明,HIF1A可以直接与PDK1启动子区结合,并在低氧条件下增强宿主基因PDK1的转录(图2J)。此外,敲低HIF1A可显著抑制缺氧诱导的细胞内和外泌体circPDK1的丰度(图2K-M)。ChIP实验结果也验证了低氧条件下RNA聚合酶II与宿主基因PDK1启动子位点的结合增强,进一步验证了circPDK1在低氧条件下可被激活(图2N)。此外,ActD处理可部分抑制缺氧外泌体培养的PC细胞中circPDK1的表达水平,且缺氧条件下PC细胞中circPDK1的稳定性不受影响(图2O)。总之,这些结果表明,缺氧外泌体中circPDK1的上调部分是由于HIF1A的激活。
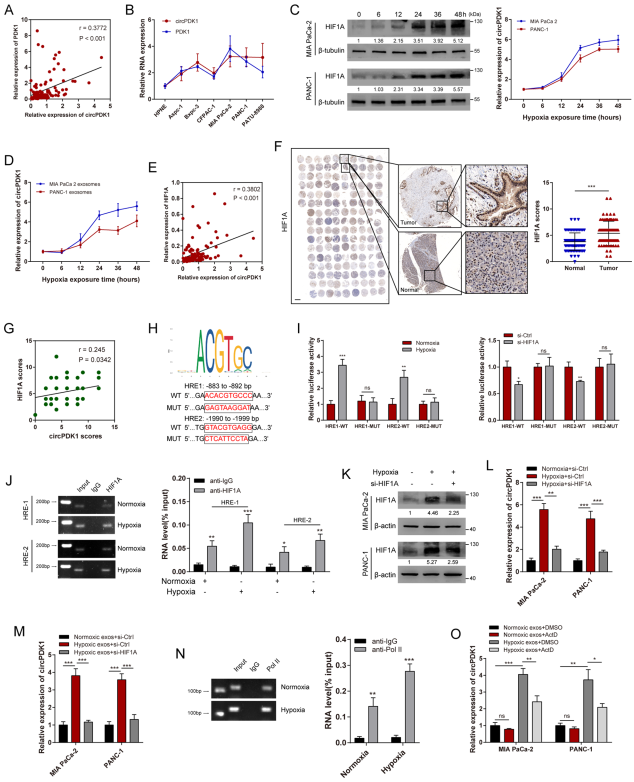
图2低氧条件下外泌体circPDK1被HIF1A激活
6. 低氧源性外泌体circPDK1在体内外促进PC细胞增殖和转移
为了阐明缺氧来源外泌体circPDK1在PC中的作用,分离MIA PaCa-2和PANC-1细胞来源的不同丰度circPDK1外泌体,并与相应的供体细胞共培养,包括4个实验组:常氧外泌体、缺氧外泌体、缺氧NC外泌体和缺氧sh1-circPDK1外泌体。克隆形成实验、EdU实验、CCK-8实验和transwell实验检测缺氧诱导的外泌体对常氧PC细胞增殖和迁移的影响。结果表明,缺氧外泌体处理的PC细胞活力和迁移能力增强,而在缺氧外泌体中清除circPDK1后,这种促进增殖和迁移的现象将消失(图3A-D)。此外,Western blot结果显示,与缺氧sh1-circPDK1外泌体相比,低氧NC外泌体处理后的PC细胞E-cadherin明显受到抑制。相反,与缺氧sh1-circPDK1外泌体处理相比,缺氧NC外泌体处理的PC细胞N-cadherin和vimentin显著上调(图3E)。
小鼠异种移植瘤模型实验表明,缺氧NC外泌体增加了异种移植肿瘤的体积和重量,而缺氧sh1-circPDK1外泌体消除了缺氧外泌体,从而加速了肿瘤的生长(图3F-H)。各组裸鼠体重无明显差异(图3I)。在肺转移模型中,缺氧sh1-circPDK1外泌体组肺转移结节数量低于乏氧NC组(图3J)。免疫组织化学染色显示,缺氧sh1-circPDK1外泌体组PCNA和vimentin表达降低,而N-cadherin表达升高(图3K)。这些发现与体外实验结果一致,表明缺氧诱导的外泌体circPDK1也可以促进PC细胞体内肿瘤的生长和转移。

图3缺氧源性外泌体circPDK1促进PC细胞在体外和体内增殖和转移
7. circPDK1在PC中起miR-628-3p海绵的作用
细胞质circRNA通过竞争性海绵化miRNA发挥ceRNA的功能。circinteractome在线数据库证实circPDK1可能与AGO2结合(图4A)。RIP实验验证了circPDK1富集于含AGO2的微核糖核蛋白复合物(图4B)。因此,通过miRNA测序来筛选对照组和过表达circPDK1组之间潜在的差异表达的miRNA,同时也检测了circPDK1过表达的效率(图4C)。途径富集分析显示,差异表达的miRNAs富集于泛素介导的蛋白水解、PI3K-AKT signaling pathway和HIF-1signaling pathway等(图4D)。随机选取7个被抑制的miRNA,进行qRT-PCR,结果发现miR-628-3p在过表了circPDK1的MIA PaCa-2细胞中被显著抑制(图4E)。RIP检测也表明miR-628-3p可以与AGO2结合(图4F)。在TCGA数据和临床数据,miR-628-3p在PC肿瘤中显著被抑制,并且与circPDK1表达呈负相关(图4H)。此外,miR-628-3p低表达与不良预后相关(图4I)。circRNA可直接与RNA聚合酶II结合,激活亲本基因的转录。在本研究中, circPDK1不调节miR-628-3p的启动子活性或pri-miRNA和pre-miRNA的表达(图4J)。在MIA PaCa-2和PANC-1细胞中,circPDK1过表达后miR-628-3p下调,而sh1-circPDK1组miR-628-3p上调(图4K)。双荧光素酶报告结果显示miR-628-3p直接与circPDK1结合(图4L)。这些结果表明,circPDK1可能与miR-628-3p相互作用,从而在PC细胞中作为miR-628-3p的ceRNA海绵发挥作用。
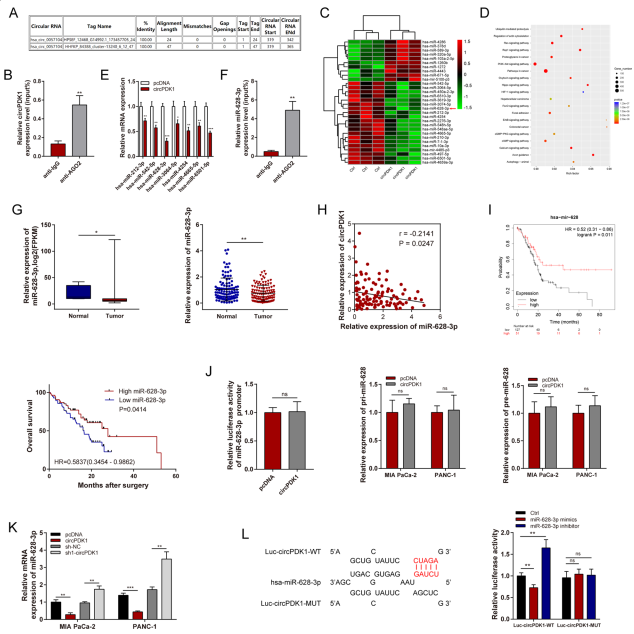
图4 circPDK1在PC中作为miR-628-3p海绵的作用
8. circPDK1作为ceRNA在PC中协调BPTF的表达
miR-628-3p在胰腺癌中的潜在功能和作用机制尚不清楚。利用mirDIP、RNAInter、miRDB、miRTarBase和TargetScan数据库,预测到BPTF、PURA、RBFOX2和ARSJ是miR-628-3p的潜在下游靶点(图5A)。TCGA的数据验证了潜在下游靶点与miR-628-3p表达之间的相关性。结果表明,BPTF的表达与miR-628-3p呈负相关,而PURA、RBFOX2和ARSJ的表达与miR-628-3p无关(图5B)。circPDK1缺失后的RNA测序结果显示172个差异表达的circRNA,包括135个上调和37个下调的蛋白编码基因。BPTF被列为显著下调的蛋白编码基因之一(图5C)。基因集富集分析确定了c-myc通路与circPDK1之间的显著相关性(图5 D)。临床数据证实了BPTF和miR-628-3p之间的负相关(图5E)。在MIA PaCa-2和PANC-1细胞中转染miR-628-3p模拟物后BPTF的mRNA表达水平降低,而转染miR-628-3p抑制物后BPTF的mRNA表达水平升高(图5F)。双荧光素酶报告实验显示,miR-628-3p可与BPTF的3ʹ-UTR结合(图5G)。因此,BPTF是miR-628-3p的功能性靶基因。此外,PC中BPTF表达水平与circPDK1表达水平呈正相关(图5H)。过表达circPDK1显著激活BPTF-c-myc轴并调节c-myc下游靶点CCND1和p21,而转染miR-628-3p模拟物可消除这一作用。通过转染miR-628-3p抑制剂,BPTF-c-myc轴的失活和circPDK1敲低诱导的两个c-myc下游靶点的调节也被消除(图5I, J)。使用双荧光素酶报告实验也获得了相同的结果(图5K)。综上所述,circPDK1作为ceRNA从海绵化的BPTF mRNA与miR-628-3p结合,从而从miR-628-3p的抑制作用中释放BPTF。

图5 circPDK1作为ceRNA调节PC中BPTF的表达
9. circPDK1与BIN1相互作用,增强BIN1的泛素化
RNA pull-down和免疫沉淀实验证实,作为miRNA海绵的对照circRNA(ciRS-7)不会与BIN1结合(图6A)。此外,FISH分析显示circPDK1在细胞质中与BIN1共定位(图6B)。circPDK1调节BIN1蛋白水平 (图6C)。此外,circPDK1的表达导致BIN1蛋白水平降低,这可以通过蛋白酶体抑制剂(MG132)恢复(图6D)。经环己酰亚胺(CHX)处理后,BIN1在过表达circPDK1的PC细胞中具有较短的半衰期,而在下调circPDK1的PC细胞中具有较长的半衰期(图6E)。为了研究与BIN1相互作用的circPDK1区域,对circPDK1的进行不同截断,随后RIP证实截断3和4与BIN1相互作用(图6F)。基于生物信息学在线数据库catRAPID,对截断3和4中预测的两个潜在结合位点进行突变(图6G)。此外,circPDK1突变降低了circPDK1和BIN1之间的相互作用(图6H, I)。这表明,在PC细胞中,circPDK1- wt与BIN1在截短3和4存在相互作用,而circPDK1- mut不存在相互作用。circPDK1-MUT在mRNA或蛋白水平均不影响BIN1(图6J)。过表达circPDK1显著增强BIN1的泛素化水平,但这一作用被突变消除(图6K)。进一步利用ARES精确构建与circPDK1相互作用的BIN1区域的三维结构。分析结果显示,circPDK1只能在BAR结构域区域与BIN1结合,这与catRAPID一致(图6L)。RNA pull-down实验结果表明,缺失BIN1的29-276 aa区(BAR结构域)会消除其与circPDK1的相互作用(图6M)。免疫组织化学结果也显示,胰腺癌组织中BIN1蛋白水平下调,并且与组织芯片中的circPDK1呈负相关(图6N, O)。综上所述,这些数据表明,circPDK1可能通过与BIN1的BAR结构域相互作用来调节BIN1的稳定性,从而促进其泛素依赖性降解。
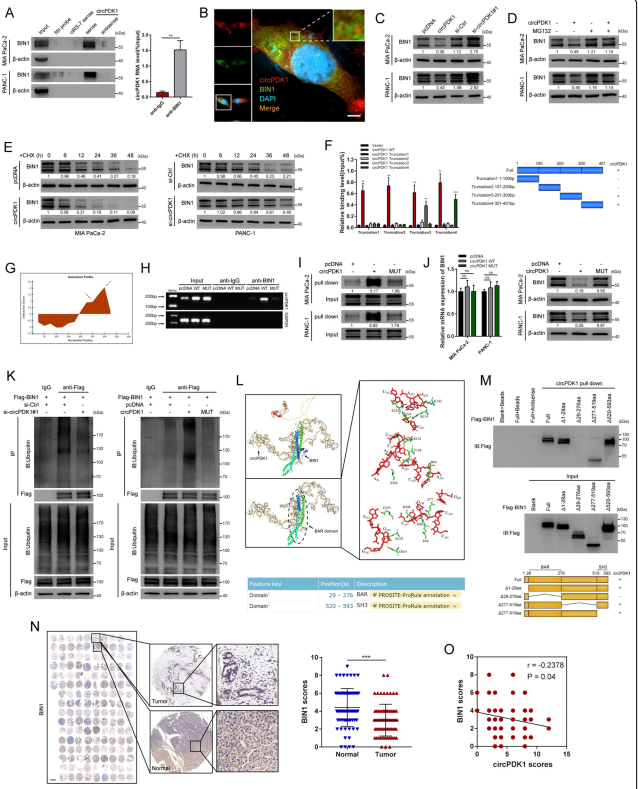
图6 circPDK1与BIN1相互作用,增强BIN1的泛素化
10. circPDK1作为一个支架,增强了BIN1蛋白与UBE2O的结合
UBE2O一种泛素结合酶,它同时显示了E2泛素结合酶和E3泛素连接酶的活性。RNA pull-down和RIP确认了circPDK1与UBE2O之间的相互作用,而ciRS-7不会与UBE2O结合(图7A)。免疫共沉淀(Co-IP)结果显示UBE2O与BIN1结合(图7B)。FISH和IF表明,circPDK1、UBE2O和BIN1主要在细胞质中共定位(图7C)。qRT-PCR结果显示,UBE2O不影响BIN1和circPDK1的RNA水平,但UBE2O下调后BIN1蛋白水平明显升高(图7D)。此外,circPDK1的缺失显著减弱了UBE2O对BIN1泛素化和降解的影响(图7E, F)。Co-IP结果表明,转染circPDK1-WT的MIA PaCa-2 PC细胞中UBE2O与BIN1的相互作用增强,而转染circPDK1-MUT的MIA PaCa-2 PC细胞中UBE2O与BIN1的相互作用没有增强。此外,当用RNase A处理时,UBE2O和BIN1之间的结合被严重破坏,而用RNase R处理时,UBE2O和BIN1之间的结合没有被破坏(图7G)。由于circRNA对RNase R具有耐药性,因此会被RNase a降解。IHC实验还发现PC组织中UBE2O蛋白水平升高,且与BIN1呈负相关(图7H, I)。总的来说,circPDK1可以作为支架,增强UBE2O与BIN1的结合,从而促进UBE2O对BIN1泛素化和降解的影响。随后作者进行了回复实验,证明circPDK1部分通过作为UBE2O和BIN1之间的支架来增强BIN1的降解,从而发挥致癌作用。
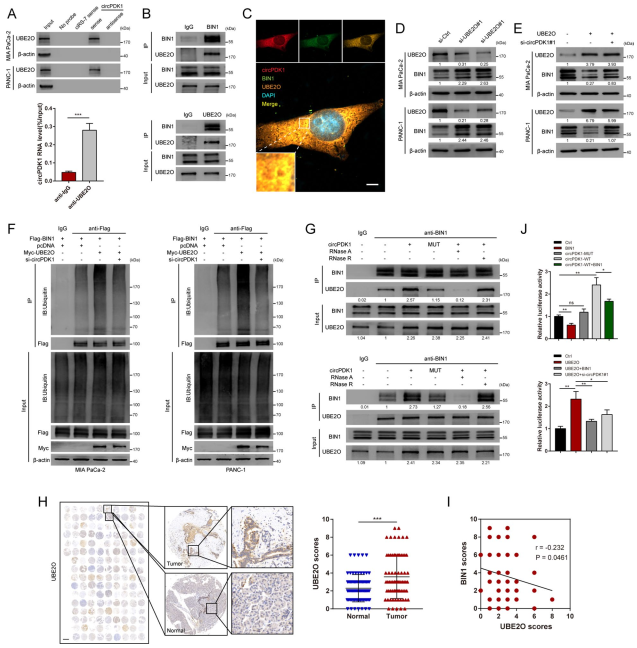
图7 circPDK1作为一个支架,增强了BIN1蛋白与UBE2O的结合
BIN1是一个肿瘤抑制因子,它与c-myc相互作用,从而限制c-myc的转录活性。双荧光素酶报告实验表明,转染circPDK1-WT后,c-myc应答的转录报告基因荧光素酶活性明显增加,而转染circPDK1-MUT后,c-myc应答的转录报告基因荧光素酶活性无明显增加,这种增加被BIN1部分阻断。BIN1过表达和circPDK1缺失消除了UBE2O增加的荧光素酶活性(图7J)。综上所述,circPDK1和UBE2O可以通过降解BIN1蛋白来激活c-myc转录活性。此外,BIN1和UBE2O不影响miR-628-3p或BPTF表达(图S13A-C)。同时,miR-628-3p或BPTF不能在RNA或蛋白水平调控BIN1或UBE2O(图S13D-E),表明circPDK1可以通过两个互不干扰的轴激活c-myc。
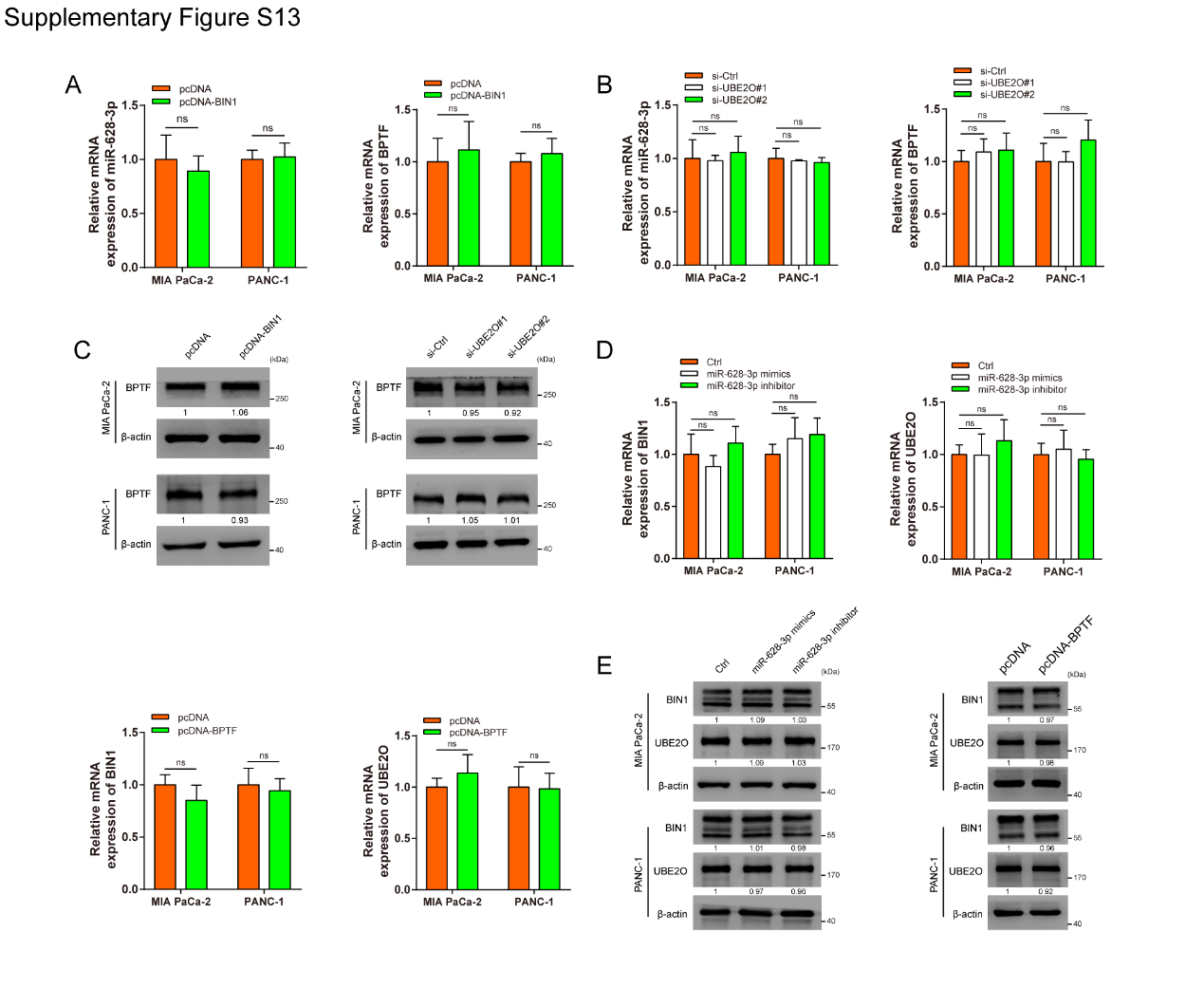
图S13 circPDK1通过两个非干扰轴激活c-myc
12. circPDK1通过c-myc激活促进有氧糖酵解
c-myc作为circPDK1介导的两个轴的共同靶点,通过直接激活多种靶点糖酵解基因来满足快速增殖和转移的需求,是Warburg效应的关键介导者。qRT-PCR和Western blotting结果表明,circPDK1的缺失显著抑制了这些糖酵解基因的表达(图8A, B)。乳酸生成、ATP生成和葡萄糖摄取可以通过circPDK1的缺失来降低(图8C-F),以及细胞外酸化速率和氧消耗速率 (图8G, H)。PET-CT扫描显示,circPDK1的缺失会显著抑制小鼠皮下肿瘤的葡萄糖代谢(图8I)。综上所述,c-myc介导了circPDK1在糖酵解中的功能。
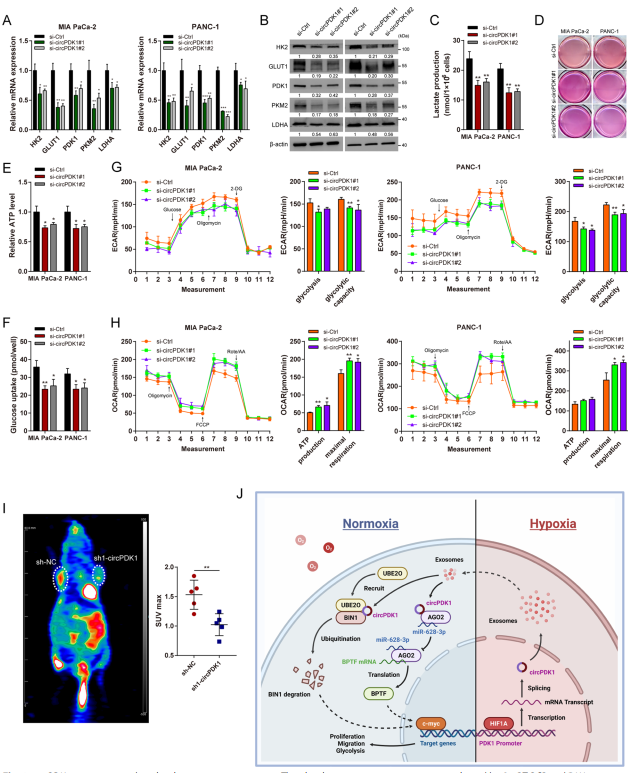
图8 circPDK1通过c-myc激活促进好氧糖酵解
结论:
circPDK1在缺氧PC细胞来源的外泌体中高度富集。circPDK1在胰腺癌患者和血清外泌体中表达上调,且circPDK1高表达与患者不良预后相关。此外,外泌体circPDK1通过增强生长,转移和糖酵解在胰腺癌中发挥促进肿瘤的作用。HIF1A通过激活宿主基因PDK1上调circPDK1, circPDK1通过调控miR-628-3p/BPTF轴并降解BIN1激活c-myc。因此,该研究显示了circPDK1-c-myc轴促进PC进展的模型机制(图8J),为circRNA/miRNA/mRNA和circRNA-RBP相互作用的多样性提供了新的见解,并强调了其作为胰腺癌生物标志物和治疗靶点的潜在用途。






