褪黑激素改善帕金森病
帕金森病(PD)的一个重要病理生理成分是昼夜节律紊乱,与循环褪黑激素(MLT)水平下降密切相关。近年来有报道称维甲酸相关孤核受体(RORα)是MLT潜在的内源性配体,在多种疾病中发挥着重要作用。然而,RORα在神经退行性疾病发病机制中的作用尚不清楚。在这里,我们通过一个细胞PD模型显示,在MPP+处理的BV2细胞中,RORα表达下调,而MLT处理后上调。在MPTP诱导的小鼠模型中,中脑组织中RORα水平降低,MLT处理显著提高了RORα水平,保护了多巴胺神经元。此外,siRNA介导的下调暗示了STAT通路的参与。总之,MLT通过抑制STAT相关的小胶质细胞的促炎极化来改善神经炎症,为PD的神经保护治疗提供了替代方案。本文于2022年7月发表于“NPJ Parkinson’s Disease”(IF=9.304)上。
技术路线

结果
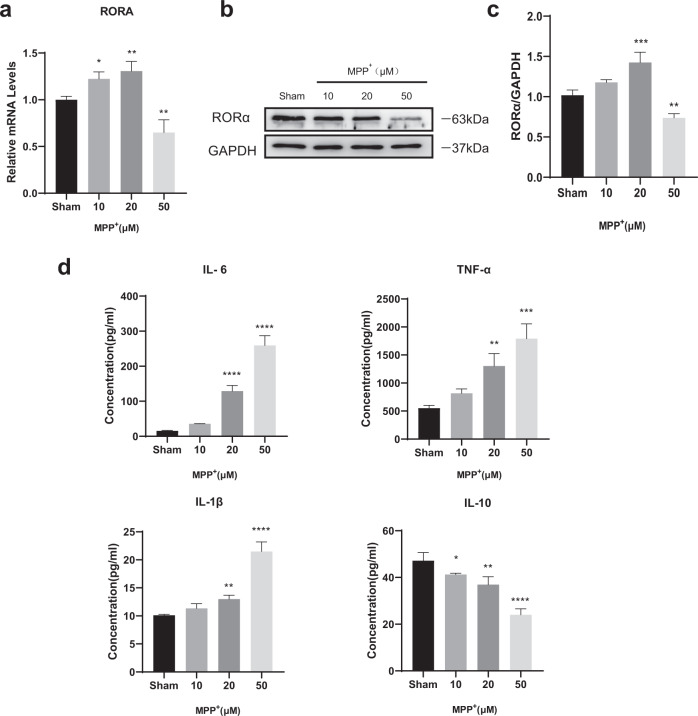
1)RORα在MPP+处理的BV2细胞中表达下调
为探讨RORα是否参与PD的炎症过程,我们首先研究了不同浓度(0-100 μM)的MPP+对BV2细胞的生物学作用。结果显示50 μM MPP+诱导的BV2细胞活力下降25-30%(补充图,未展示)。RT-qPCR和WB分析显示,MPP+-处理的BV2细胞中,低剂量(10和20 μM) MPP+处理后,RORα的表达增加,但在高剂量(50 μM)时显著降低(图1a-c)。我们还观察到,随着MPP+浓度的增加,促炎因子(TNF-α、IL-6、IL-1β)逐渐增加,而IL-10等抗炎因子逐渐减少(图1d)。RORα表达的改变与细胞因子水平的改变提示RORα在PD中具有抗炎症作用。
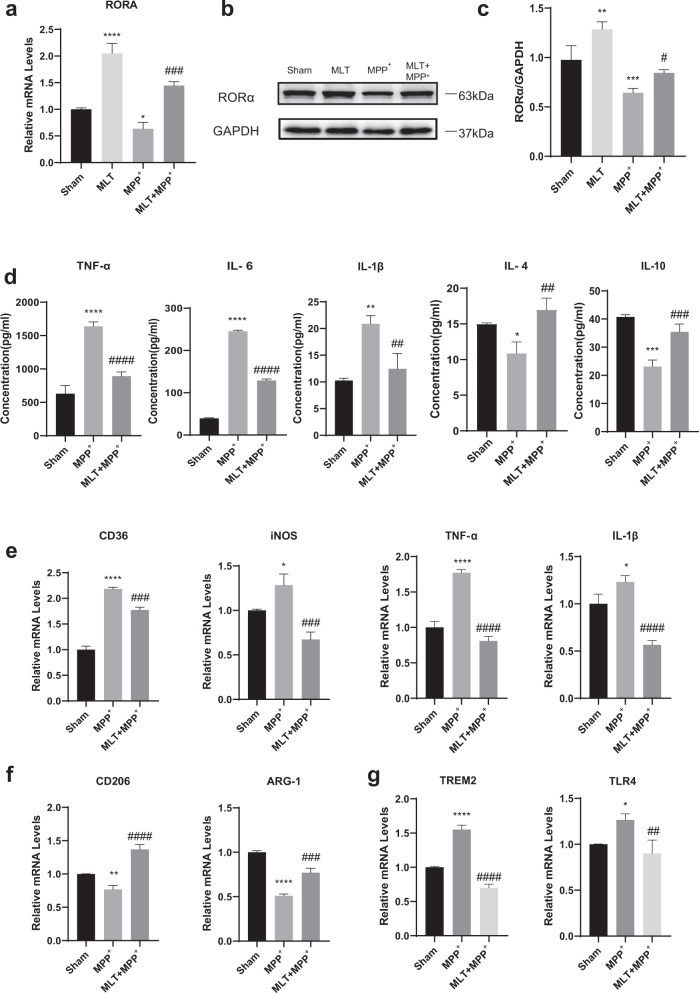
2) MLT在体外增加RORα表达,抑制促炎性M1样小胶质细胞极化,减少神经炎症
我们探索了MLT对MPP+处理的BV2细胞的潜在抗炎机制。RT-qPCR和WB分析表明,MLT(50μM)完全逆转了MPP+在50μM时诱导的RORα的降低,尽管最终水平低于单独使用MLT(图2a-c)。同时,ELISA检测到MLT处理后抗炎细胞因子IL-4和IL-10水平升高,促炎细胞因子(IL-1β、TNF-α和IL-6)浓度显著降低(图2d),进一步证实了MLT在MPP+处理的BV2细胞中的抗炎作用。此外,在PD的进展过程中,小胶质细胞极化在神经炎症发病机制中起着重要作用。因此,我们进一步分析了MLT对细胞模型中小胶质细胞分化的影响。在应用MPP+前半小时应用MLT,并在药物干预后24小时通过RT-qPCR测量极化标志物。结果表明,MLT治疗降低了促炎分子(如iNOS、CD36、IL-1β、TNF-α)以及DAM表型因子如TREM2和TLR4的基因表达,但增加了抗炎M2样标记物CD206和ARG-1的表达(图2e-g)。这些结果表明,RORα通过减少小胶质细胞中促炎性M1和DAM表型标记物的表达,在MLT的抗炎作用中发挥作用。
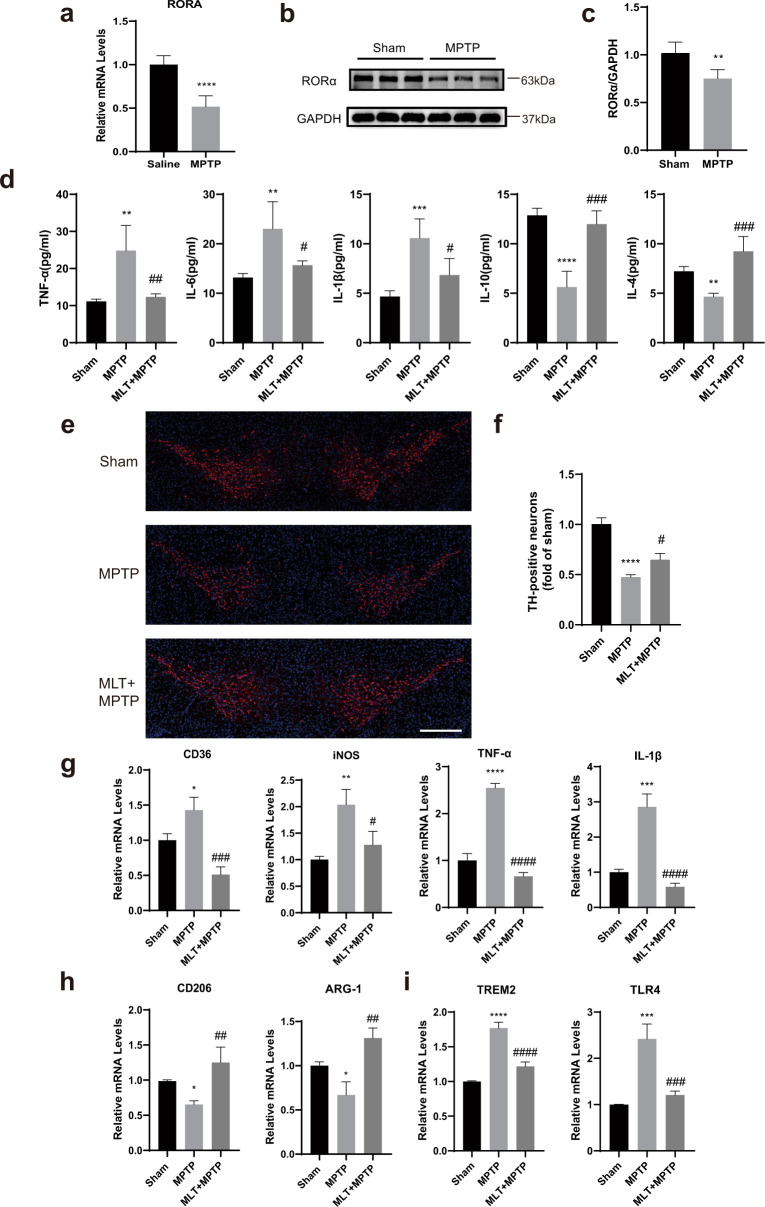
3)MPTP处理的小鼠中RORα表达降低,且MLT显示出减轻MPTP的抗炎作用
为了研究RORα与体内PD之间的关系,我们使用MPTP诱导的PD小鼠模型。与体外结果一致,MPTP处理的小鼠的中脑组织RORα水平下调(图3a-c)。为了探讨MLT在体内是否具有相同的抗炎作用,在MPTP注射前半小时注射MLT。我们观察到,与对照组相比,MLT治疗组的小鼠在运动功能方面表现更好(未展示)。MLT治疗后,炎症因子(包括IL-6、IL-1β、TNF-α)的血清水平降低,而抗炎因子(如IL-4和IL-10)显著增加(图3d)。此外,免疫荧光显示MLT处理可防止TH阳性细胞在SNc中丢失(图3e,f)。这些结果表明,MLT对DA神经元具有抗炎和保护作用,从而改善MPTP诱导的小鼠模型的运动症状。
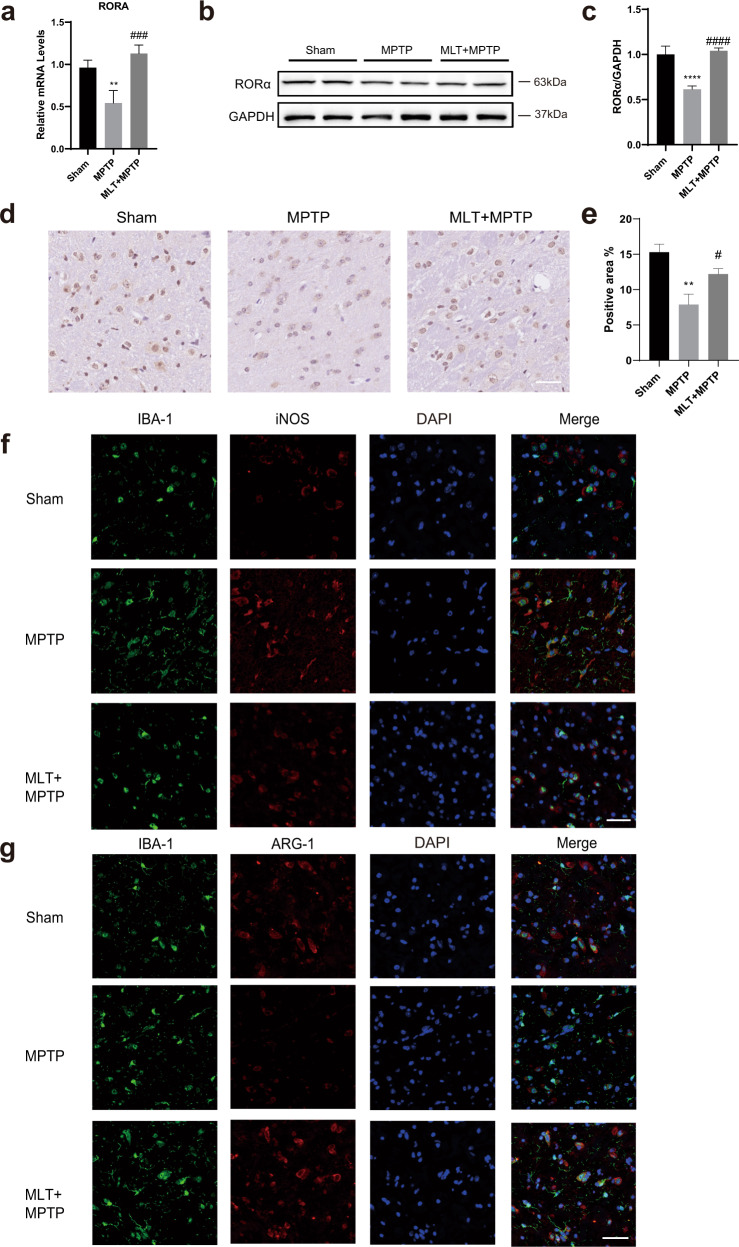
4)MLT增加MPTP处理小鼠的RORα水平,并降低促炎和DAM相关基因表达
我们观察到,MLT治疗显著增加了中脑组织的RORα水平(图4a-c)。RORα的免疫组织化学染色图像显示了类似的结果(图4d,e),表明MLT的作用可能与RORα有关。此外,我们研究了MLT是否能改变MPTP诱导的小鼠的小胶质细胞表型。MPTP和MLT+MPTP处理组的小胶质细胞均因IBA-1的增加而激活。RT-qPCR检测发现,促炎M1样和DAM表型标记物减少,而抗炎M2样表型分子增加(图3g-i)。类似地,MLT处理组中IBA1+iNOS+细胞的荧光强度小于MPTP组,而MLT+MPTP组中IBA1+ARG-1+细胞的荧光强度高于MPTP组(图4f,g)。总之,MLT处理通过下调促炎和DAM相关分子改变了小胶质细胞表型。
5)RORα缺失促进小胶质细胞促炎表型极化,加重神经炎症
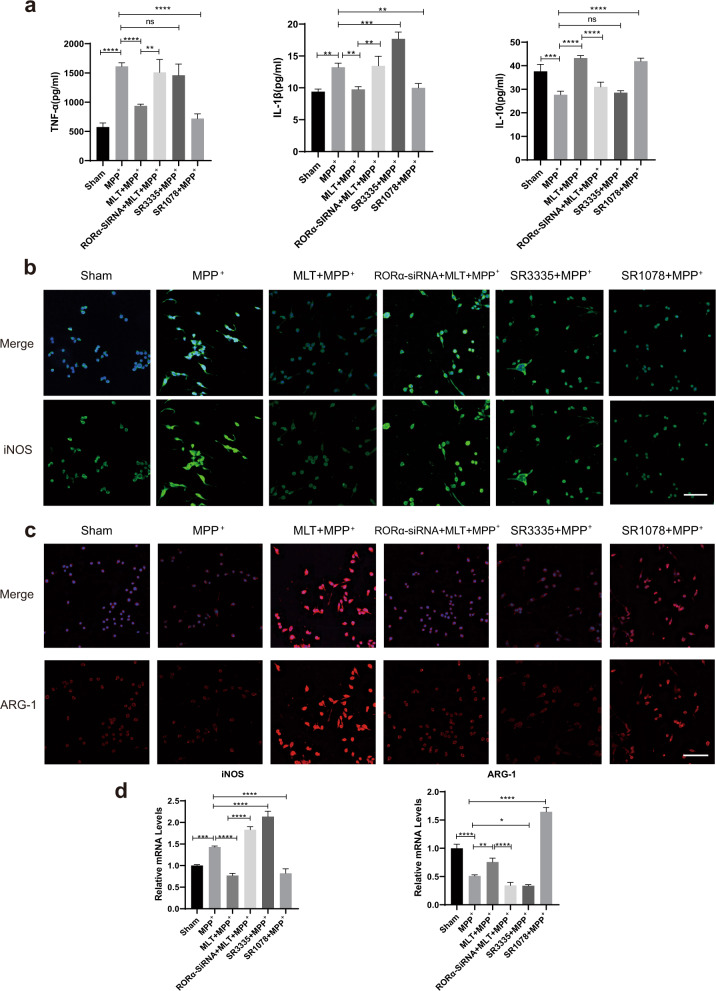
据报道,RORα可在多种疾病中发挥抗炎作用。为了验证RORα在MLT对MPP+处理的BV2细胞的影响中是否发挥了类似的作用,我们进一步确定了RORα缺失对小胶质细胞极化和炎症的分子效应。SiRNA用于敲除RORα。此外,在MPP+干预前,我们还使用了SR3335,一种合成的RORα选择性逆激动剂,和SR1078,一种合成的RORα激动剂。在蛋白质水平上,与MPP+处理组相比,MLT和SR1078处理组均显示出抗炎作用。然而,SR3335并未增加MPP+处理细胞中TNF-α的水平或降低IL-10的水平。更重要的是,与MLT+MPP+的非沉默组相比,RORα敲除增加了培养基中促炎因子(TNF-α和IL-1β)的水平,并降低了抗炎因子(IL-10)(图5a)。同时,免疫荧光图像显示的iNOS的上调和ARG-1的下调也表明,BV2细胞中的RORα缺失可增强促炎极化(图5b,c)。在mRNA水平上,RT-qPCR显示出一致的结果,但MLT处理细胞组中ARG1表达除外。MLT+MPP+处理的细胞显示免疫染色强度增加,但ARG-1的mRNA减少(图5d)。这些结果表明RORα参与了MLT的抗炎作用。
6)MLT通过STAT的RORα依赖的信号通路调节小胶质细胞极化
据报道,MLT的抗炎作用与STAT通路的激活有关。为了进一步探索与MPP+诱导的神经炎症和MLT介导的抗炎相关的信号通路,我们检测了关键信号分子STAT的表达和磷酸化,尤其是STAT1和STAT3。结果表明,在MPP+刺激的BV2s中,p-STAT1的表达增加,而p-STAT3的表达显著降低。MLT预处理抑制p-STAT1的表达,但激活STAT3磷酸化。为了验证RORα是否参与MLT对STAT通路的影响,使用siRNA来敲除RORα。与没有RORα-siRNA的细胞组相比,RORα的缺乏显著降低了p-STAT3的水平,但增加了MLT预处理引起的STAT1的磷酸化(图6a,b)。这些结果表明MLT通过RORα-STATs途径介导小胶质细胞的表型变化。
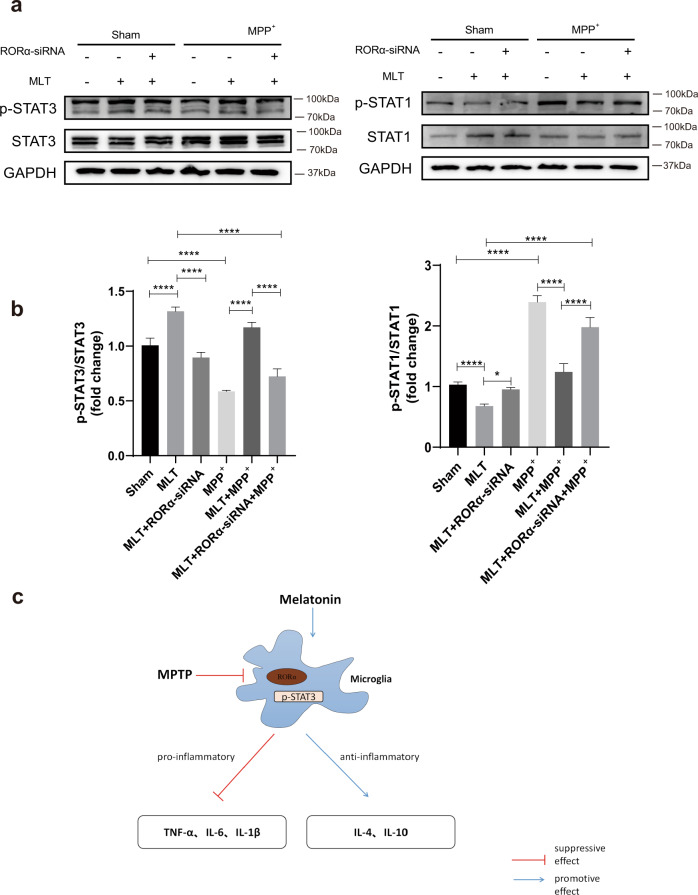
结论:本研究证明MLT通过改变小胶质细胞的表型标志物减轻神经炎症。MLT调节小胶质细胞向抗炎表型转变,且RORα在小胶质细胞极化的调节中发挥关键作用。该发现指出了MLT-RORα轴的有益作用,其可减少炎症反应并改善PD。
参考文献:
Li J, Liu H, Wang X, Xia Y, Huang J, Wang T, Lin Z, Xiong N. Melatonin ameliorates Parkinson's disease via regulating microglia polarization in a RORα-dependent pathway. NPJ Parkinsons Dis. 2022 Jul 8;8(1):90. doi: 10.1038/s41531-022-00352-5.






