LncRNA MILIP促进透明细胞肾细胞癌的转移
远处转移是透明细胞肾细胞癌(ccRCC)相关死亡率的主要原因。然而,涉及ccRCC转移的分子机制仍有待充分了解。随着lncRNAs在癌症发展、进展和治疗耐药性中的作用越来越被重视,导致ccRCC发病机制的异常表达lncRNAs的列表正在迅速扩大。与原发ccRCC组织相比,转移性ccRCC中MILIP表达上调。转移性ccRCC细胞中MILIP表达增加是由TFAP2C驱动的。MILIP的敲低降低了ccRCC细胞在体外迁移和侵袭的潜能,并减少了ccRCC在体内转移病灶的形成。MILIP对ccRCC细胞的影响与EMT标志基因表达的改变有关。机制上,MILIP与Snai1 mRNA形成RNA-RNA双链,并与YBX1结合。这促进了YBX1蛋白和Snai1 mRNA之间的关联,导致后者的翻译增加。Snai1反过来在MILIP驱动的ccRCC转移中发挥重要作用。总之,TFAP2C响应的lncRNA MILIP驱动ccRCC转移。因此,靶向MILIP可能是ccRCC治疗的潜在途径。本文于2022年8月发表于Journal of Experimental & Clinical Cancer Research ( IF=12.658 )上。
技术路线

结果
1)TFAP2C驱动转移性ccRCCs中上调的MILIP表达
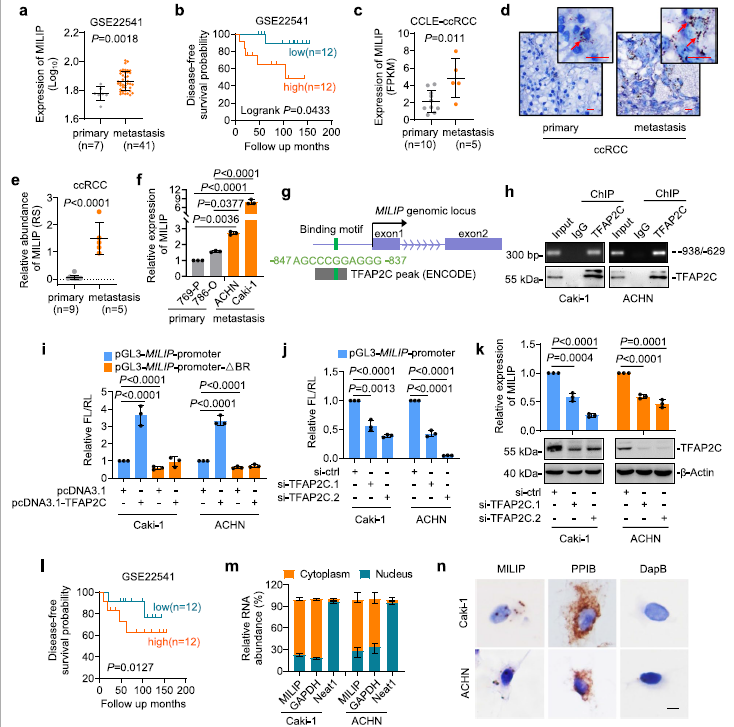
通过查询ccRCC数据集(GSE22541),我们发现,与原发肿瘤相比,转移病灶来源的ccRCC组织中lncRNA MILIP表达水平更高(图1a)。此外,MILIP高表达与ccRCC患者无病生存期(DFS)较差相关(图1b)。对CCLE的ccRCC细胞系数据集的分析显示,与原发肿瘤相比,转移性肿瘤产生的ccRCC细胞系中MILIP表达水平更高(图1c)。我们证实,在FFPE ccRCC样本队列中,与原发性ccRCC样本相比,转移性ccRCC中MILIP表达增加(图1d, e)。类似地,MILIP表达水平在转移性细胞系中更高(cki -1和ACHN) (图1f)。接着,为了了解在ccRCC细胞中调控MILIP表达的转录机制,我们使用生物信息学查询其启动子的转录因子结合位点。这揭示了位于 MILIP 基因启动子-837/-847 区域的转录因子 TFAP2C 的共有结合基序(图1g)。来自ENCODE的ChIP-seq数据分析显示,在TFAP2C结合区(TFAP2C-BR)有一个TFAP2C结合峰(图1g)。该区域与内源性TFAP2C共同沉淀,是MILIP转录上调所必需的(图1h, i)。此外,TFAP2C的敲除降低了Caki-1和ACHN细胞中MILIP的转录活性(图1j),支持MILIP 通过已识别的 TFAP2C-BR 被 TFAP2C 转录激活。为了证实这一点,TFAP2C的敲除降低了内源性MILIP水平(图1k)。此外,与MILIP的高表达一样,在GSE22541数据集中,TFAP2C的高表达与ccRCC患者较差的DFS相关(图1l)。通过qPCR分析和原位杂交(ISH)分析显示,MILIP主要位于ccRCC细胞的细胞质中(图1m, n)。
2)MILIP促进ccRCC转移
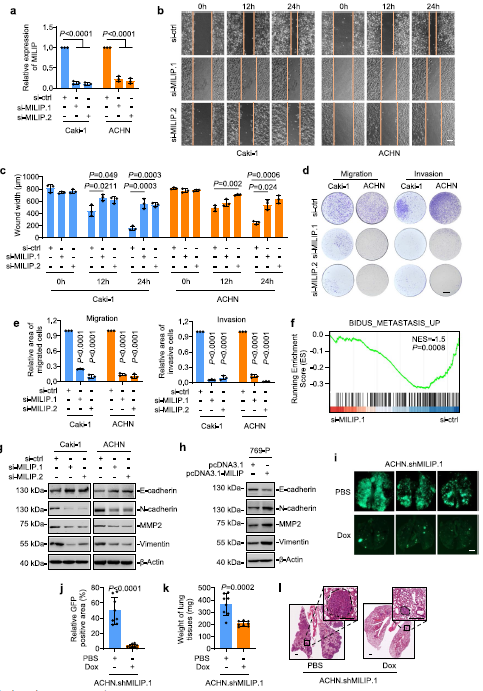
在发现MILIP在转移性ccRCC中特异性上调后,我们重点研究了MILIP对ccRCC细胞侵袭和转移的潜在作用。MILIP的敲除在划痕试验中显著延迟了Caki-1和ACHN细胞的伤口愈合,并在transwell试验中减少了它们的迁移和侵袭(图2a-e)。来自Caki-1细胞的RNA测序数据的GSEA显示MILIP敲除导致转移途径基因特征的减少(图2f)。此外,MILIP的敲低导致上皮标记物E-cadherin的上调以及间充质标记物N-cadherin、MMP2和波形蛋白的下调,而MILIP过表达导致E-cadherin的降低,N-cadherin、MMP2和波形蛋白的表达上调(图2g,h)。此外,shMILIP细胞显著减少了肺转移病灶的形成(图2i-l)。总之,这些结果表明MILIP促进ccRCC细胞的细胞侵袭和迁移,这与增强EMT有关。
3)MILIP与YBX1相互作用,促进Snai1的翻译激活
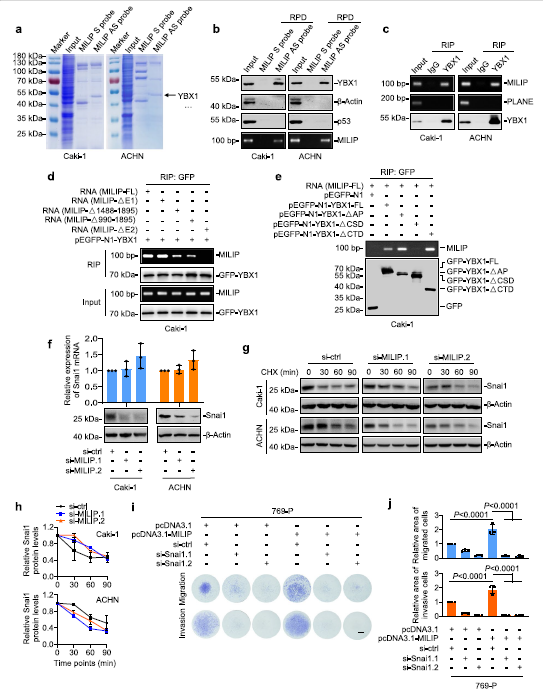
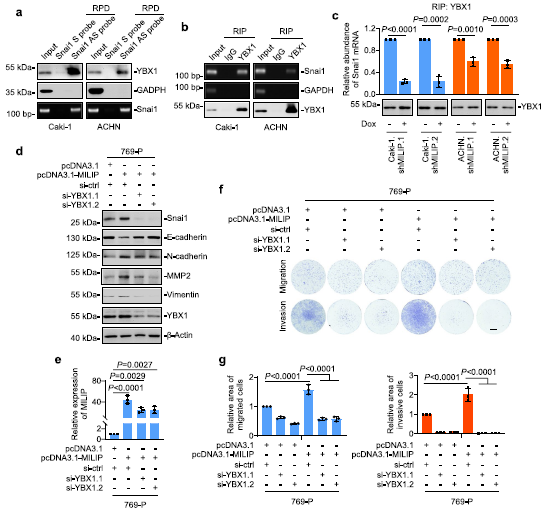
为了了解ccRCC细胞中MILIP介导的EMT促进机制,我们使用RNA下拉和质谱分析确定了与MILIP相互作用的蛋白质。与MILIP共沉淀的最丰富的蛋白质是YBX1(图3a),这是一种核酸结合蛋白,已知可翻译激活Snai1,通过转录抑制下调E-cadherin表达,从而促进EMT。在Caki-1和ACHN细胞中使用RNA下拉和RIP测定确认了MILIP和YBX1之间的关联(图3b,c)。为了确定负责与YBX1相互作用的MILIP区域,我们对体外转录的MILIP突变体进行了映射实验。该分析表明,位于外显子2 (E2)内的MILIP片段618-989是其与YBX1结合的关键(图3d)。另一方面,YBX1的CSD缺失减少了其与MILIP的关联(图3e)。值得注意的是,MILIP的敲低导致Snai1蛋白水平的下调,而不影响Snai1 mRNA表达(图3f)。环己酰亚胺追踪实验表明,MILIP的敲除不会改变Snai1蛋白的周转率(图3g,h)。Snai1的敲低消除了MILIP过表达诱导的ccRCC细胞迁移和侵袭(图3i,j),表明Snai1对于MILIP介导的ccRCC细胞转移的促进至关重要。
4)MILIP与Snai1 mRNA形成RNA-RNA双链
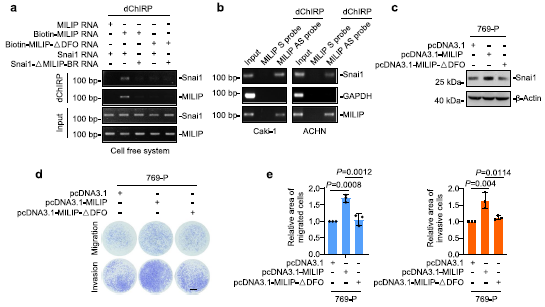
我们研究了MILIP如何促进Snai1的翻译激活。使用IntaRNA程序进行的生物信息学分析确定了Snai1 mRNA的5′UTR附近的潜在MILIP结合区(MILIP-BR),该区域与MILIP中富含 DFO的片段互补。体外合成的生物素标记的MILIP RNA沉淀了含有MILIP-BR的RNA片段(图4a)。然而,当MILIP内富含DFO的片段被删除时,这种关联性减弱(图4a)。因此,MILIP和Snai1 mRNA分别通过DFO和MILIP-BR形成RNA-RNA双链体。作为支持,内源性MILIP从Caki-1和ACHN细胞提取物中沉淀Snai1 mRNA(图4b)。我们还测试了RNA-RNA双链在MILIP介导的Snai1翻译调控中的功能重要性。与野生型MILIP的过表达(图4c)相反,将缺乏DFO的MILIP突变体(MILIP-ΔDFO)转染769-P细胞不会影响Snai1蛋白表达水平,也不会影响细胞迁移和侵袭(图4c-e)。因此,RNA-RNA双链的形成是MILIP介导的Snai1翻译促进所必需的。
我们接下来研究了MILIP和YBX1在调节Snai1 mRNA翻译中的关系。正如预期的那样,YBX1与Snai1 mRNA结合(图5a,b)。然而,在MILIP敲低的细胞中,YBX1和Snai1 mRNA之间的这种关联减少(图5c),表明MILIP促进YBX1与Snai1 mRNA的关联。一致地,在769-P细胞中,YBX1的敲除消除了MILIP过表达触发的Snai1、N-cadherin、MMP2和波形蛋白的上调和E-cadherin的下调(图5d,e)。此外,YBX1的敲除至少部分阻断了769-P细胞中MILIP介导的迁移和侵袭增加(图5f,g)。总之,这些结果表明MILIP促进YBX1与Snai1 mRNA的结合,并促进YBX1介导的Snai1的翻译激活。
结论:
TFAP2C响应的MILIP通过与Snai1 mRNA形成RNA-RNA双链以促进YBX1介导的Snai1翻译激活,促进ccRCC转移。MILIP在转移性ccRCCs中上调,且MILIP高表达与ccRCC患者预后不良相关。这些发现揭示了lncRNA介导的促进ccRCC转移的机制,并暗示靶向MILIP代表了治疗晚期ccRCC的新途径。
参考文献:
Wang Y, Feng YC, Gan Y, Teng L, Wang L, La T, Wang P, Gu Y, Yan L, Li N, Zhang L, Wang L, Thorne RF, Zhang XD, Cao H, Shao FM. LncRNA MILIP links YBX1 to translational activation of Snai1 and promotes metastasis in clear cell renal cell carcinoma. J Exp Clin Cancer Res. 2022 Aug 26;41(1):260. doi: 10.1186/s13046-022-02452-9.






