神经损伤特异性长链非编码RNA通过增加Ccl2表达促进神经性疼痛
背根神经节(DRGs)中神经损伤相关基因的适应性改变是神经性疼痛发生的关键。新的证据支持长链非编码RNA(lncRNAs)在调节基因转录中的作用。在这里,作者鉴定了一种保守的lncRNA,命名为神经损伤特异性lncRNA(NIS-lncRNA),NIS-lncRNA可能通过促进FUS触发的DRG Ccl2表达参与神经性疼痛,可能是神经性疼痛管理的一个潜在靶点。该研究于2022年7月发表在《The Journal of Clinical investigaton》,IF:11.864。
技术路线:
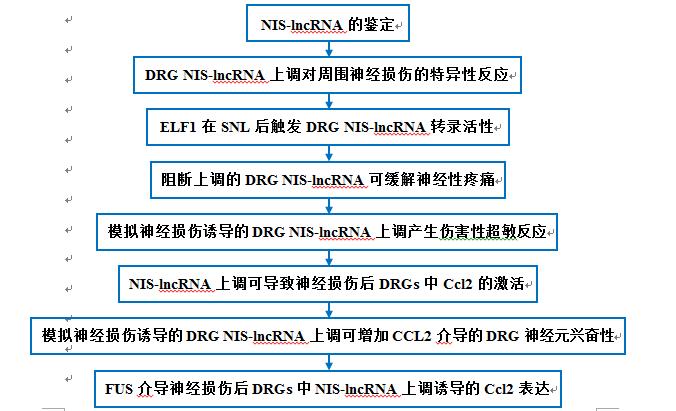
主要研究结果:
1. NIS-lncRNA的鉴定
首先通过RNA测序数据库的分析确定了NIS-lncRNA。使用链特异性引物进行逆转录,并在小鼠、大鼠和人类的DRG中鉴定出NIS-lncRNA转录物(图1A)。利用快速扩增cDNA末端对5'端和3'端及逆转录酶进行定向测序PCR(RT-PCR)检测发现,在小鼠体内,NIS-lncRNA有NIS V1和NIS V2共2个变体(图1B)。使用Northern blot分析,SNL后7天,损伤小鼠DRGs中NIS V1和V2的大小与预期一致(图1C)。两种变体的转录本也在未发育的小鼠的脊髓、不同的大脑区域和其他身体器官中表达(图1D)。对DRG提取物的核/细胞质RNA的定量分析表明,两种变体在细胞核中的富集程度高于在细胞质中的含量(图1E)。此外,这两种变体的体外翻译没有产生蛋白质(图1F)。核糖体分析显示NIS-lncRNA无/极少量核糖体(图1G)。这些证据表明NIS-lncRNA是一种非编码RNA。
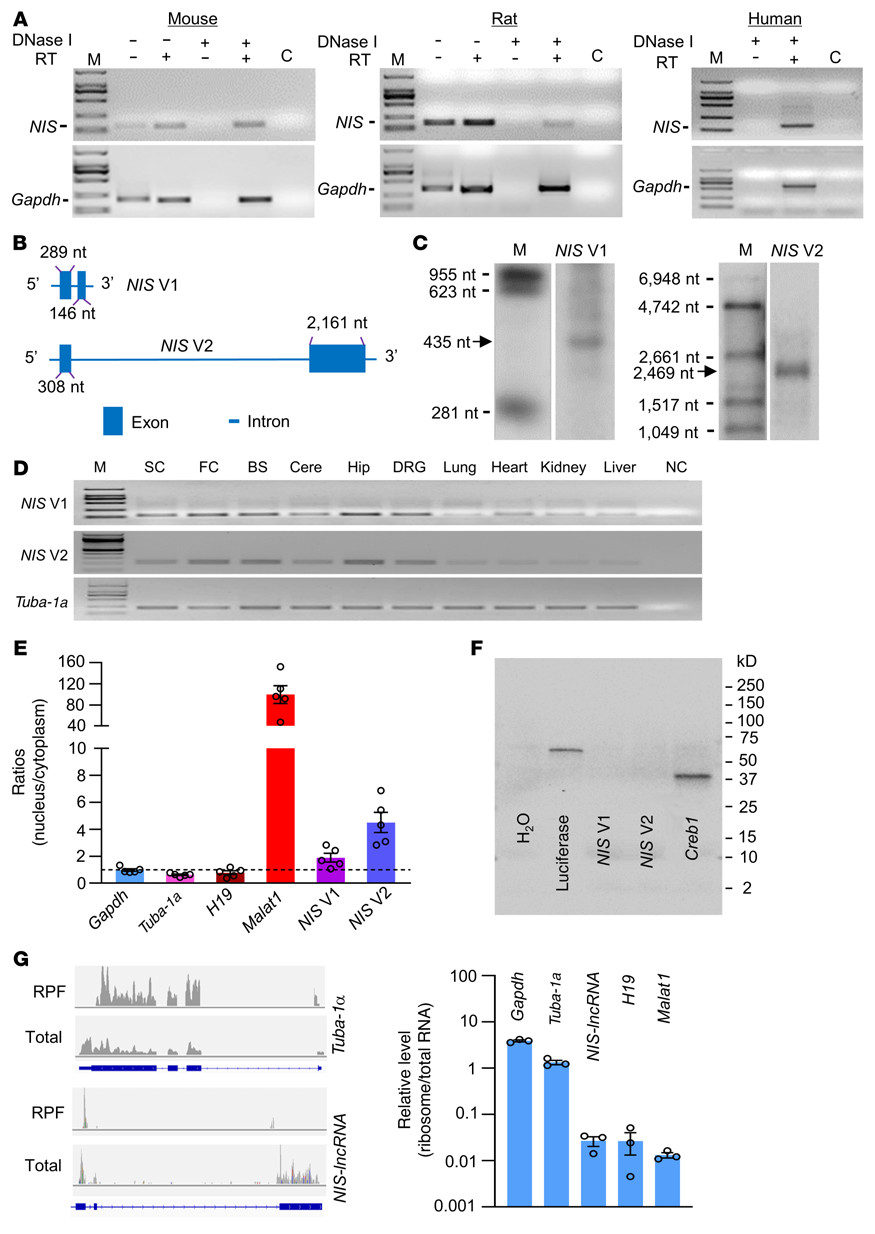
图1. DRGs中NIS-lncRNA的鉴定
2. DRG NIS-lncRNA上调对周围神经损伤的特异性反应
接下来,作者进行了定量RT-PCR分析和增加样本模板策略,来检测周围神经损伤后,NIS-lncRNA在2个疼痛相关区域DRGs和脊髓的表达。SNL,而非Sham(假手术),在同侧L4 DRG中NIS V1和V2在术后第3天至第28天均有时间依赖性上调(图2A)。SNL和Sham均未改变这2个变体在对侧L4 DRG,同侧完整的L3 DRG和同侧L4脊髓中的基础表达(图2B-D)。在另一种由单侧坐骨神经慢性缩窄性损伤(CCI)引起的神经性疼痛动物模型中,结果相似(图2E和F)。有趣的是,在单侧后爪足底注射完全弗氏佐剂引起的慢性炎性疼痛动物模型(图2G)、单侧膝关节关节内注射单碘乙酸钠引起的慢性炎性疼痛动物模型(图2H)和单侧后爪足底切开引起的术后疼痛动物模型(图2I)中,观察期间同侧的L3/4 DRGs中NIS V1和V2水平均未发生明显变化。
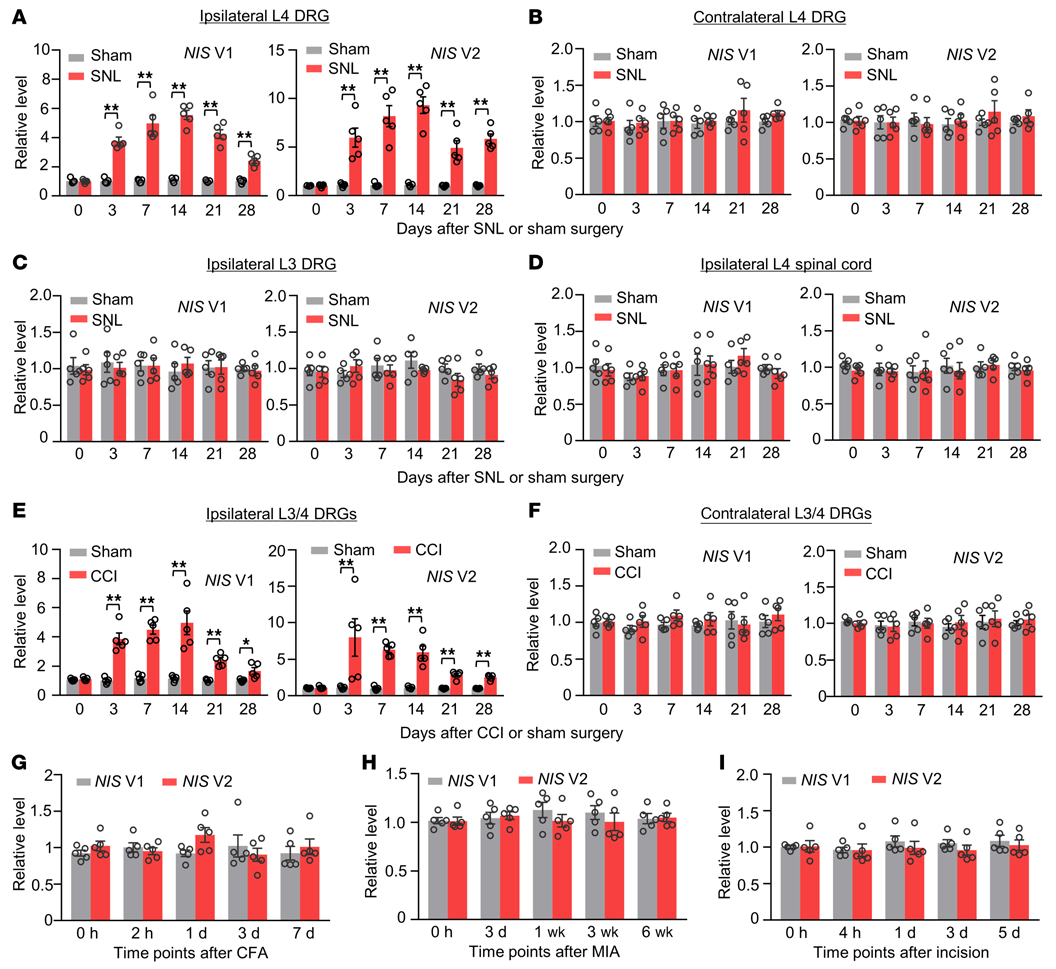
图2. 雄性小鼠周围神经损伤后DRGs中NIS V1和V2表达上调
通过RNAscope原位杂交(ISH)和不同细胞标志物的免疫组化分析,观察NIS-lncRNA在DRG中的细胞分布模式。在SNL后大量检测到NIS V1或V2标记的信号粒子(图3A)。在受损DRGs的单个细胞中,两种变体均与β-微管蛋白III(一种特异性神经元标志物)共表达,但不与谷氨酰胺合成酶(一种卫星胶质细胞标志物)和CD68(一种巨噬细胞和单核细胞标志物)共表达(图3A和B)。定量分析显示在SNL后第3、7和14天,同侧L4 DRG中NIS V1或V2标记的神经元数量显着高于对侧L4 DRG(图3C-F)。重要的是,SNL后上述天数,损伤DRGs神经元中NIS V1或V2标记的信号颗粒(≥3)在细胞核中的富集程度高于细胞质(图3C-F)。神经元胞体的横截面积分析表明,这些变化主要发生在SNL小鼠的中型和大型DRG神经元中(图3G和H)。综上所述,这些证据表明神经损伤诱导DRG神经元中的NIS-lncRNA表达上调可能在神经性疼痛中起功能性作用。
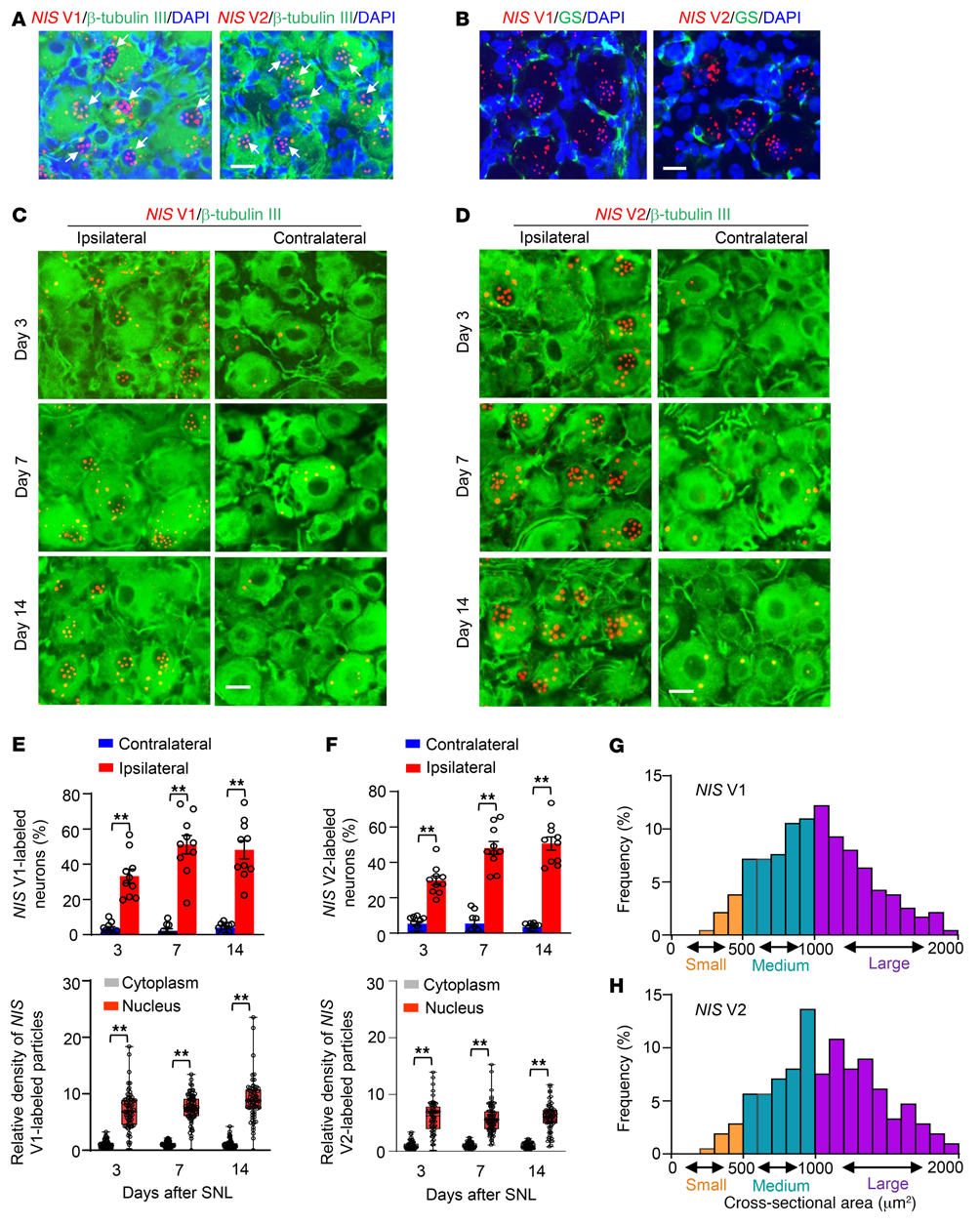
图3. SNL后雄性小鼠DRGs中NIS V1或V2标记神经元数量显著增加
3. ELF1在SNL后触发DRG NIS-lncRNA转录活性
接下来,作者研究DRG NIS-lncRNA在神经损伤后是如何上调的。利用数据库JASPAR确定了NIS-lncRNA启动子区域中E74样ETS转录因子1(ELF1)的共有结合基序(–227TGGGGAGGAAGTT–215)。在伪核片段中,可以从ELF1抗体免疫沉淀复合物中扩增出含有该结合基序的NIS-lncRNA启动子片段(图4A)。SNL后同侧L4 DRG的结合活性增加2.4倍(图4A),ELF1 mRNA和ELF1蛋白水平升高(图4B和C),表明SNL增加了ELF1与NIS-lncRNA启动子的结合。
在体外培养的DRG神经元中,进一步观察到过表达ELF1诱导NIS-lncRNA增加(图4D和E)。荧光素酶测定显示,共转染全长Elf1载体显著增加了体外CAD细胞中NIS-lncRNA启动子的活性(图4F)。在手术前3天通过DRG微注射Elf1 siRNA来阻断SNL诱导的DRG ELF1增加,同时减弱了SNL诱导的同侧L4 DRG中NIS V1和V2水平的增加(图4G和H)。此外,在siRNA微注射前35天,在乱序siRNA微注射的小鼠中,DRG微注射AAV5-Elf1而不是AAV5-Gfp,在siRNA微注射后第7天增加了注射的L3/4 DRGs中NIS V1和V2的量,在siRNA微注射后第5天和第7天,雄性小鼠对同侧机械、热和冷刺激的反应增强(图4I和J)。研究结果表明神经损伤诱导的NIS-lncRNA上调至少部分归因于ELF1在受伤的DRGs中的高表达。
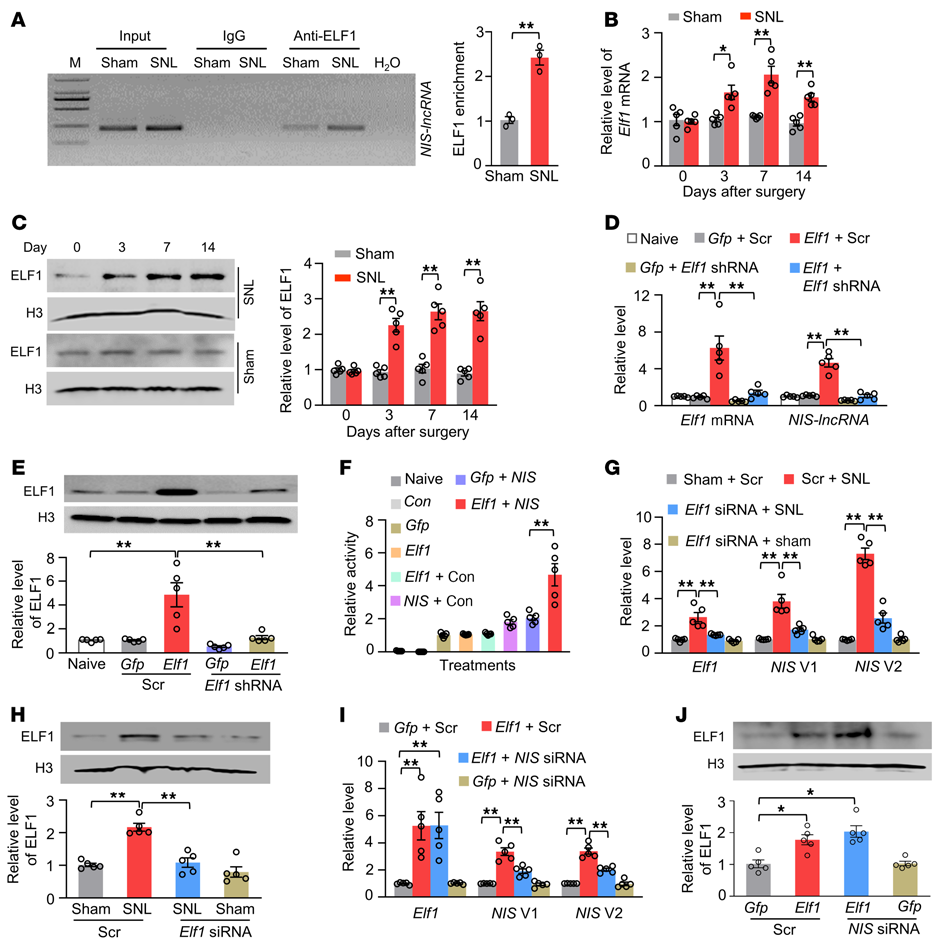
图4. ELF1在SNL后触发受损DRG中的NIS-lncRNA上调
4. 阻断上调的DRG NIS-lncRNA可缓解神经性疼痛
在雄性小鼠的CCI或Sham前4天,将在体外培养的DRG神经元中显著敲低NIS-lncRNA及其2个变体的NIS-lncRNA siRNA微注射到单侧L3/4 DRGs 中。这种微注射不仅阻断了CCI诱导的同侧L3/4 DRGs在CCI后第5天NIS V1和V2水平的升高(图5A)。也改善了CCI后第3天和第5天CCI引起的同侧机械、热和冷伤害性超敏反应(图5B-D)。
作者生成了NIS-lncRNAfl/fl小鼠,并发现手术前35天将AAV5-Cre而不是AAV5-Gfp微注射到同侧L3/4 DRGs的雄性小鼠,在CCI后14天阻断了CCI诱导的同侧L3/4 DRGs中NIS V1和V2水平的增加(图5E)。同时也减轻了CCI后第3天至第14天CCI引起的同侧机械、热和冷伤害性超敏反应的发展(图5F-I)。在CCI后第7天,在AAV5-Cre微注射的NIS-lncRNAfl/fl小鼠中,同侧的机械、热和冷伤害性超敏反应完全发生(图5J-M)。从CCI后的第14天到第28天,这些伤害性超敏反应显著减弱(图5J-M)。此外,在CCI后28天,与刺激无关的自发持续疼痛在AAV5-Cre微注射的NIS-lncRNAfl/fl小鼠中也显著减少(图5N)。
综上所述,作者的研究结果强烈表明,在受损DRGs中上调NIS-lncRNA对神经性疼痛的发生和维持是必需的。

图5. 阻断DRG NIS-lncRNA上调可减轻雄性小鼠神经性疼痛的发生和维持
5. 模拟神经损伤诱导的DRG NIS-lncRNA上调产生伤害性超敏反应
将表达全长NIS V1(AAV5-V1)或V2(AAV5-V2)的AAV5微注射到天然雄性小鼠的单侧L3/4 DRGs中,AAV5-Gfp用作对照。在病毒微注射8周后,注射的DRGs中NIS V1和V2的水平显著增加(图6A)。AAV5-V1或AAV5-V2的DRG微注射导致响应机械刺激的缩爪频率增加和响应注射侧的热或冷刺激的缩爪潜伏期降低(图6B-E)。这些行为变化发生在微注射后2到4周之间,并持续至少8周(图6B-E)。DRG微注射AAV5-V1或AAV5-V2均可在微注射8周后产生独立的自发持续疼痛(图6F和G)。微注射后8周,在同侧L3/4背角也检测到了p-ERK1/2和GFAP水平的显著增加,表明神经元和星形胶质细胞过度活跃(图6H)。这些发现表明,在没有神经损伤的情况下,DRG NIS-lncRNA上调可能会产生神经性疼痛样症状。

图6. DRG过表达NIS-lncRNA在未发病雄性小鼠中产生神经性疼痛样症状
6. NIS-lncRNA上调可导致神经损伤后DRGs中Ccl2的激活
为阐明DRG NIS-lncRNA上调参与神经性疼痛的机制,进行了高通量RNA测序,以确定雄性小鼠受伤DRGs中NIS-lncRNA调节的下游靶点。趋化因子Ccl2 mRNA是重叠基因中最引人注目的一个基因,是神经性疼痛的关键因素。分别将AAV5-V1和AAV5-V2转导到培养的DRG神经元中,NIS V1和V2的过表达显著增加了Ccl2 mRNA的表达水平(图7A)。SNL在SNL后3至14天增加了雄性小鼠同侧L4 DRG中Ccl2 mRNA和CCL2蛋白的量(图7B和C)。DRG微注射AAV5-Cre而不是AAV5-Gfp时,SNL或CCI诱导的Ccl2 mRNA和CCL2蛋白的增加在雄性或雌性NIS-lncRNAfl/fl小鼠的同侧L4 DRG中被显著阻断(图7D和E)。相反,通过将AAV5-V1微注射到用对照干扰siRNA处理的雄性小鼠单侧L3/4 DRG中,DRG过表达NIS V1不仅使同侧(非对侧)对机械、热和冷刺激产生了更强的爪子退缩反应(图8A-D)。但也升高了同侧L3/4 DRG中Ccl2 mRNA和CCL2蛋白的水平(图7F和G)。在AAV5-V1微注射后第35天,在DRG微注射Ccl2 siRNA或腹膜内微注射CCR2拮抗剂CCR2-RA-[R]可阻断这些增强的行为反应(图7F和G,图8A-H)。通过DRG微注射AAV5-Elf1过表达ELF1也增加了用对照乱序siRNA处理的雄性小鼠注射的DRG中Ccl2 mRNA和CCL2蛋白的量(图7H和I)。在AAV5-Elf1微注射35天后,通过DRG微注射NIS-lncRNA siRNA,这些增加显著减弱(图7H和I)。总之,这些证据表明上调的NIS-lncRNA可能参与神经损伤诱导的受损DRG中Ccl2基因的转录激活。
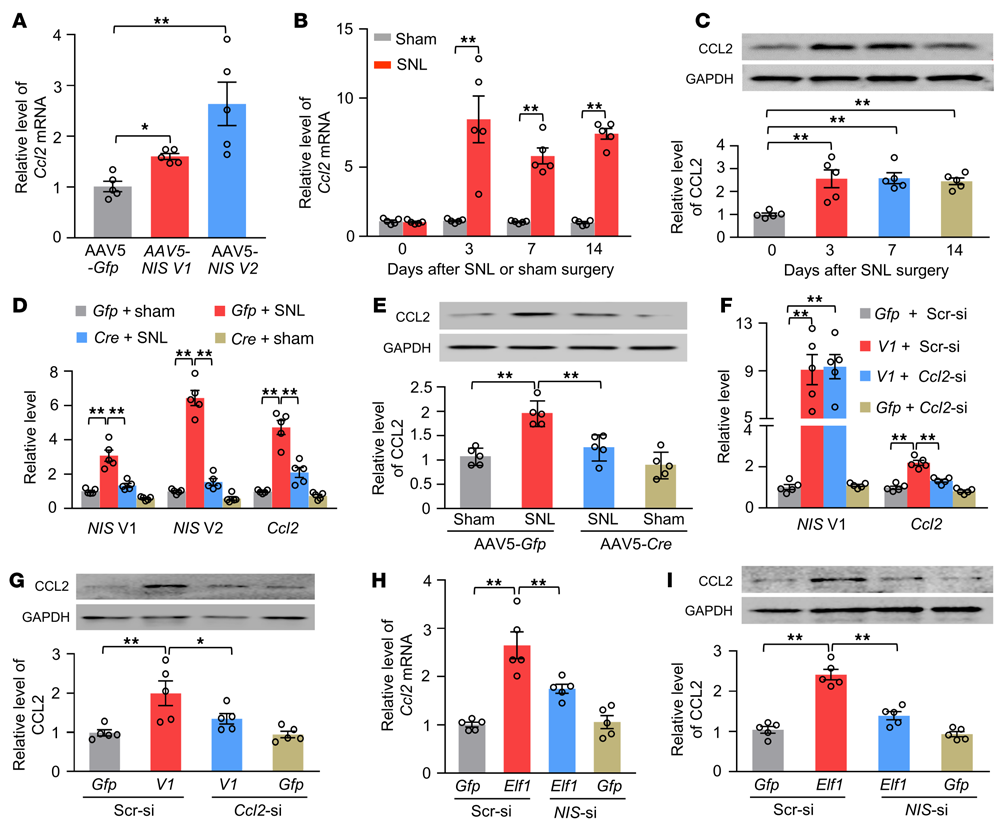
图7. 上调的NIS lncRNA是SNL诱导的雄性小鼠受损DRG中CCL2增加所必需的
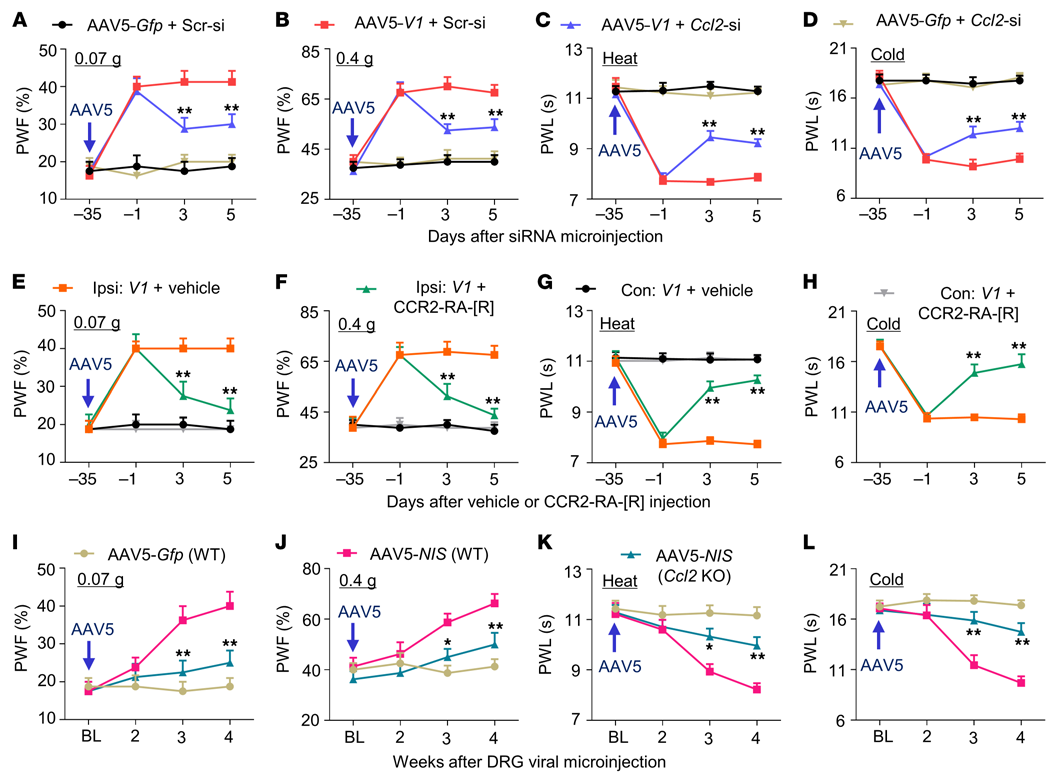
图8. 通过药理抑制或基因敲除DRG CCL2可减轻雄性小鼠DRG NIS V1过表达引起的伤害性超敏反应
7. 模拟神经损伤诱导的DRG NIS-lncRNA上调可增加CCL2介导的DRG神经元兴奋性
在单独微注射AAV5-Gfp(Gfp)或AAV5-NIS-lncRNA V1和AAV5-Gfp(NIS)的混合病毒溶液后4-5周,在同侧L3/4 DRG的急性分离神经元中进行全细胞电流钳记录。Gfp(NIS)进入野生型(WT)或Ccl2-敲除(KO)雄性小鼠的单侧L3/4 DRGs(图9A和B)。NIS微注射的WT小鼠对机械、热和冷刺激的反应增强在NIS微注射的Ccl2-KO小鼠中受损(图8I-L)。与Gfp微注射的WT小鼠相比,NIS微注射的WT小鼠的小型、中型和大型DRG神经元静息膜电位去极化率分别为5.1、4.5和3.6 mV(图9C),而rheobase电位分别降低了49%、43%和36%(图9D)。此外,与注射Gfp的WT小鼠相比,注射NIS的WT小鼠的小型、中型和大型DRG神经元也表现出由注射电流诱发的动作电位数量增加(图9E-H)。在来自NIS微注射的WT小鼠的小型和中型但不是大型的DRG神经元中观察到自发活动的频率显著增加(图9I和J)。综上所述,这些发现表明CCL2可能介导NIS-lncRNA上调诱导的DRG神经元兴奋性增加。
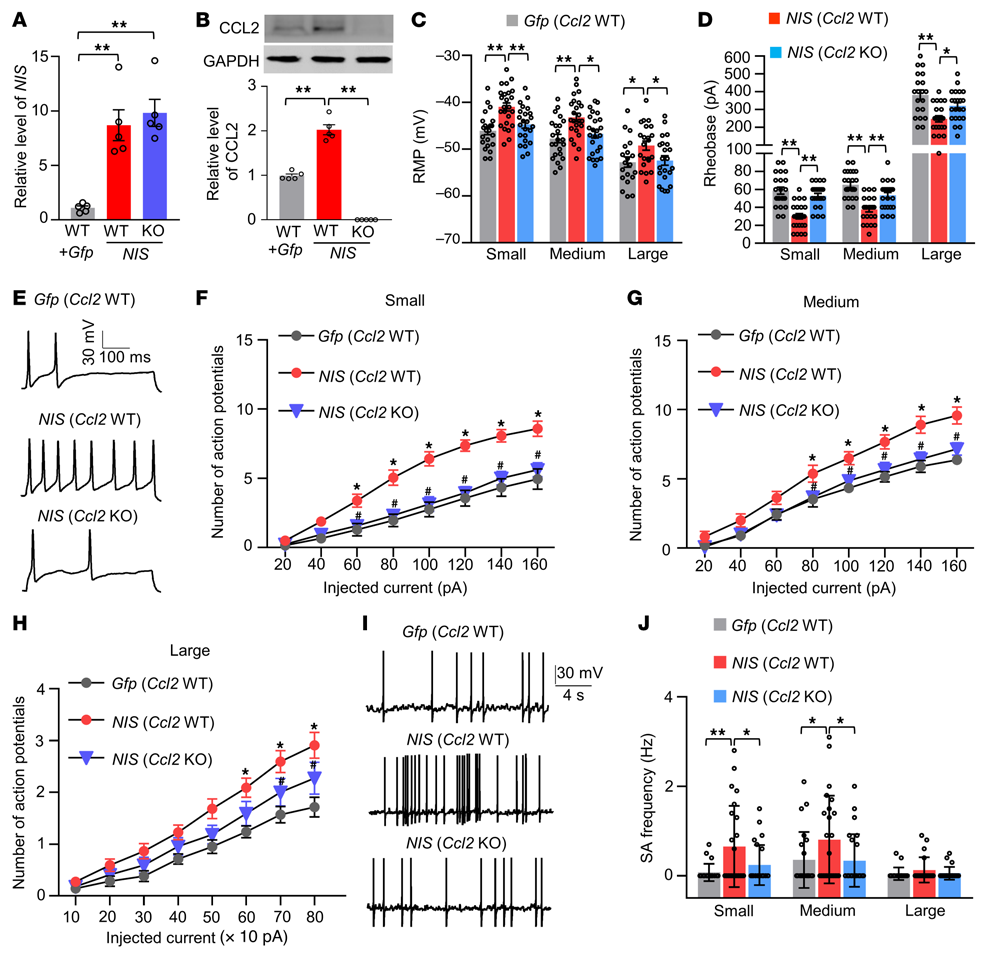
图9. DRG过表达NIS-lncRNA增加CCL2介导的DRG神经元兴奋性
8. FUS介导神经损伤后DRGs中NIS-lncRNA上调诱导的Ccl2表达
在体外培养的DRG神经元中,特定的NIS V1和V2感测RNA探针可以分别拉低FUS,而相应的阴性对照反义RNA探针则不能(图10A)。NIS V1和V2片段均在雄性小鼠的体内假DRGs中被抗FUS抗体(但不是正常纯化的IgG)免疫沉淀(图10B)。与Sham组相比,SNL后第7天损伤DRGs中这两种免疫沉淀活性分别显著增加3.2倍和3倍(图10B)。研究结果表明,在周围神经损伤后,NIS-lncRNA与受损DRG中FUS结合的能力增加。
此外,通过DRG Fus siRNA微注射防止CCI诱导的FUS水平升高,在CCI后第5天阻断了受损DRGs中CCL2量的增加(图10C)。通过DRG微注射AAV5-Fus(而不是AAV5-Gfp),过表达FUS显著提高了NIS-lncRNAfl/fl雄性小鼠微注射DRG中Ccl2 mRNA和CCL2蛋白的水平(图10D和E)。与Sham组相比,在 SNL后第7天,来自AAV5-Gfp微注射的NIS-lncRNAfl/fl小鼠的损伤DRGs的R7和R8中的结合活性分别增加了5.4倍和3倍(图10F和G)。荧光素酶测定表明,在体外共转染全长Fus载体加对照乱序siRNA的CAD细胞中,Ccl2基因启动子被显著激活,但在全长Fus载体加NIS-lncRNA siRNA共转染时没有被激活(图10H)。总之,作者的数据表明FUS介导NIS-lncRNA促进外周神经损伤后受损DRGs中Ccl2表达的增加。

图10. NIS-lncRNA是FUS触发的受伤DRGs中CCL2表达所必需的
结论:
综上所述,作者证明了NIS-lncRNA触发的机制,通过该机制,Ccl2在神经性疼痛条件下选择性地在受损的DRGs中被转录激活。考虑到NIS-lncRNA仅在受损的DRG神经元对外周神经损伤的特异性反应中上调,而阻止这种上调可阻断神经性疼痛的发展并逆转其维持,而不影响基础/急性疼痛和运动功能。因此,NIS-lncRNA可能是缓解神经性疼痛的潜在治疗靶点。






