长链非编码RNA TLNC1通过抑制p53信号促进肝癌的生长和转移
肝癌是全球第六大常见恶性肿瘤和第三大癌症死亡原因。肝癌的高死亡率已被认为是由转移和术后复发直接引起的。然而,目前临床上可用于预防肝癌复发和转移的方法非常有限。为了更有效地治疗肝癌的复发转移,研究肝癌复发转移的分子机制,寻找潜在的治疗靶点具有重要意义。该研究发表于《Molecular Cancer》,IF: 41.444。
技术路线:

主要研究结果:
1. TLNC1在肝癌组织中高表达并与患者预后相关
为了找到与肝癌的发展和进展相关的lncRNA,作者对11对肝癌和邻近的正常肝组织进行了RNA-seq,并确定了328个显著改变的lncRNA(图1a)。为了缩小候选lncRNA的范围,作者首先利用了TCGA LIHC队列(50对)的RNA-seq数据,并确定了658个显著改变的lncRNA(图1b)。通过WCH 和TCGA队列的交叉,确定了101个显著改变的lncRNA,随后根据TCGA LIHC队列的总生存期 (OS) 和无病生存期(DFS)数据对其进行生存分析。经过生存分析,作者成功鉴定出5个候选lncRNA,它们在肿瘤和正常组织之间存在显著差异表达,并且与肝癌患者的OS和DFS均显著相关(图1c)。接下来,通过qRT-PCR对20对组织样本验证了这些候选lncRNA的表达水平。基于表达水平数据,TLNC1被选为候选lncRNA进行进一步研究,因为它是上述5个候选lncRNA中最丰富的lncRNA(图1d)。此外,作者扩大了样本量(n=72)以确认TLNC1在肝癌组织中显著高表达(图1e)。一致地,在TCGA LIHC队列中也观察到了类似的结果(图1f, g)。这些发现表明TLNC1是一种丰富的lncRNA,在肝癌中显著上调并与患者预后相关。

图1 TLNC1在肝癌组织中上调
2. TLNC1的过表达促进体外和体内肝癌细胞的生长和转移
为了确定TLNC1是否作为致瘤性lncRNA发挥作用,作者构建了两个TLNC1过表达肝癌细胞系SNU449和HCCLM3细胞(图2a)。CCK-8和EdU测定显示TLNC1的过表达显著提高了SNU449和HCCLM3细胞的细胞增殖(图2b, c)。此外,作者证明与指定的对照相比,TLNC1过表达的肝癌细胞中的细胞运动性增加(图2d-g)。为了在体内验证TLNC1的致癌功能,作者首先构建了皮下异种移植肝癌小鼠模型,发现TLNC1的强制表达显著增加了异种移植肿瘤的体积和重量(图2h)。此外,建立肝原位移植模型和肺转移模型,以评估TLNC1过表达对肿瘤转移的影响。体内成像系统(IVIS)成像结果表明,TLNC1过表达组在肝脏中表现出更强的生物发光信号强度。同时,TLNC1的过表达显著促进了肝癌细胞的肝脏定植(图2i)。一致地,TLNC1-过表达组在肺转移模型中显示出更多的肺转移灶(图2j)。综上所述,这些数据表明TLNC1过表达促进了肝癌的细胞增殖和转移。
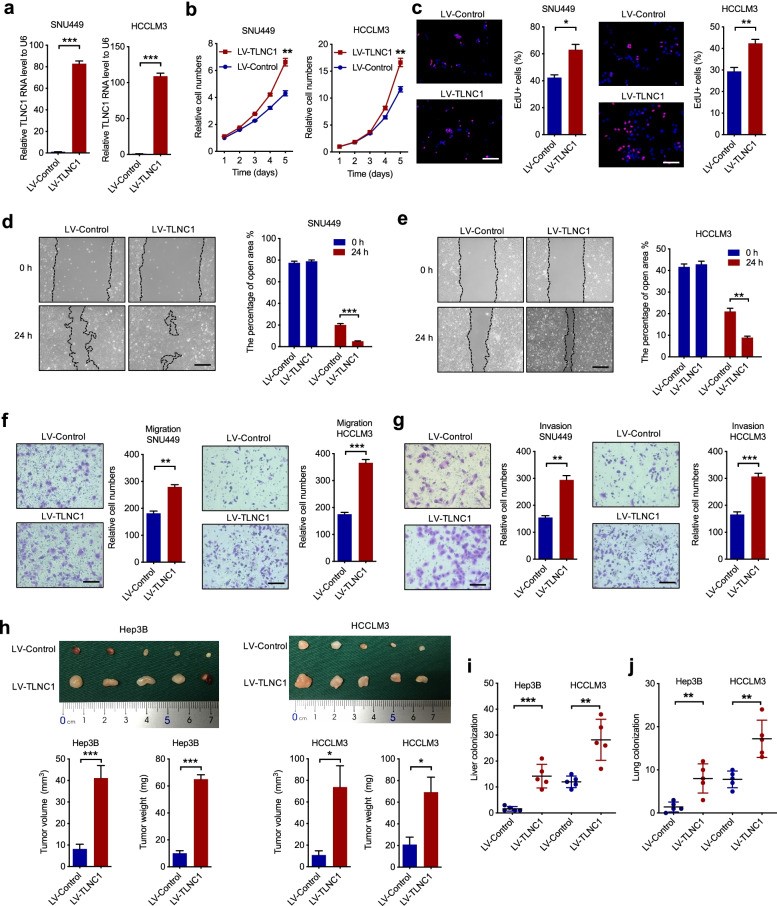
图2 TLNC1促进肝癌细胞的肿瘤生长和转移
3. TLNC1对肝癌的肿瘤进展和转移至关重要
为了证实TLNC1在肝癌肿瘤进展和转移中的功能,作者在SNU449和HCCLM3细胞中使用3个独立的短发夹RNA (shRNA) 使TLNC1沉默(图3a)并选择2个具有更好敲低功效的shRNA用于后续实验。结果表明,TLNC1的沉默抑制了SNU449和HCCLM3细胞的细胞生长(图3b, c)。同时,与指定的对照相比,TLNC1敲低的肝癌细胞系中的细胞运动性显著下调(图3d-f)。为了确定TLNC1是否是体内肝癌生长和转移所必需的,作者首先构建了皮下异种移植肝癌小鼠模型,并表明TLNC1的沉默降低了异种移植肿瘤的体积和重量(图3g)。此外,肝原位移植模型和肺转移模型被用来验证TLNC1沉默对肿瘤转移的作用。IVIS成像结果表明TLNC1敲低组在肝脏中显示出较弱的生物发光信号强度。同时,TLNC1的敲低显著抑制肝癌细胞的肝脏定植(图3h)。一致地,TLNC1敲低组在肺转移模型中显示出较少的肺转移灶(图3i)。总之,作者的结果表明TLNC1是肝癌细胞生长和转移所必需的。
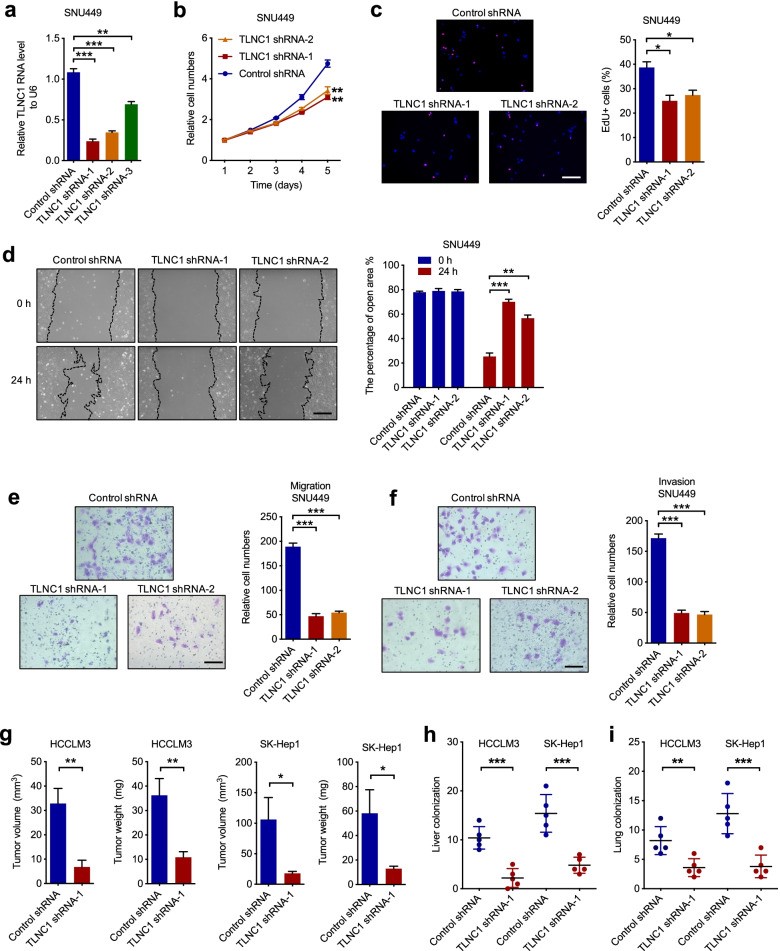
图3 TLNC1的敲低抑制了肝癌细胞的肿瘤生长和转移
4. TLNC1调节与细胞生长和转移相关的多种信号通路
为了探索TLNC1介导的肝癌肿瘤进展和转移的潜在机制,作者进行了RNA-seq以鉴定受TLNC1敲低调节的基因,并 在与对照相比,TLNC1敲低的HCCLM3细胞(图4a)。京都基因和基因组百科全书(KEGG)通路分析表明,p53信号通路和细胞周期是最显著的富集通路之一。基因本体论(GO)分析表明,TLNC1可以调节一系列与肿瘤进展相关的生物学过程,如细胞粘附、粘着斑和有丝分裂细胞周期的调节(图4b)。之后,分别在p53信号通路、细胞周期和粘着斑基因组中鉴定出倍数变化最显著的前10个基因(图4c)。为了验证RNA-seq的数据,作者使用qRT-PCR检查了每个基因组中5个基因的mRNA水平。如图4d和e所示,TLNC1的调节确实调节了与肿瘤生长和转移相关的基因的表达水平。
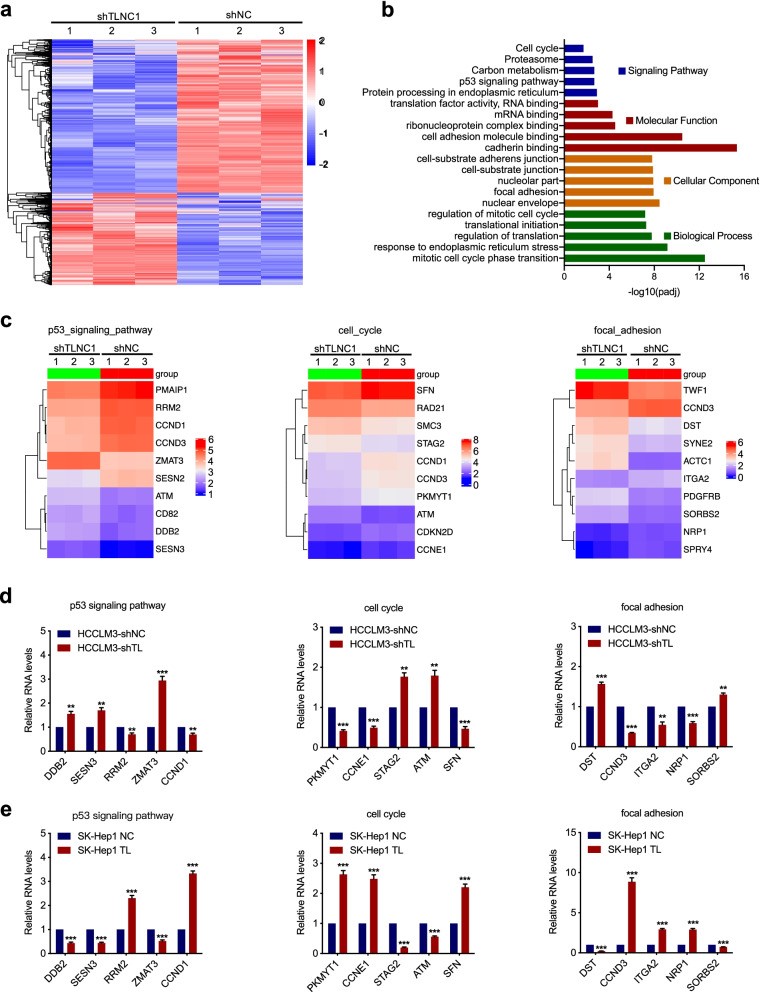
图4 TLNC1诱导肝癌细胞中参与细胞增殖和转移的基因的失调
5. TLNC1与TPR相互作用调节p53信号通路
为了进一步了解TLNC1调节的肿瘤生长和转移的详细机制,作者随后使用生物素标记的RNA pull-down和质谱 (MS) 来鉴定与肝癌细胞中TLNC1相互作用的蛋白质。由于作者已经证明TLNC1主要定位于细胞核,作者只提取核蛋白用于RNA pull-down。共有393种蛋白质被鉴定为TLNC1相互作用蛋白。基于RNA-seq和MS数据的交集,作者假设TLNC1可能通过与TPR相互作用来调节p53信号通路。为了验证这一假设,作者首先验证了TLNC1和TPR之间的相互作用。
接下来,作者试图确定TLNC1和TPR之间的相互作用位点。根据RNA二级结构预测软件RNAfold,作者提出了3个可能与TPR相互作用的潜在部分。基于预测,作者构建了3个截短的TLNC1片段,并表明TLNC1和TPR之间的相互作用需要1-653个核苷酸(图5a)。之后,作者进行了RNA pull-down和RIP分析,以表明TPR的775-1700个氨基酸是TPR与TLNC1相互作用的原因(图5b, c)。
为了确定TLNC1是否能够调节p53信号通路,作者使用含有p21启动子的载体进行了双荧光素酶报告基因检测,p21启动子是众所周知的p53转录靶标。结果表明TLNC1 过表达显著下调p53在肝癌细胞中的转录活性(图5d)。一致地,p53靶基因的mRNA水平,如 p21、波形蛋白、MMP2、Bax 和 Maspin,可以被TLNC1调节(图5e)。为了进一步确定TLNC1通过TPR调节p53信号通路,作者在TLNC1过表达肝癌细胞中用siRNA敲低TPR(图5f)。如图5g-i所示,TPR的敲低阻断了TLNC1过表达介导的p21下调,以及TLNC1的致瘤功能。
这些结果表明TLNC1可以通过与TPR相互作用来调节p53信号通路。
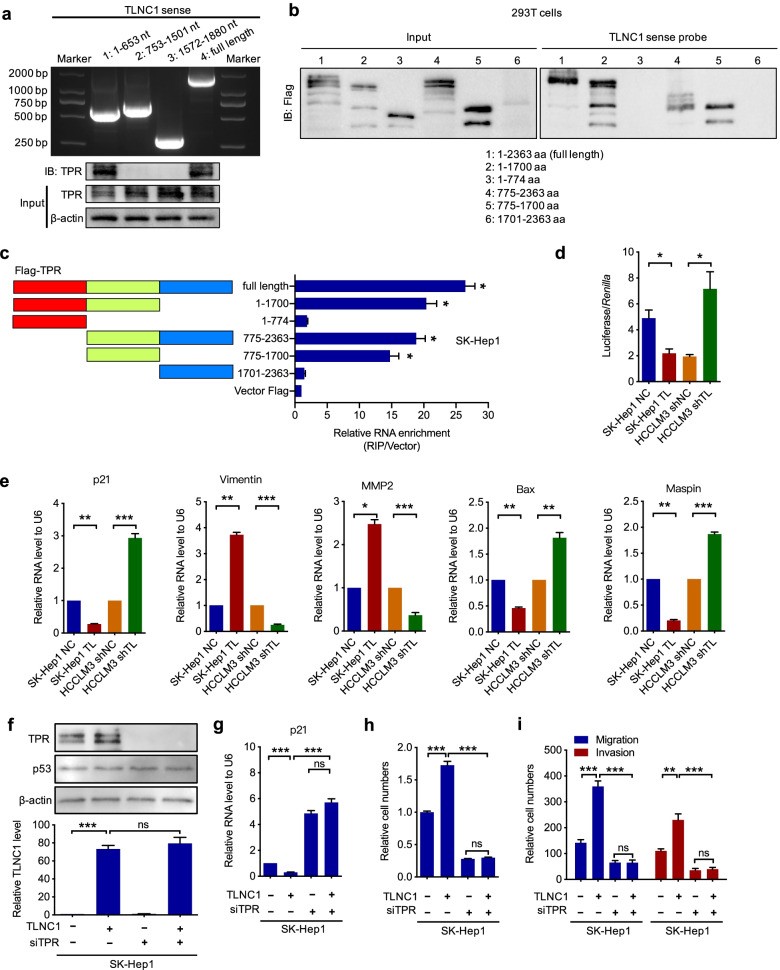
图5 TLNC1与TPR相互作用并抑制p53的转录活性
6. TLNC1通过与TPR相互作用促进p53胞质易位
为了发挥转录因子的功能,p53必须从细胞质转移到细胞核。为了了解TLNC1如何调节p53信号通路的机制,作者检测了p53在TLNC1过表达或敲低时的亚细胞定位。如图6a所示,TLNC1过表达极大地刺激了p53的细胞质易位。免疫印迹进一步证实了这一观察结果,尽管p53的总蛋白水平在TLNC1过表达后保持不变,但细胞核中p53的量显著降低(图6b, c)。
根据以往的研究,TPR可以与染色体维持区1 (CRM1) 形成复合物,介导p53的核输出。为了确定TLNC1是否通过调节TPR-CRM1-p53复合物促进p53的核输出,作者检查了TPR、CRM1和p53与co-IP之间的相互作用。如图6d所示,TPR可以与野生型肝癌细胞中的CRM1和p53相互作用。有趣的是,TLNC1的过表达增强了TPR-CRM1-p53复合物的相互作用,而TLNC1的敲低抑制了TPR-CRM1-p53复合物的相互作用(图6e)。为了进一步发现TLNC1如何促进复合物的形成,作者首先检查了蛋白质与纯化重组蛋白的相互作用,以排除细胞裂解物中其他蛋白质的干扰。如图6f所示,TPR显示直接与CRM1结合,CRM1可以直接与p53结合;然而,TPR不能直接与p53结合。接下来,表面等离子共振分析显示,在存在 TLNC1 的情况下,TPR和CRM1之间的亲和力显著增加(图6g)。
这些数据表明TLNC1通过与TPR的相互作用诱导p53的核输出并上调TPR和CRM1 之间的亲和力。
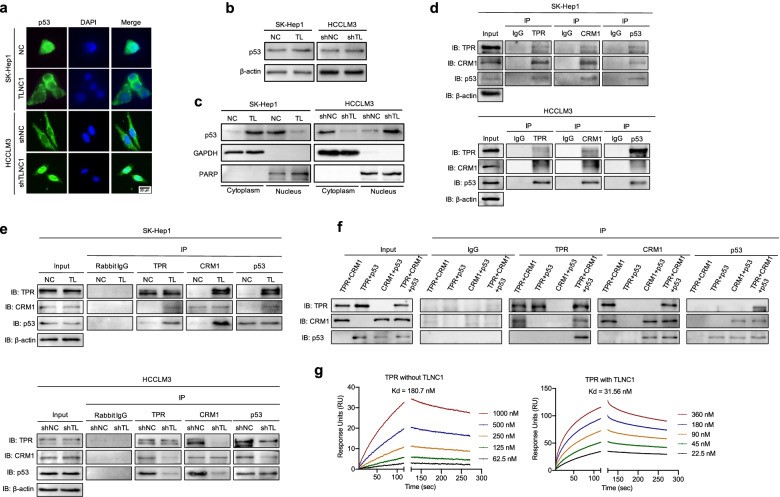
图6 TLNC1通过与TPR的相互作用抑制p53的核转位
7. TLNC1的上调预测肝癌患者的不良生存率
为进一步探讨TLNC1在肝癌中表达的临床意义,将72例肝癌患者根据TLNC1的表达水平分为2组:TLNC1高表达组(n=36)和TLNC1低表达组(n=36)。相关分析显示,TLNC1 表达与肝硬化显著相关(p= 0.026)。单变量分析显示,TLNC1高表达组的OS(风险比(HR),2.28;95%置信区间(CI),0.92~5.63)和TLNC1高表达组的DFS(HR,1.06;95%CI,0.59至1.93)比低 TLNC1 表达组差(p<0.05)。同样,华西医院(WCH)和TCGA 数据集的生存曲线显示TLNC1表达与患者预后呈负相关(图7a-d)。
为了验证TLNC1可以调节人肝癌中p53信号通路,作者检测了p21 mRNA的表达水平,发现p21的mRNA水平与TLNC1的表达水平呈负相关(r=- 0.6249,p<0.0001)。这些数据证明TLNC1可以诱导p53的核输出并抑制p21的转录。为了评估TLNC1-p53轴的临床潜力,作者随后分析了TLNC1和p21组合的预后潜力。引人注目的是,TLNC1低表达和p21高表达的患者预后最好。相反,TLNC1高表达而p21低表达的患者预后最差(图7e, f)。总之,这些数据表明TLNC1和p21的组合可用作肝癌患者的预后因素。
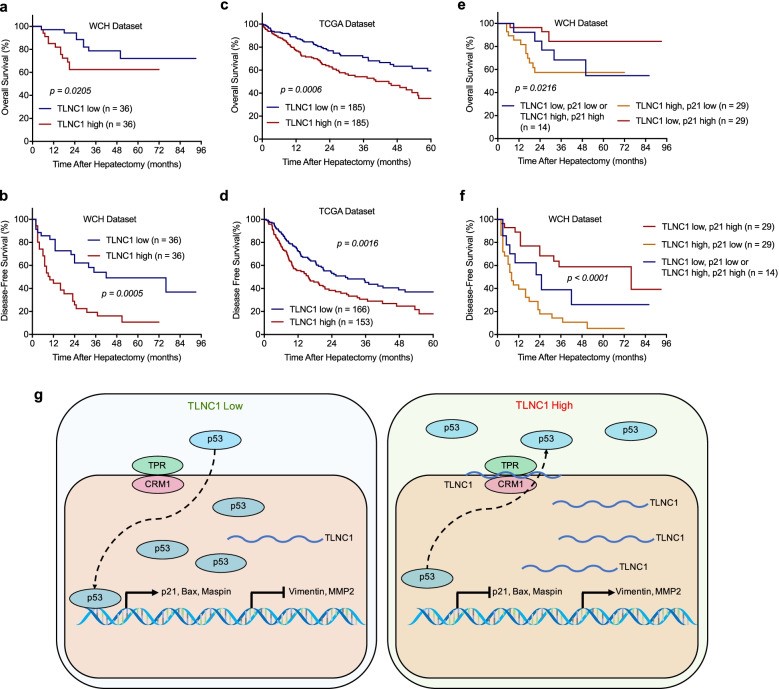
图7 高水平的TLNC1与低水平的p21与肝癌患者预后不良有关
结论:
该研究表明,TLNC1能够在体外和体内促进肝癌的肿瘤生长和转移。机制上,该研究证明TLNC1可以与TPR相互作用以加强TPR和CRM1之间的相互作用,从而促进p53的核输出,导致一系列肿瘤抑制基因的下调和许多癌基因的上调,最终有助于诱导肝癌的肿瘤生长和转移。此外,该研究证明TLNC1与肝癌患者的OS和DFS密切相关,TLNC1和p53 靶基因p21的组合可以作为肝癌患者的预后生物标志物。
参考文献:
Yuan K, Lan J, Xu L, Feng X, Liao H, Xie K, Wu H, Zeng Y. Long noncoding RNA TLNC1 promotes the growth and metastasis of liver cancer via inhibition of p53 signaling. Mol Cancer. 2022;21(1):105. doi: 10.1186/s12943-022-01578-w.






