RNA结合蛋白HuR通过抑制长链非编码RNA H19的表达来保护NAFLD
NAFLD已成为全球最常见的慢性肝病。人抗原R (Human antigen R, HuR)是一种RNA结合蛋白,也是一种重要的转录后调节因子。有研究发现HuR在调节肝脏和脂肪组织的脂质稳态中起关键作用。然而,在代谢应激下,肝细胞特异性HuR调节肝脏脂质代谢的潜在机制仍不清楚。近日,有研究发现HuR不仅作为RNA结合蛋白调节转录后基因表达,还调节H19启动子活性。肝脏HuR通过调节H19的表达,是肝脏脂质代谢的重要调节因子。该研究发表在《Cell & Bioscience》,IF:9.584。
技术路线:

主要研究结果:
1. 肝细胞特异性HuR缺陷增强了WDSW诱导的NAFLD
为了明确HuR在NAFLD疾病进展中的肝细胞特异性作用,通过尾静脉注射AAV8-TBGP-Cre重组酶的HuRflox/flox小鼠建立HuRhKO小鼠,并以AAV8-TBGP-GFP作为对照。如图1a, b所示,肝细胞特异性敲除HuR加重了WDSW-诱导的肝脏脂质蓄积和4周喂养后的肝损伤:表现为脂质蓄积增加,AST和ALT水平升高,且HuRhKO小鼠的肝脏甘油三酯和胆固醇水平远高于对照小鼠(图1c)。此外,如图1所示,在WDSW喂养4周后,TCA在总胆汁酸中的百分比从10%(对照)显著增加到23% (HuRhKO),而βMCA从26%(对照)显著降低到15% (HuRhKO)。HuRhKO小鼠血清总胆汁酸水平显著升高,包括总初级、次级和结合胆汁酸(图1e)。
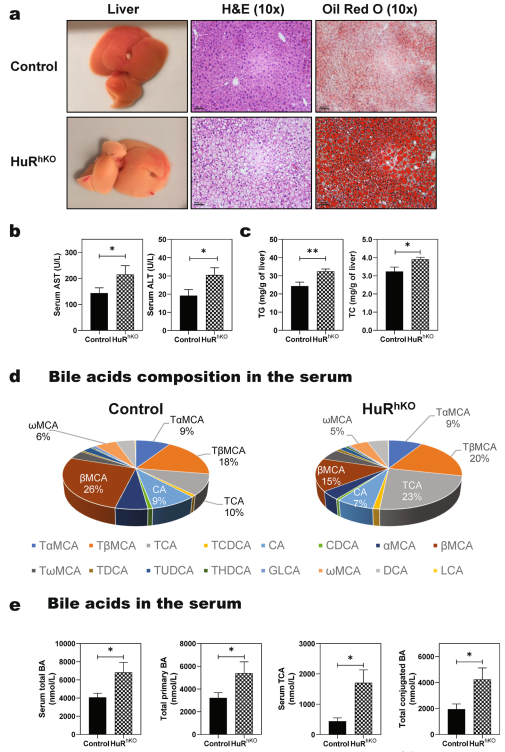
图1肝细胞特异性HuR缺乏增强WDSW诱导的NAFLD
2. 肝细胞特异性HuR缺陷通过调节整体转录组谱增强了WDSW诱导的NAFLD
为了阐明肝脏HuR缺乏导致NAFLD疾病进展的潜在机制,进行了RNA-seq转录组分析。如图2a, b所示,与对照组小鼠相比,WDSW饲喂导致HuRhKO小鼠中192个基因表达上调,160个基因表达下调。

图2肝细胞特异性HuR缺失通过调节整体转录组谱增强WDSW诱导的NAFLD
3. 肝细胞特异性HuR缺乏增强WDSW诱导的脂肪酸和脂质代谢失调
如图2c所示,在WDSW喂养4周后,与对照组小鼠相比,HuRhKO小鼠中脂肪酸生物合成途径中涉及的大部分基因增加:包括Acc1、Fasn、Elov16、Fads1/ 2、LXRα/β、Ppar α/β、Cpt1α、Pnpla3和Atgl等。q-PCR结果显示(图2d),与对照组小鼠相比,在WDSW喂养4周后,Acc1、Fasn、Elov16、Fads1/ 2、LXRα/β、Ppar α/β、Cpt1α、Pnpla3和Atgl的mRNA水平在HuRhKO小鼠中显著增加。
4. 肝细胞特异性HuR缺陷增强了WDSW诱导的炎症和氧化应激
RNA-seq分析显示,在WDSW喂养4周的HuRhKO小鼠中,F4/80免疫组织化学染色结果显示,肝细胞特异性敲除HuR促进WDSW诱导的巨噬细胞向肝脏浸润,在各种巨噬细胞上高水平表达的成熟细胞表面糖蛋白(图3a)。q-PCR结果显示,巨噬细胞的主要标志基因、炎性细胞因子和趋化因子F4/80、Cd68、Cd63、Integrin alpha M (图3b)、Cxcl1、Cxcl10、Ccl2、Ccr2、IL-1α、IL-1β、Tnfα和IL-6等的mRNA表达水平显著升高(图3c)。中性粒细胞的不适当激活会导致组织损伤,这已经涉及到不同的疾病,包括各种肝脏疾病。在本研究中,参与中性粒细胞活化的主要基因如Nox2, Ncf2, Ncf4, Cybα, IL-2rγ,ICAM1和Vcam1,在WDSW喂养的HuRhKO小鼠的肝脏中显著上调(图3d)。
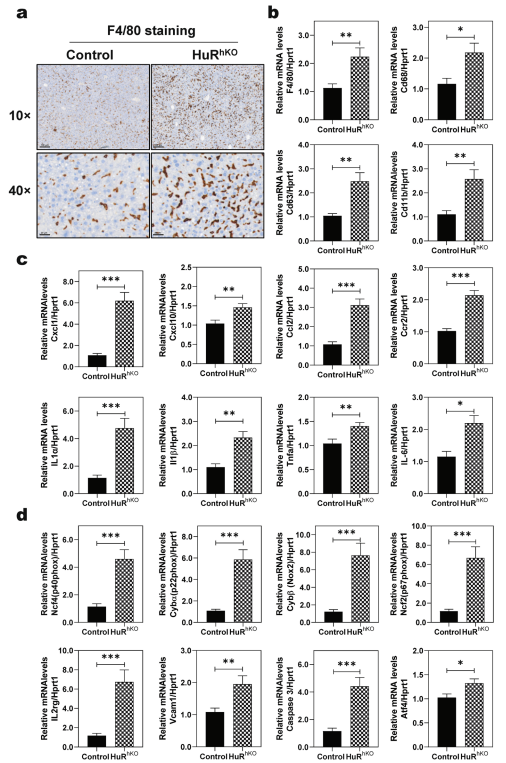
图3肝细胞特异性HuR缺乏增强WDSW诱导的炎症和氧化应激
5. HuR是lncRNA H19转录的抑制因子
先前的研究表明lncRNA H19的异常表达与包括NASH在内的多种肝脏疾病的肝脏炎症和肝纤维化密切相关。为了进一步确定肝脏中HuR的缺失促进NAFLD进展的潜在机制,检测了H19在人类NASH患者和WDSW诱导的NASH小鼠模型肝脏中的表达。如图4a所示,与健康对照相比,人类NASH患者的肝脏H19 mRNA水平增加了10倍以上。类似地,在喂食WDSW 21周的NASH小鼠中,与对照小鼠相比,肝脏H19 mRNA水平增加了30倍以上(图4b)。对来自最近一项研究(GSE143358)的公开RNAseq数据集的分析表明,H19是肝脏特异性HuR敲除小鼠中上调最显著的基因(图4c)。另外,在喂食WDSW 4周的HuRhKO小鼠肝脏中,H19显著上调(图4d)。荧光素酶报告基因实验所示,过表达HuR显著抑制H19启动子活性(图4e)。为了进一步确定H19在体内肝脏脂肪变性和炎症中的作用,H19 - / -小鼠和WT小鼠被喂养4周的WDSW。结果显示,WDSW诱导的H19 - / -小鼠肝脏脂质蓄积得到保护(图4f)。
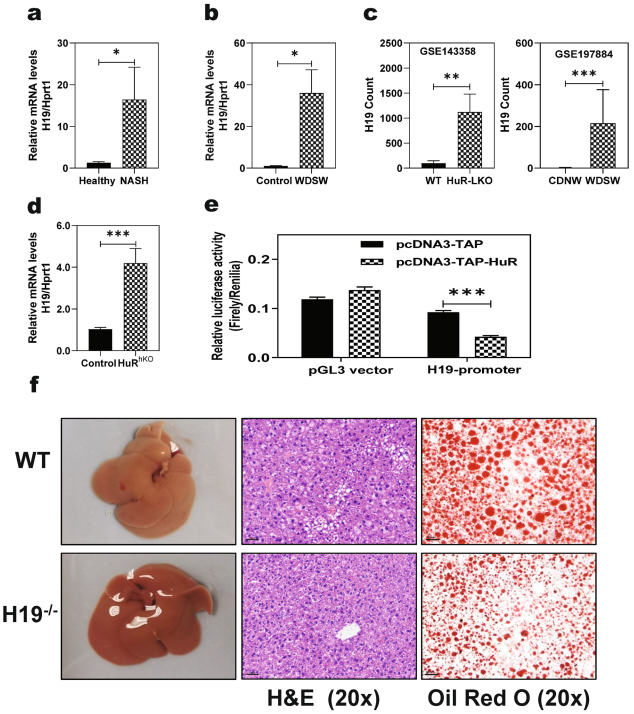
图4 HuR是lncRNA H19转录的抑制因子
6. HuR调节SphK2和S1PR2的表达
有研究报道鞘脂分解代谢的关键酶SphK2在调节肝脏脂质代谢中发挥重要作用。与接受两周高脂饮食的对照组小鼠相比,SphK2基因缺陷(SphK2 - / -)小鼠出现了明显的脂肪肝。SphK2主要定位于细胞核。如图5a所示,与对照组小鼠相比,WDSW喂养的HuRhKO小鼠肝脏中SphK2的核蛋白水平显著降低。H19缺失增加SphK2核蛋白水平(图5b)。如图5c, d所示,人NASH患者和WDSW诱导的NASH小鼠模型肝脏中S1PR2 mRNA水平显著上调。同样,在WDSW喂养的HuRhKO小鼠中,S1PR2的mRNA和蛋白水平均显著升高。荧光素酶报告实验显示S1PR2显著增强H19启动子活性(图5e)。
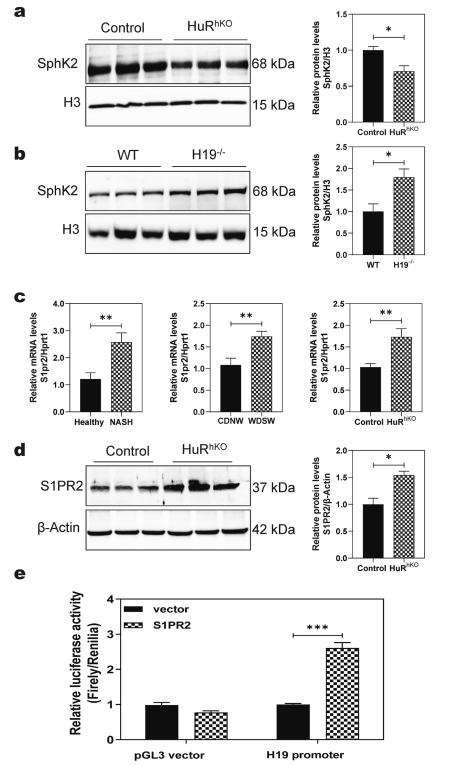
图5 HuR调节SphK2和S1PR2的表达
7. 肝细胞特异性HuR缺陷增强了WDSW诱导的胆汁酸稳态失调
胆汁酸是重要的信号分子,在调节肝脏脂质、葡萄糖和能量代谢中起关键作用。血清胆汁酸水平的LC-MS /MS分析表明,肝细胞特异性HuR缺陷加重了WDSW诱导的胆汁酸稳态破坏(图1d, e)。q-PCR分析显示,胆汁酸合成途径中的两种限速酶Cyp7α1和Cyp27α1的表达水平显著降低。相反,Shp和Ntcp的表达水平在WDSW喂养的HuRhKO的肝脏中显著上调(图6a)。为了进一步确定肝细胞特异性缺失HuR对肠肝循环的影响,使用LC-MS /MS检测了肝脏、回肠和盲肠内容物中的胆汁酸组成和水平。如图6b所示,TCA在肝脏总胆汁酸中的百分比从27%(对照)增加到40% (HuRhKO),而βMCA从39%(对照)降低到24% (HuRhKO)。虽然在WDSW喂养的HuRhKO小鼠和对照小鼠之间,肝脏总胆汁酸无显著变化,但在HuRhKO小鼠中,TCA水平、总初级结合胆汁酸与总初级未结合胆汁酸的比值、总结合胆汁酸与总未结合胆汁酸的比值和总二级结合胆汁酸与总二级未结合胆汁酸的比值均升高(图6c)。然而,肝细胞HuR缺乏显著降低了盲肠内容物中的胆汁酸水平 (图6d)。
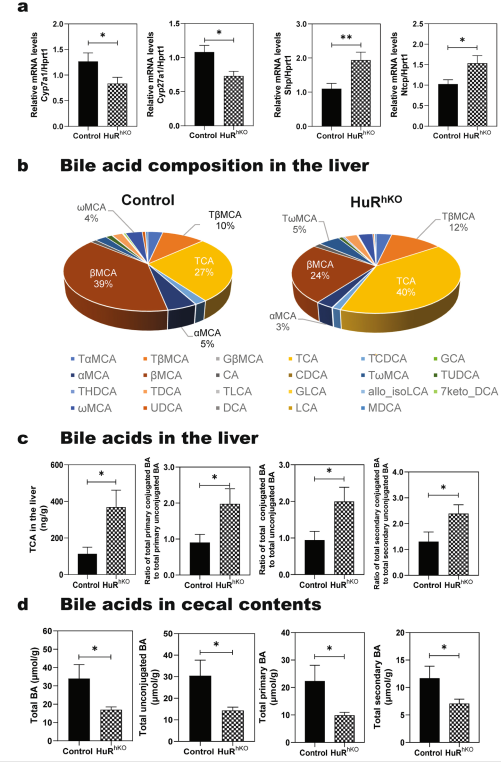
图6肝细胞特异性HuR缺乏增强WDSW诱导的胆汁酸稳态失调
8. 肝细胞特异性HuR缺陷增强了WDSW诱导的肝纤维化
为了进一步研究肝脏HuR在WDSW诱导的NAFLD疾病进展中的影响,对照组和HuRhKO小鼠自由进食12周的WDSW诱导NASH和早期纤维化。苏木精-伊红染色显示,喂食WDSW 12周的HuRhKO小鼠出现了加重的腺泡内(小叶)炎症、肝细胞气球样变和大泡性脂肪变性(图7a)。与在HuRhKO小鼠中进行的4周WDSW喂养研究(图4d)相似,在12周WDSW喂养的HuRhKO小鼠中,肝脏H19表达水平显著上调(图7b)。如图7c所示,喂养WDSW 12周的HuRhKO小鼠肝脏巨噬细胞浸润增强,可见F4/80的免疫组化染色。如图7c所示,12周WDSW喂养在HuRhKO小鼠中诱导了早期纤维化,但在对照组小鼠中诱导的纤维化要少得多。CK-19染色显示肝细胞特异性HuR缺陷显著加重了WDSW诱导的胆管细胞增殖。在WDSW喂养的HuRhKO小鼠中,Ck19、α-Sma、Tgfβ1、Loxl2、sox4/9、Ctgf、Mmp2/7、Sctr、Postn和S1pr2的mRNA表达水平显著上调,表明肝细胞特异性HuR缺陷加重WDSW诱导的肝纤维化(图7d)。
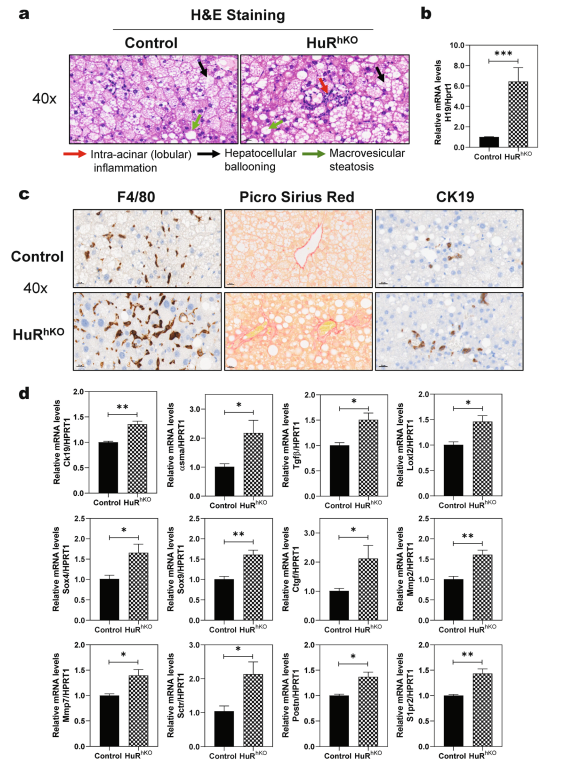
图7肝细胞特异性HuR缺乏加重WDSW诱导的肝纤维化
9. H19下调可缓解WDSW诱导的HuRhKO小鼠NAFLD
H19上调可能是WDSW诱导的HuRhKO小鼠NAFLD的主要细胞机制。为了验证H19在WDSW诱导的HuRhKO小鼠NAFLD中的作用HuRhKO小鼠被注射编码H19-shRNA的重组腺病毒或对照腺病毒(GFP),同时自由进食WDSW 4周。如图8a所示,与注射对照腺病毒相比,注射H19-shRNA腺病毒后,肝脏中H19水平显著降低。H19的下调逆转了WDSW诱导的SphK2核内蛋白的降低(图8b)。H&E染色显示,在HuRhKO小鼠中,H19的下调减轻了WDSW诱导的腺泡内(小叶)炎症、肝细胞气球样变和大泡性脂肪变性(图8c)。Picro-Sirius Red染色还表明,在HuRhKO小鼠中,H19的下调减少了WDSW诱导的早期纤维化(图8d)。总之,这些结果表明,上调H19至少部分地促进了WDSW诱导的HuRhKO小鼠NAFLD的发展。
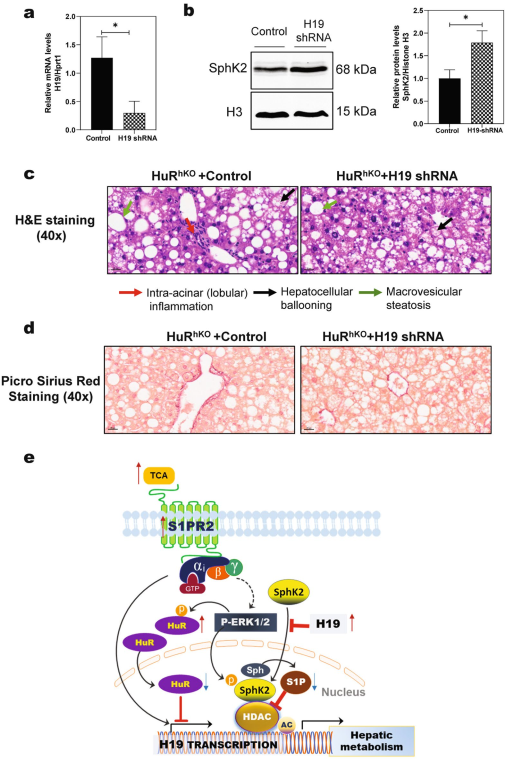
图8 H19下调缓解WDSW诱导的HuRhKO小鼠NAFLD
结论:
综上所述,本研究表明HuR通过抑制H19表达和调节SphK2核蛋白水平,在肝脏脂质代谢、肠肝胆汁酸稳态、炎症和纤维化中发挥重要的调节作用(图8e)。胆汁酸诱导的S1PR2激活也可能通过上调H19参与NASH纤维化。此外,HuR的磷酸化状态影响其在细胞内的定位。肝细胞特异性调节HuR的表达及其下游靶点H19可能被用于开发NAFLD的潜在治疗靶点。






