PLAA通过METTL3介导的TRPC3 mRNA m6A修饰抑制卵巢癌转移
广泛转移导致卵巢癌的高死亡率,了解其分子机制有助于找到转移性卵巢癌治疗的有效靶点。已发现PLAA在一些癌症中失活,但其在癌症转移中的作用尚不清楚。在此,我们发现PLAA在卵巢癌高转移细胞系和患者中显著下调,PLAA的低表达与患者的预后差和高危临床病理特征相关。在原位异种移植小鼠模型中,PLAA抑制卵巢癌细胞的迁移、侵袭和移植瘤的转移。同时,PLAA通过抑制TRPC3介导的细胞内Ca2+水平来抑制卵巢癌的转移。从机制上讲,PLAA通过泛素介导的降解抑制METTL3的表达,而METTL3 mRNA通过m6A修饰稳定TRPC3 mRNA的表达。我们的研究证实了PLAA-METTL3-TRPC3轴参与卵巢癌转移的功能和机制,以期为卵巢癌提供潜在的治疗途径。本文于2022年7月发表于“Oncogene”(IF=8.756)上。
技术路线

结果
1)卵巢癌中PLAA下调,与预后呈正相关
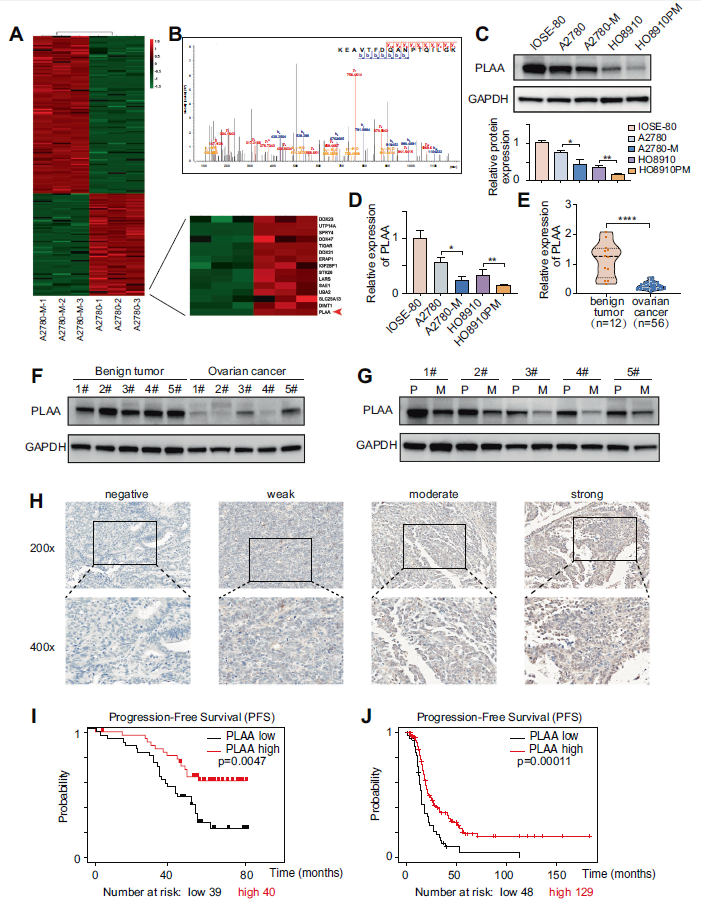
通过LC-MS/MS分析,PLAA被确定为高转移细胞中最显著下调的蛋白质之一(图1A)。PLAA的典型质谱如图1B所示。通过western blot和RT-qPCR验证了PLAA在具有不同转移能力的卵巢癌细胞系(包括A2780-M、A2780、HO8910PM、HO8910)和正常卵巢上皮细胞系IOSE-80中的内源性表达。结果表明,高转移细胞系的PLAA低于亲代细胞系,卵巢癌细胞的PLAA也低于正常卵巢细胞(图1C、D)。我们还收集了56例卵巢癌新鲜组织样本和12例卵巢良性肿瘤新鲜组织样本进行PLAA mRNA检测,发现癌组织中PLAA mRNA显著降低(图1E)。此外,卵巢癌组织中PLAA蛋白的表达显著低于良性肿瘤组织(图1F)。有趣的是,与原发性卵巢癌相比,转移性卵巢肿瘤中PLAA蛋白和mRNA的表达进一步降低(图1G)。为了了解PLAA的临床意义,我们收集了79例卵巢癌患者的临床病理资料以及他们的组织样本,并进行了免疫组化分析(图1H)。Kaplan-Meier生存分析所示,低PLAA表达患者的无进展生存期也比高PLAA表达的患者短(图1I)。我们还分析了TCGA数据库中的数据,发现了相同的结果(图1J)。我们的数据表明,低PLAA表达的患者生存期较短,PLAA可能是预测卵巢癌预后的潜在生物标记物。
2)PLAA在体内外抑制卵巢癌的迁移和侵袭
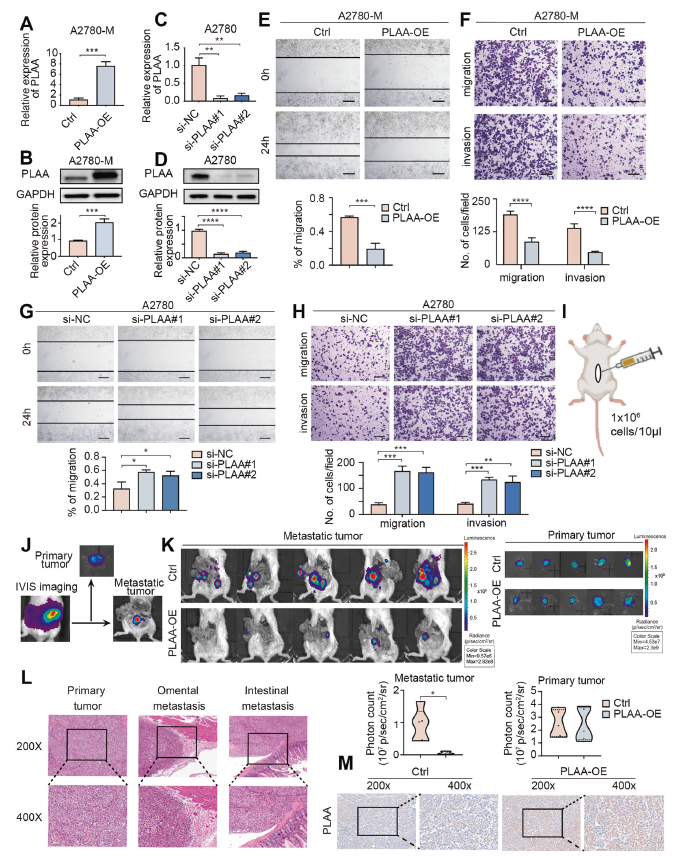
为了证实PLAA在卵巢癌中的生物学功能,建立了PLAA敲低或PLAA过表达细胞系(图2A-D)。我们发现PLAA过表达显著抑制细胞迁移和侵袭(图2E,F),而PLAA下调促进细胞迁移和侵袭(图2G,H)。接下来,我们利用原位异种移植模型研究了PLAA对卵巢癌体内转移的影响。将A2780-M-PLAA-luc或A2780-M对照-luc细胞原位注射到卵巢上皮下(图2I)。每周使用体内成像系统(IVIS)监测肿瘤进展,6周后对小鼠实施安乐死。通过摘除原发肿瘤分别评估原发肿瘤和转移肿瘤(图2J)。IVIS扫描显示,与对照组相比,PLAA过表达显著抑制了异种移植模型的转移,而不会改变其原发肿瘤(图2K)。H&E染色显示卵巢癌原发肿瘤、网膜和肠转移的典型形态(图2L)。免疫组织化学染色分析显示PLAA在原位异种移植模型中的过表达效率(图2M)。我们的研究结果表明,PLAA在卵巢癌中起到了肿瘤转移抑制作用。
3)TRPC3与PLAA表达呈负相关
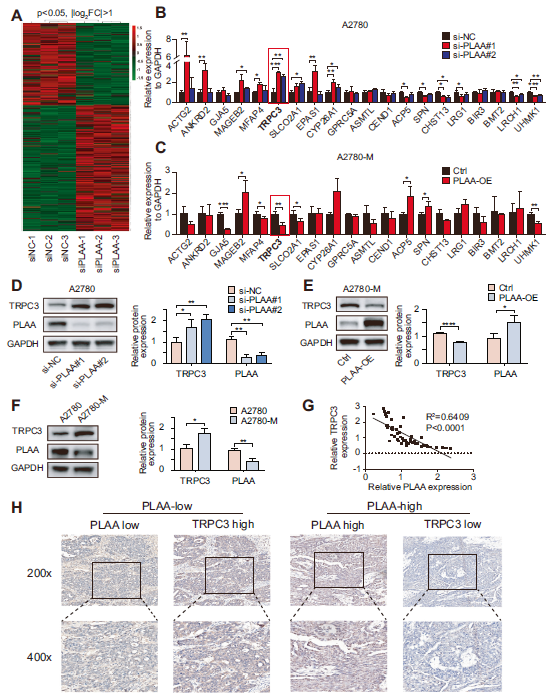
为了了解PLAA抑制卵巢癌转移的潜在机制,分别对有PLAA下调和无PLAA下调的A2780细胞进行转录组测序。分层聚类表明,PLAA敲低的细胞中有165个上调基因和109个下调基因(图3A)。我们选择了10个上调和10个下调基因,以验证它们在PLAA敲低的A2780和HO8910细胞中的表达,或在PLAA过表达的A2780-M和HO8910PM细胞中的表达,并发现在这些差异表达的基因中,TRPC3是唯一在两种细胞中以及两个PLAA siRNA中持续上调表达的基因(图3B)。相反,在PLAA过表达的A2780-M和HO8910PM细胞中,TRPC3下调(图3C)。此外,经验证,TRPC3蛋白表达在PLAA敲除时上调(图3D),在PLAA过表达时下调(图3E),以及与亲代细胞相比在高转移细胞中下调(图3G)。我们进一步发现56例癌症样本中PLAA和TRPC3 mRNA的表达呈显著负相关(图3G),IHC染色分析也显示PLAA和TRPC3呈负相关(图3H)。因此,这些结果证实TRPC3可能是卵巢癌中PLAA的潜在靶点。
4)TRPC3是一个癌基因,是PLAA的下游靶点
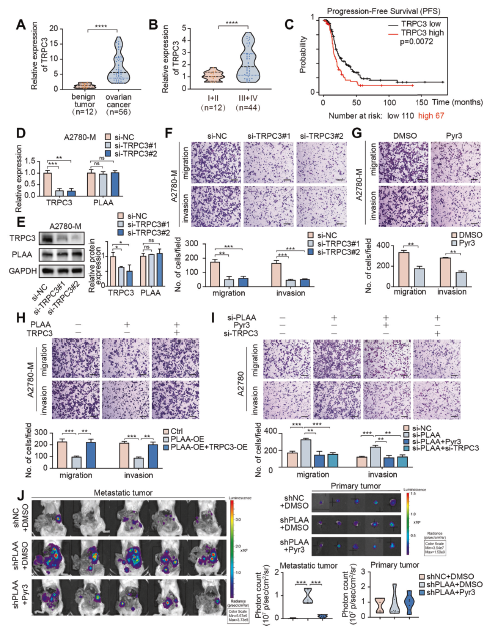
为了进一步明确TRPC3在卵巢癌中的作用,我们首先检测了临床卵巢癌样本中TRPC3的表达。我们证实,与良性卵巢肿瘤组织相比,卵巢癌组织中的TRPC3 mRNA显著上调(图4A),并且在卵巢癌组织的晚期比早期更高(图4B)。此外,TCGA数据库的Kaplan–Meier生存分析表明,较高的TRPC3表达与较短的无进展生存期相关(图4C)。因此,我们根据TRPC3的基本水平建立了TRPC3敲除或TRPC3过表达的细胞模型,并发现无论TRPC3被敲除或过表达,PLAA表达都保持不变(图4D,E),但transwell分析显示TRPC3敲低或用TRPC3抑制剂Pyr3治疗,抑制A2780-M和HO8910PM细胞的迁移和侵袭(图4F,G)。此外,我们还观察到,PLAA过表达导致的迁移和侵袭能力下降可通过TRPC3过表达恢复(图4H)。相反,TRPC3 siRNA或Pyr3处理可消除PLAA敲除加速的迁移和侵袭能力(图4I)。此外,我们发现,与对照组相比,注射A2780-shPLAA-luc的小鼠表现出更广泛的转移,通过Pyr3治疗可以显著消除转移,但在原发肿瘤中未检测到显著变化(图4J)。我们的结果表明,PLAA以TRPC3依赖的方式抑制卵巢癌转移。
5)PLAA通过降低TRPC3介导的细胞内钙水平抑制卵巢癌转移
TRPC3是一种控制钙相关信号的高钙渗透性阳离子通道。细胞内钙是一种多功能的第二信使,参与多种生物学行为,如癌细胞的增殖和转移。在含有1.8 mM游离钙的外部溶液中,我们观察到当TRPC3被敲低或用Pyr3处理时,细胞内Ca2+水平降低(图5A、B)。相反,当TRPC3过表达时,细胞内Ca2+水平增加,并且通过BAPTA-AM(一种公认的细胞内钙螯合剂)治疗恢复增加的Ca2+水平(图5C)。我们进一步观察了钙内流对TRPC3促进卵巢癌转移的作用。正如预期的那样,我们发现在经BAPTA-AM处理的A2780和HO8910细胞中,TRPC3过表达促进的迁移和侵袭被消除(图5D)。此外,IVIS扫描显示,与对照组相比,Pyr3或BAPTA-AM治疗的异种移植模型的转移受到明显抑制,但在原发肿瘤中未检测到明显变化(图5E)。此外,在含有1.8 mM游离钙的外部溶液中,我们发现TRPC3下调或BAPTA-AM处理显著降低了PLAA下调引起的细胞内Ca2+水平的升高(图5F)。正如预期的那样,BAPTA-AM也挽救了PLAA下调促进的迁移和侵袭(图5G)。我们的结果表明,PLAA通过下调TRPC3介导的细胞内钙水平抑制卵巢癌转移。
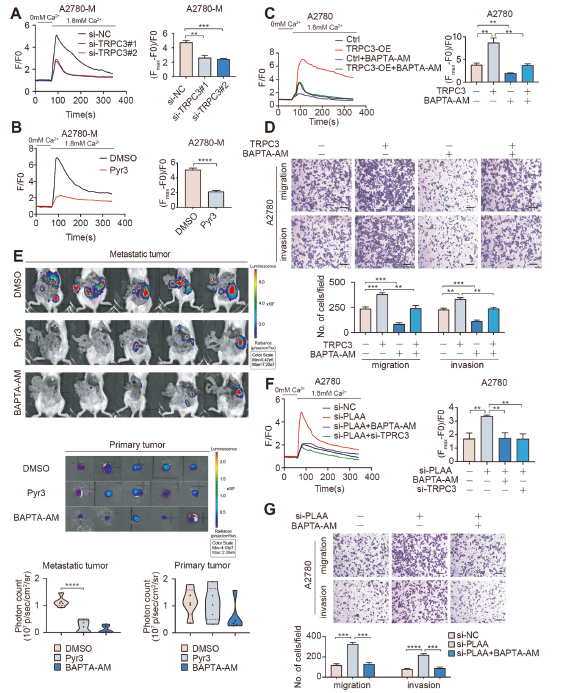
6)PLAA通过m6A修饰破坏TRPC3 mRNA的稳定性
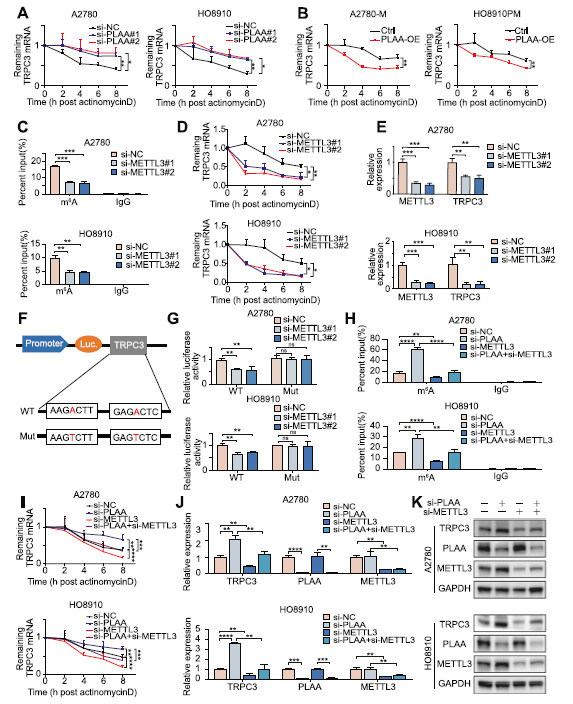
如上所述,PLAA可以直接调节TRPC3 mRNA水平。在此,我们发现PLAA敲低显著增加了TRPC3 mRNA的稳定性(图6A),而PLAA过表达发挥了相反的作用(图6B)。考虑到m6A修饰是mRNA在转录后水平的常见调节模型,包括mRNA稳定性。首先,我们敲低METTL3,并发现A2780和HO8910细胞中的TRPC3 m6A修饰水平(图6C)、mRNA稳定性(图6D)、mRNA水平(图5E)和蛋白质水平(补充图)显著降低。为了进一步证明m6A在调节TRPC3中的重要作用,我们建立了一个抗m6A修饰的突变TRPC3(图6F),并发现当METTL3沉默时,在转染TRPC3-WT质粒的细胞中,荧光素酶活性降低(图6G)。此外,为了研究PLAA是否通过m6A修饰介导TRPC3,我们进行了拯救试验,发现由PLAA缺失引起的m6A修改水平升高和TRPC3 mRNA半衰期延长被METTL3敲除所逆转(图6H,I)。此外,通过METTL3的衰减也可以恢复PLAA敲除诱导的TRPC3 mRNA和蛋白水平的升高(图6J,K)。我们的结果表明,PLAA通过m6A修饰调节TRPC3 mRNA的表达。
7)PLAA通过泛素介导途径促进卵巢癌METTL3降解
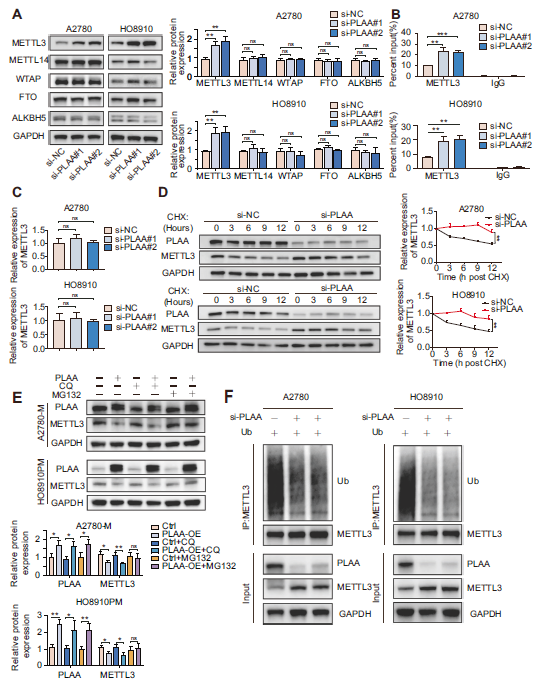
由于PLAA通过m6A修饰来调节TRPC3 mRNA的表达,因此我们检测了m6A修饰的相关蛋白。我们发现在PLAA敲低的细胞中,METTL3显著升高(图7A),这表明TRPC3 mRNA受METTL3.调节。此外,RNA免疫沉淀分析表明,与IgG对照组相比,METTL3特异性抗体显著富集了TRPC3 mRNA,而PLAA的敲除显著增强了A2780和HO8910细胞中TRPC3的mRNA富集(图7B)。考虑到PLAA下调对METTL3的mRNA水平没有影响(图7C),我们认为蛋白水平的变化可能是PLAA下调组METTL3mRNA上调的主要原因。因此,我们用环己酰亚胺(CHX)处理A2780和HO8910细胞以抑制蛋白质生物合成,并发现在PLAA敲除的细胞中METTL3蛋白的半衰期显著延长(图7D)。我们进一步观察到蛋白酶体抑制剂MG132治疗后,PLAA过表达的A2780-M和HO8910PM细胞中METTL3蛋白表达恢复(图7E)。这些结果表明METTL3是通过泛素介导的降解途径降解的。因此,我们进行泛素化实验,发现PLAA下调减少了A2780和HO8910细胞中METTL3的泛素化(图7F)。这些结果表明,PLAA通过泛素介导的降解途径抑制METTL3蛋白的表达。
结论:
我们的研究表明,下调的PLAA与卵巢癌转移和患者预后不良相关,PLAA通过调节TRPC3和细胞内钙水平抑制卵巢癌细胞的迁移和侵袭,并抑制小鼠原位异种移植的转移。PLAA通过蛋白酶体降解途径下调METTL3,METTL3-介导的m6A修饰有助于PLAA调节TRPC3 mRNA。我们的研究结果表明PLAA在卵巢癌转移中的抑制作用以及潜在机制,这可能为临床阻断卵巢癌转移提供一种潜在的途径。
参考文献:
Shen Z, Gu L, Liu Y, Wang L, Zhu J, Tang S, Wei X, Wang J, Zhang S, Wang X, Cheng X, Xie X, Lu W. PLAA suppresses ovarian cancer metastasis via METTL3-mediated m6A modification of TRPC3 mRNA. Oncogene. 2022 Aug;41(35):4145-4158. doi: 10.1038/s41388-022-02411-w.






