METTL14介导的circORC5的m6A修饰通过调节miR-30c-2-3p/AKT1S1轴抑制胃癌进展
N6-甲基腺苷(m6A) RNA甲基化和环状RNAs (circRNAs)在包括胃癌(GC)在内的多种恶性肿瘤中起着重要作用。然而,关于circRNAs的m6A修饰如何促进GC进展的知识很少。我们采用Western blot和免疫组化评估METTL14表达与胃癌患者临床病理特征和预后的关系。通过体外和体内功能实验研究METTL14在GC中的作用。通过RT-qPCR和Western blot分析,评估METTL14和(或)circORC5对miR-30c-2-3p介导的AKT1S1和EIF4B的影响。我们发现METTL14在胃癌组织样本中表达下调,其低表达是胃癌患者生存不良的前兆因素。异位表达METTL14在体内外均能显著抑制GC细胞的生长和侵袭,而敲除METTL14则具有相反的作用。机械上,m6A-circRNA转录微阵列和Me-RIP将circORC5识别为METTL14的下游靶点。沉默METTL14降低了circORC5的m6A水平,但增加了circORC5的表达。此外,circORC5可以海绵miR-30c-2-3p,并逆转METTTL14引起的miR-30c-2-3p的上调以及AKT1S1和EIF4B的下调。circORC5与miR-30c-2-3p呈负相关,在GC中生存率较低。我们的研究结果表明,METTL14介导的circORC5的m6A修饰通过调节miR-30c-2-3p/AKT1S1轴抑制胃癌进展。本文于2022年2月发表于Molecular Cancer (IF=41.444)上。
技术路线:

主要研究结果:
(1) METTL14基因下调预示GC患者预后不良
为了研究METTL14在GC中的潜在作用,我们首先分析了TCGA的RNA测序数据。结果显示,与正常组织相比,人类GC组织样本中METTL14的表达降低了(图1A,P<0.05)。我们进一步通过Western blot检测了10个配对GC组织样本中METTL14的蛋白水平,结果显示,与配对正常样本相比,GC中METTL14明显下调(图1B,C, P<0.0001)。组织芯片包含90对癌组织和匹配的正常组织,通过IHC染色分析,进一步验证了GC组织中METTL14的下调(图1D, P=0.029)。Kaplan-Meier分析发现,METTL14低表达患者的总生存率较高表达患者差(图1E, P=0.042)。从GSE22377中提取TCGA和GC患者的临床资料,建立独立的两个队列。与我们的结果一致的是,低表达的METTL14在胃癌中的生存率较低(图1E, P<0.01)。这些结果提示METTL14是GC患者的一个可靠的预后因子。

图1:胃癌患者METTL14基因下调与预后不良相关。
(2) 敲除METTL14促进了GC的增殖和侵袭
鉴于METTL14在胃癌组织中的表达减少,我们推测METTL14可能在胃癌中起抑癌作用。我们通过RT-qPCR和Western blot检测正常胃上皮细胞系(GES1)和GC细胞系(SGC-7901、MKN28、BGC-823、AGS和MGC-803)中METTL14的mRNA和蛋白水平,发现METTL14在AGS和MGC-803中高表达,而在SGC-7901中低表达(图2A)。因此,为了确认METTL14在GC中的作用,我们用siRNA在AGC和MGC-803细胞中建立了METTL14敲除细胞模型,用质粒在SGC-7901细胞中建立了METTL14过表达细胞模型。通过RT-qPCR和Western blot检测转染效率(图2B)。正如预期的那样,METTL14的敲除显著促进了细胞活力(图2C)和增殖潜能(图2D)。此外,Transwell侵袭实验显示,METTL14的下调显著促进了GC细胞的侵袭能力(图2E)。同样,与对照组相比,过表达的METTL14对细胞活力(图2C)、集落形成(图2D)和侵袭能力(图2E)均表现出抑制作用。
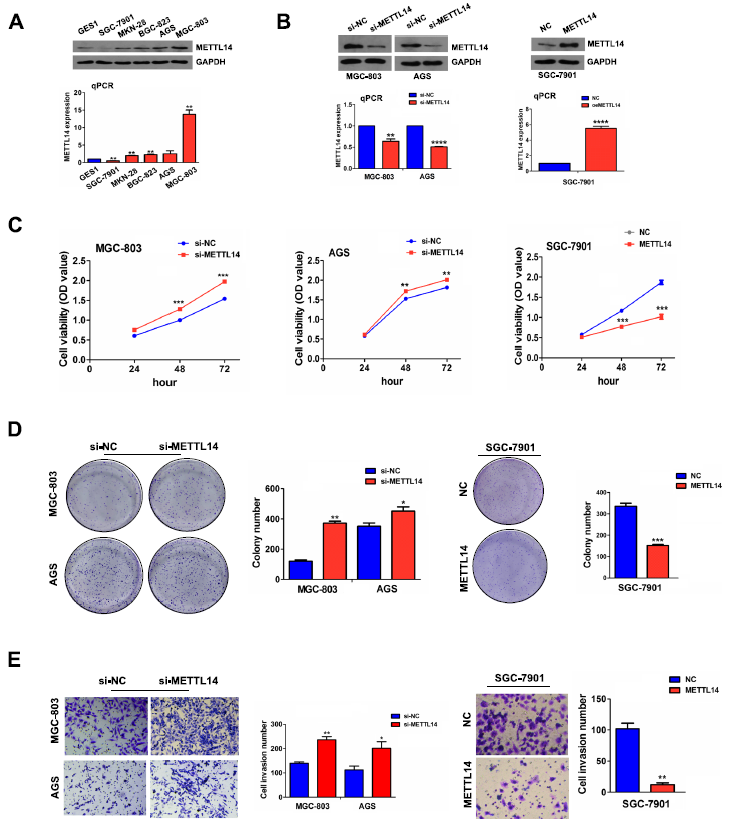
图2:METTL14基因敲除促进GC增殖和侵袭。
(3) METTL14通过circORC5的m6A依赖性修饰发挥作用
为了阐明METTL14在GC进展中的潜在机制,我们首先通过MeRIP检测了METTL14对MGC-803和AGS细胞中m6A水平的影响,结果显示METTL14敲低的MGC803和AGS细胞中m6A水平明显降低(图3A)。m6A-circRNA转录芯片显示,与对照组相比,METTL14敲低的MGC-803细胞中m6A水平升高的circRNAs有444个,m6A水平下降的circRNAs有454个(图3B),其中,hsa_circ_0030632、hsa_circ_0047481和hsa_circ_007612是METTL14敲低的细胞中m6A水平下调最多的三个circRNAs (图3C)。MeRIP-PCR进一步验证了MGC-803和AGS细胞中,METTL14的敲除降低了hsa_circ_0007612 (circORC5)的m6A水平,而不是hsa_circ_0030632和hsa_circ_0047481的m6A水平(图3D),而RT-qPCR分析显示MGC-803和AGS细胞中METTL14的敲除提高了circORC5的mRNA水平(图3E)。在功能上,我们发现circORC5的缺失降低了MGC-803和AGS细胞集落的形成和侵袭能力,并抵消了si-METTL14诱导的集落形成和侵袭潜能(图3F,G)。这些结果表明,METTL14通过circORC5的m6A依赖性修饰发挥作用。
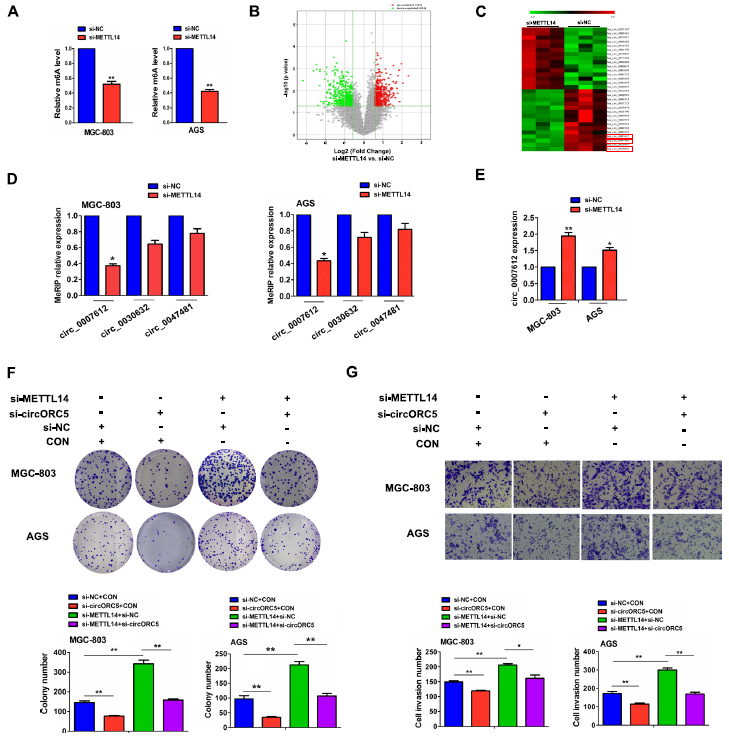
图3:METTL14通过circORC5的m6A依赖性修饰发挥作用。
(4) GC中circORC5的鉴定及特征
根据环状RNA交互组中的circRNA注释,hsa_circ_0007612来源于线性基因起源识别复合体亚基5 (ORC5),命名为circORC5(图4A)。与线性ORC5相比,经RNase R外切酶处理后,circORC5具有更高的稳定性(图4B)。细胞质和核RNA分析显示,circORC5在MGC-803和AGS细胞中优先定位在细胞质中(图4C)。FISH进一步验证了circORC5的绿色荧光分布主要在GC的细胞质中(图4D),与相邻正常组织相比,circORC5在GC组织中的表达增加(图4E)。Kaplan-Meier发现,与circORC5低表达的GC患者相比,circORC5高表达的GC患者生存期较差(图4F)。
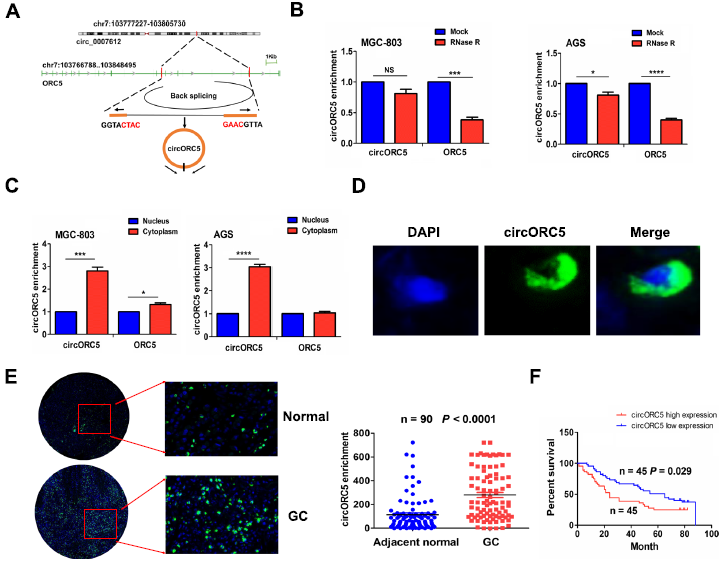
图4:circORC5的鉴定及特征。
(5) circORC5与GC中miR-30c-3p呈负相关
根据m6A-circRNA谱分析和miRbase,我们发现circORC5具有与5种miRNAs结合的潜力(图5A)。我们分析了这五种miRNAs在GC中的表达水平,发现miR-30c-2-3p在387个未配对的GC组织和41个配对的GC组织中下降最为显著(图5B, P<0.0001)。FISH分析进一步证实,miR-30c-2-3p表达水平在GC组织中显著下调,且与circORC5呈负相关(图5C,D)。FISH分析表明,circORC5也定位于GC组织的细胞质中(图5E)。
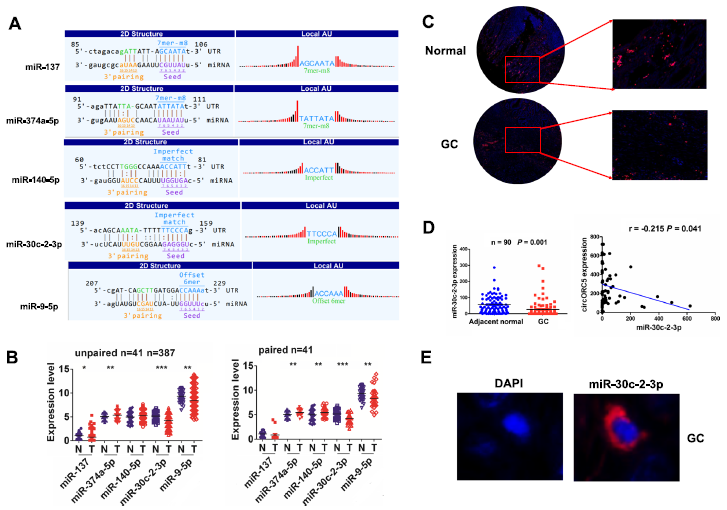
图5:circORC5在GC中与miR-30c-2-3p呈负相关。
(6) circORC5在GC中充当miR-30c-2-3p的海绵
图6A显示了miR-30c-2-3p与circORC5的结合位点。我们发现,在MGC-803和AGS细胞中,与miR-NC组相比,miR-30c-2-3p模拟物可以降低WT circORC5 3'-非翻译区(UTR)的荧光素酶活性,但对Mut circORC5 3'-UTR的荧光素酶活性没有影响(图6B)。RT-qPCR分析显示,MGC-803和AGS细胞中,circORC5敲低或METTL14过表达可显著增加miR30c-2-3p的表达(图6C),但miR-30c-2-3p模拟物对circORC5表达无影响(补充图未展示)。此外,我们在MGC-803和AGS细胞中对Ago2进行RNA免疫沉淀(RIP),并通过RT-qPCR分析从Ago2表达的细胞中拉下的内源性circORC5和miR-30c-2-3p水平,结果表明,与输入对照组相比,Ago2颗粒中circORC5和miR-30c-2-3p高度富集(图6D,E)。在功能上,miR-30c-2-3p抑制剂促进了MGC-803和AGS细胞的细胞活力,逆转了circORC5敲除诱导的抗增殖作用(图6F)。
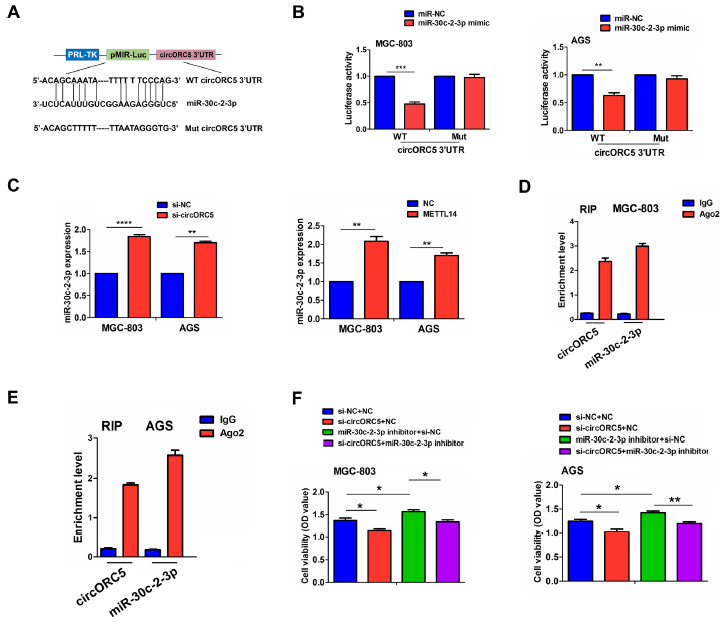
图6:circORC5在GC中充当miR-30c-2-3p的海绵。
(7) METTL14介导circORC5调节miR-30c-2-3p/AKT1S1轴
为了验证METTL14是否介导circORC5调节miR-30c-2-3p的表达,RT-qPCR分析显示,在MGC-803和AGS细胞中,下调circORC5增加了miR-30c-2-3p的表达,逆转了下调METTL14对miR-30c-2-3p表达的抑制作用(图7A)。接下来,我们将AKT1底物1 (AKT1S1)和真核翻译起始因子4B (EIF4B)确定为miR-30c-2-3p的靶点,并将miR-30c-2-3p与AKT1S1/EIF4B潜在结合位点的示意图列出(补充图未展示)。我们进一步发现,在MGC-803和AGS细胞中,与miR-NC组相比,miR-30c-2-3p模拟物可以降低WT AKT1S1和EIF4B 3’UTR的荧光素酶活性,但对Mut AKT1S1和EIF4B 3’UTR的荧光素酶活性没有影响(图7B,C)。同时,miR-30c-2-3p模拟物可下调AKT1S1和EIF4B的表达(图7D,E)。进一步的Western blot显示,METTL14敲低显著上调MGC-803和AGC细胞中AKT1S1和EIF4B的表达,而这种影响可通过敲低circORC5逆转(图7E)。
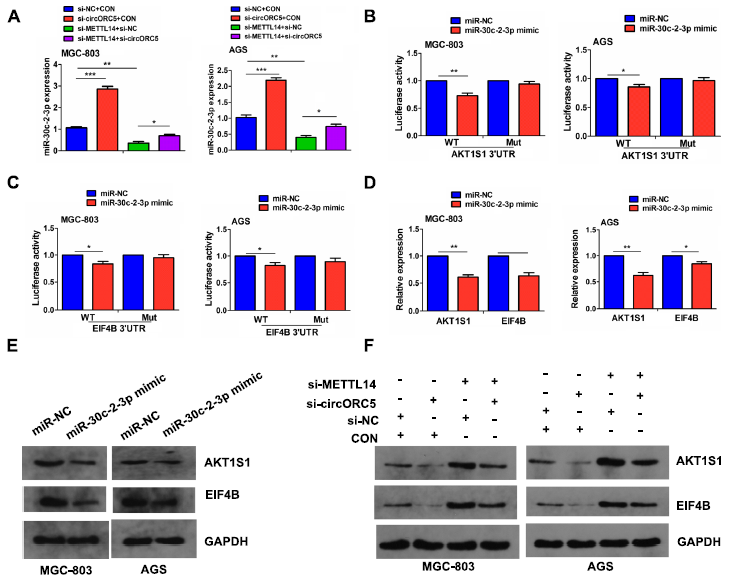
图7:METTL14介导circORC5调节miR-30c-2-3p/AKT1S1轴。
为了研究METTL14在体内是否抑制肿瘤生长,我们建立了稳定转染METTL14或NC的SGC-7901细胞系,然后将其皮下注射到裸鼠的腹部。观察33天后,我们发现,转染METTL14的SGC-7901细胞诱导的移植瘤体积小于转染NC的细胞(图8A)。生长曲线显示,METTL14转染组肿瘤呈时间依赖性减少(图8B),与NC组相比,METTL14转染组肿瘤体积和重量均有所减轻(图8C)。HE和IHC染色显示,与NC组相比,METTL14转染组肿瘤增殖标志物Ki-67下调(图8D)。
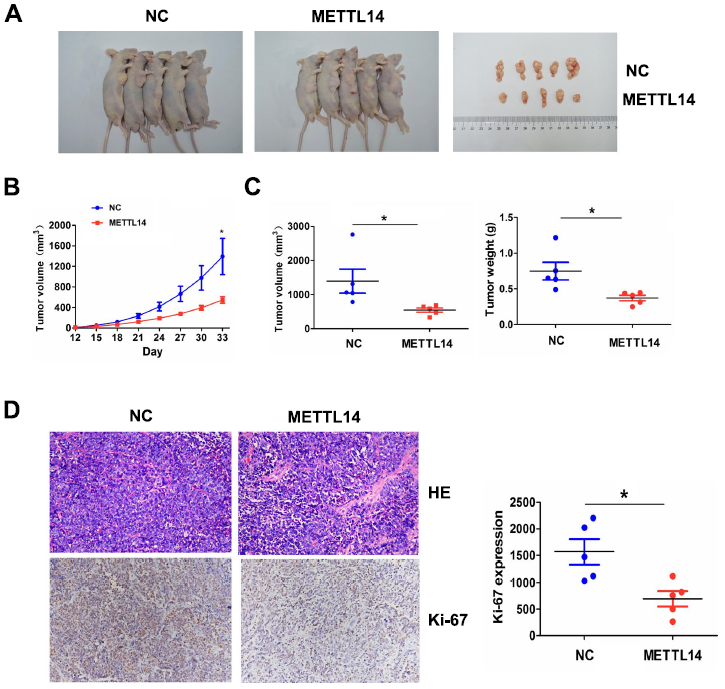
图8:METTl14在体内抑制肿瘤生长。
结论:
在本研究中,我们发现miR-30c-2-3p或circORC5的敲除会降低ElF4B和AKT1S1的表达,circORC5的缺失逆转了METTL14敲除对GC细胞中ElF4B和AKT1S1表达的促进作用。结果表明,METTL14通过提高circORC5的m6A水平和降低其表达来抑制GC的生长,circORC5海绵化miR-30c2-3p并上调ElF4B和AKT1S1,促进GC的肿瘤发生(图9)。综上所述,METTL14的下调与胃癌患者的生存率差相关,METTL14介导的circORC5的m6A修饰通过调节miR-30c-2-3p/AKT1S1轴抑制胃癌细胞的生长和侵袭,可能为胃癌提供一个有希望的预后因子。
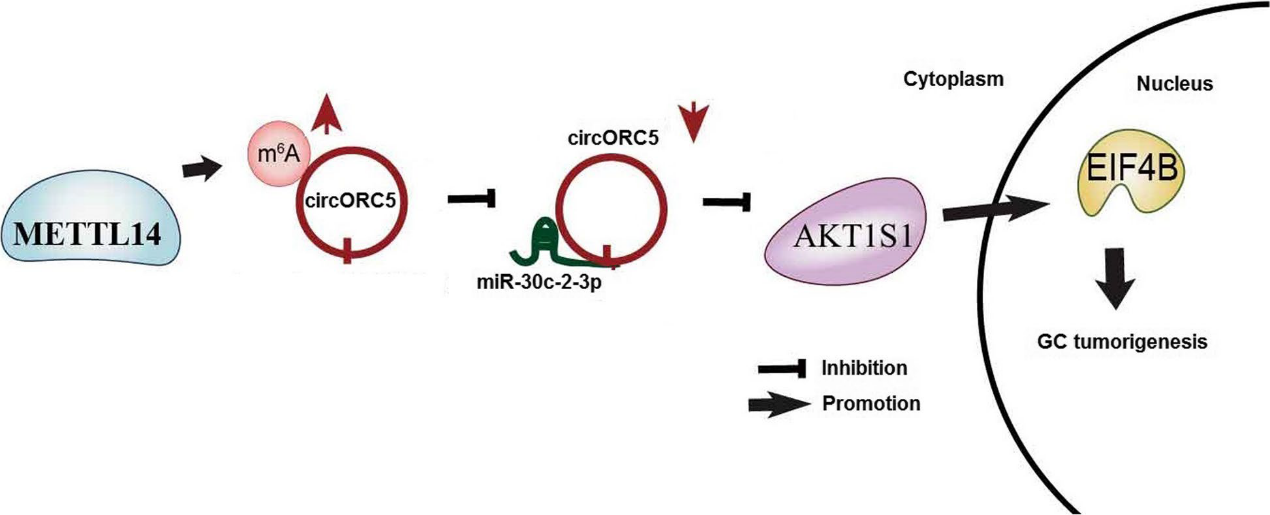
图9:GC中的METTL14机制示意图。METTL14增加了circORC5的m6A水平,抑制了circORC5的表达,从而上调了miR-30c-2-3p,下调了AKT1S1和EIF4AB,抑制了GC的进展。
参考文献:Fan, H. N., Chen, Z. Y., Chen, X. Y., Chen, M., Yi, Y. C., Zhu, J. S., & Zhang, J. (2022). METTL14-mediated m6A modification of circORC5 suppresses gastric cancer progression by regulating miR-30c-2-3p/AKT1S1 axis. Molecular cancer, 21(1), 51. https://doi.org/10.1186/s12943-022-01521-z.






