VEGF糖基化参与血管生成
N-糖基化和二硫键的形成是蛋白质折叠的两个重要步骤,它们发生在内质网(ER)中,相互影响。本研究为分析N-糖基化和氧化之间的相互作用,研究了蛋白质二硫氧化酶ERO1-α如何影响血管生成VEGF121的糖基化,VEGF121是血管稳态的关键调节因子。本研究揭示ERO1丢失对蛋白质N-糖基化的影响不仅与血管生成有关,而且与其他癌症病理机制有关。本研究于2022年10月发表在《Redox Biology》IF:10.787期刊上。
技术路线:
实验结果:
1、ERO1敲除的细胞氧化能力减弱氧化键形成受损
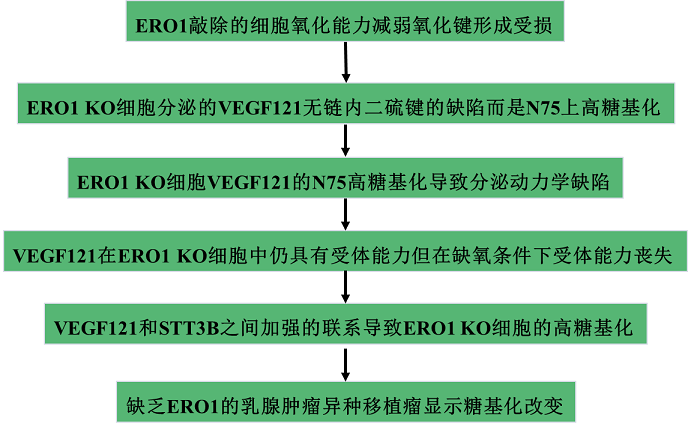
为了跟踪WT和ERO1 KO HeLa细胞中ER的氧化还原平衡,利用比例氧化还原传感器ER定位的roGFP2。如图1A所示,在WT和ERO1 KO细胞中,DTT刺激后ER roGFP2迅速减少;然而,在还原剂的洗脱过程中,ERO1 KO细胞表现出较慢的恢复速度,而WT细胞的氧化平衡恢复得很快,ERO1 KO细胞在40分钟内未达到WT细胞的氧化平衡基线值,这表明缺乏ERO1会损害ER的氧化平衡。
为评估ERO1缺失对ER中二硫键形成速率的影响,作者构建了FLAG-VEGF121,它被组装成二硫连接的同型二聚体(图1B),并比较了在WT和ERO1 KO细胞中,在蛋白合成抑制剂CHX脉冲作用后,细胞内形成二硫连接的同型二聚体的速率。结果显示,FLAG-VEGF121在WT和ERO1 KO细胞中的积累程度相似;然而,虽然在WT细胞中二聚体是所有时间点的主要物质,但在ERO1 KO细胞中,二聚体的生成速度较慢,单体在冲洗过程中积累,表明单体转化为二聚体的速度较慢(图 1C)。 因此,由ERO1损失引起的氧化平衡的改变转化为 VEGF121 二硫键形成速率的损害。
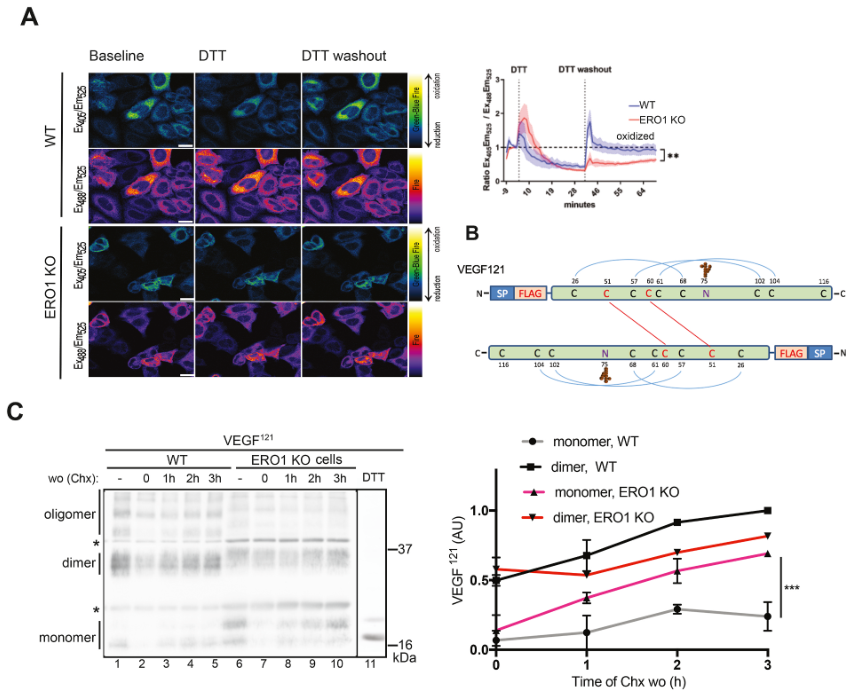
图1ERO1 KO细胞中氧化能力受损和VEGF121二硫键形成延迟
2、ERO1 KO细胞分泌的VEGF121无链内二硫键的缺陷而是N75上高糖基化
为分析WT和ERO1 KO HeLa细胞分泌的FLAG-VEGF121,收集两细胞系的条件培养基,用N -乙基马来酰亚胺(NEM)烷基化,然后用FLAG-M1抗体免疫沉淀。免疫沉淀采用非还原SDS-PAGE分析。经考马斯蓝染色发现WT细胞的FLAG-VEGF121有三个主要条带,对应于VEGF121的二聚体和寡聚体,而ERO1 KO细胞的FLAG-VEGF121只有两个条带,即一个微弱的寡聚体和一个比WT细胞分泌的慢的迁移二聚体(图2A)。从凝胶中分离这些条带,DTT还原并用碘乙酰胺(IAA)烷基化,这一处理导致二硫键中半胱氨酸被标记,导致氨基甲基(CAM)富集,最后进行nLC-ESI-MS/MS(图2B)。裂解肽的质谱显示,WT和ERO1 KO分泌的FLAG-VEGF121在NEM和IAA肽烷基化方面没有太大差异。例如,参与VEGF121链内二硫键的C68只以氧化形式存在于WT和ERO1 KO细胞的VEGF121中;C102也参与VEGF121的链内二硫键,在WT和ERO1 KO细胞的VEGF121中均以混合还原和氧化状态检测到,这表明在ERO1 KO细胞中FLAG-VEGF121的分子内二硫键没有缺陷(图2B)。
使用NetNGlyc在线软件预测VEGF121 氨基酸序列的共有序列 NIT 内75号位处存在N-糖基化位点。因此,作者假设图2A迁移较慢的条带是N-糖基化的产物,并使用糖苷内切酶对此进行测试。如图2C所示,WT和ERO1 KO细胞的FLAG-VEGF121对内糖苷酶H (ENDO H)不敏感,但对肽- N -糖苷酶F (PNGase F)敏感,导致快速迁移的蛋白质消失。这些结果表明,迁移较慢的多肽含有N -链寡糖,在高尔基体中已经成熟,从而获得了对EndoH的抗性。用PNGase F(一种酰胺酶)处理后,糖基化Asn残基被脱酰胺。对WT和ERO1 KO细胞中FLAG-VEGF121二聚体和寡聚体的片段肽进行质谱分析,然后用PNGase F酶切,证实天冬酰胺N75被糖基化,除了来自WT细胞的低聚物2(图2D)。挽救实验证实了ERO1在限制糖基化中的作用。在 ERO1 KO 细胞中转染ERO1或其高活性突变体ERO1C131A的表达质粒,通过改变糖基化形式占总量的 80% 至 40%,拯救了ERO1 KO细胞分泌的FLAG-VEGF121的N-高糖基化(图2E)。

图2 ERO1 KO细胞分泌的VEGF121链内二硫键和N-高糖基化
3、ERO1 KO细胞VEGF121的N75高糖基化导致分泌动力学缺陷
接下来比较VEGF121在WT和ERO1 KO细胞的分泌动力学,并研究N-高糖基化如何影响这一过程。结果发现ERO1 KO细胞分泌VEGF121的动力学受损,在最后两个时间点达到平台期(图3A)。为研究该损伤是否由于高糖基化,构建一个突变体,其中N75被Gln残基(N75Q)取代。发现VEGF121突变体在WT和ERO1 KO细胞中表达时都没有糖基化(图3B)。值得注意的是,该突变体在WT和ERO1 KO细胞中的分泌动力学相当,而在ERO1 KO细胞中的分泌受影响较小(图3C-3D),表明N75的高糖基化是ERO1 KO细胞中FLAG-VEGF121分泌受损的基础。
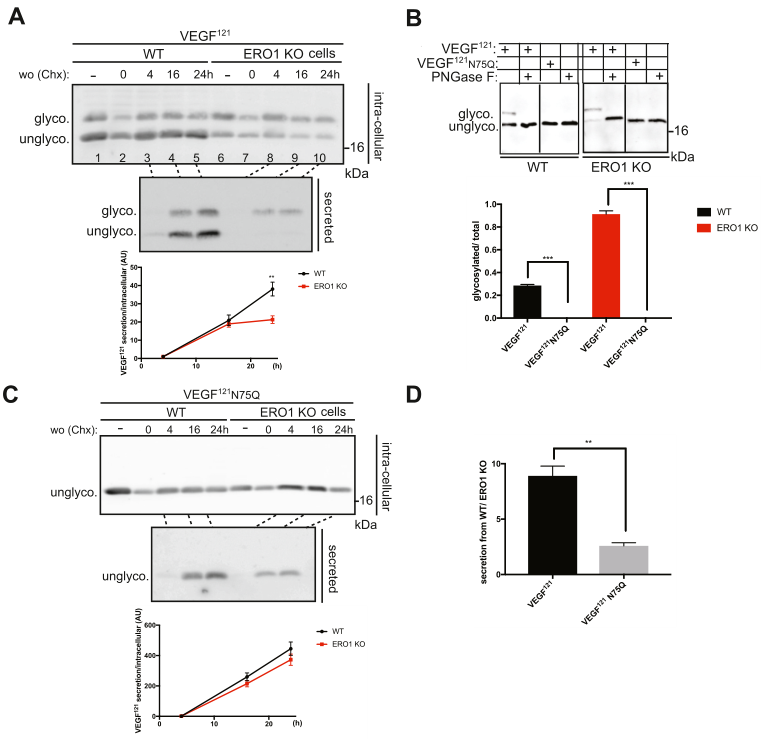
图3 ERO1 KO细胞分泌的VEGF121的N75高糖基化损害其其分泌动力学
4、VEGF121在ERO1 KO细胞中仍具有受体能力但在缺氧条件下受体能力丧失
突变为FLAG-VEGF121的C60 (C60S)或C68 (C68S)丝氨酸,分别参与链间和链内二硫键(图1B),增加了WT细胞分泌的VEGF121的N-糖基化,表明VEGF中二硫键形成的受损改善了其N -糖基化(图4A)。与未突变的VEGF121相比,WT细胞中C60的分泌不受影响,而C68的分泌受损60%(图4A)。当ERO1 KO细胞分泌两种突变体C60和C68时,未观察到高糖基化,表明ERO1缺失是VEGF121糖基化的主要影响。与相同细胞中未突变的VEGF121相比,ERO1 KO细胞中C60的分泌不受影响,而C68的分泌受损85%,WT细胞中C68的分泌受损更严重(图4A)。
利用表面等离子体共振(SPR)来确定Aflibercept的不同形式VEGF121的相对解离常数(KD),这是一种亲和力的测量方法,Aflibercept是人IgG1的Fc区与VEGF两受体VEGFR1和R2之间的融合蛋白。结果表明,ERO1 KO细胞分泌的VEGF121对受体的亲和力大约是WT细胞分泌的VEGF121的2倍(但无统计学差异),但突变的VEGF121 C60S的亲和力是WT细胞分泌的VEGF121 C68S的6倍,而突变的VEGF121 C68S则完全不与受体结合。表明,来自ERO1 KO细胞的VEGF121仍然具有受体活性,排除了其大规模氧化展开的可能(图4B)。
在低氧条件下,WT细胞分泌的VEGF121在糖基化或分泌量方面与正常缺氧条件下分泌的VEGF121相比,差异可以忽略不计(图4C)。此外,其KD在数量上与常氧条件下分泌的对应物相似(图4D)。相反,在缺氧条件下,ERO1 KO细胞中VEGF121的分泌量受到严重影响(图4C),这表明在ERO1缺失的条件下,VEGF121的成熟和分泌特别依赖氧气。此外,KD降低两倍表明缺氧条件下ERO1 KO细胞VEGF121受体能力进一步受损(图4D)。
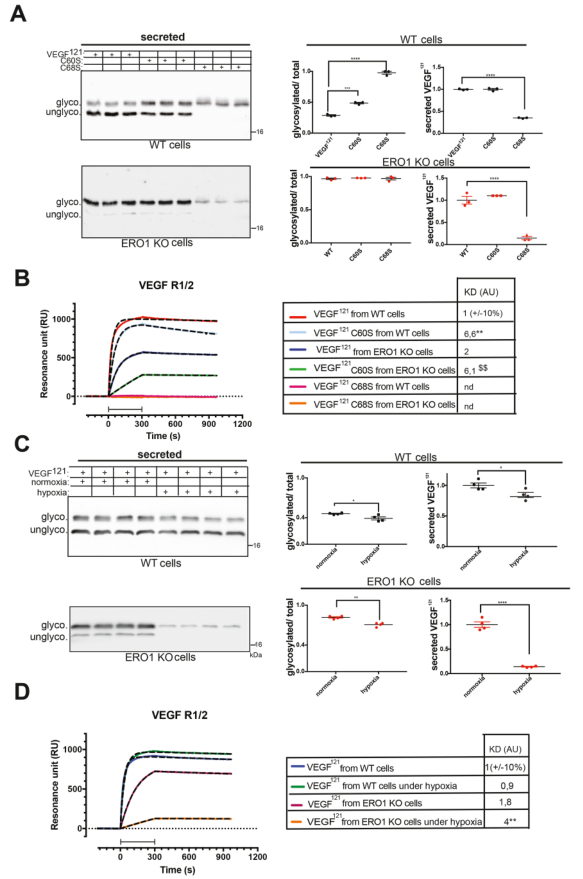
图4 ERO1 KO细胞的VEGF121具有受体能力但在缺氧条件下其受体能力受损
5、VEGF121和STT3B之间加强的联系导致ERO1 KO细胞的高糖基化
正如已经观察到的,在ERO1 KO细胞中,细胞内VEGF121以及分泌形式都是高糖基化的。然而,与分泌型VEGF121不同的是,N-糖基化的细胞内形式对EndoH和PNGaseF都敏感(图5A)。在WT和ERO1 KO细胞中,VEGF121对两种内糖苷酶的敏感性没有差异,这表明在稳定状态下,两种细胞系中大多数细胞内VEGF121都没有通过高尔基体过渡。细胞内FLAG-VEGF121 C68S和C68S的表现与WT细胞中高糖基化的分泌对应物非常相似,与ERO1 KO中的原生形式没有相关差异(图5B)。为从分子层面深入了解VEGF121高糖基化的原因和/或后果,分析了VEGF121在WT和ERO1 KO细胞中的相互作用物。转染VEGF121、VEGF121C60S和VEGF121C68S的WT和ERO1 KO细胞的蛋白裂解物用FLAG M1抗体免疫沉淀后SDS-PAGE电泳。在考马斯蓝凝胶中,可以看到贯穿泳道的一系列条带(图5C)。
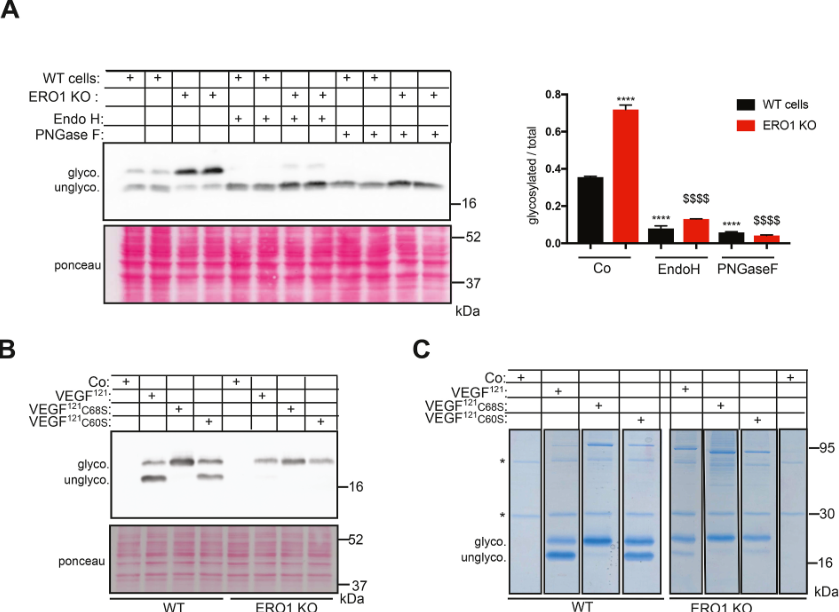
图5 在ERO1 KO和半胱氨酸突变体中细胞内VEGF121高糖基化
对图5C的每个泳道进行单独的切除和消化,将洗脱后的多肽进行nLC-ESI MS/MS分析,从而鉴定出VEGF121相互作用分子。对ERO1 KO细胞中VEGF121、VEGF121C60S和VEGF121C68S相互作用分子的通路分析表明,主要富集至通过天冬酰胺进行N-链糖基化的通路(图6A)。研究发现,在ERO1 KO细胞中,含有硫氧还蛋白结构域的STT3B复合物亚基MAGT1与所有三个VEGF121相互作用(图6B)。基于此,作者决定关注VEGF121C68S,因为C68中的突变是最接近糖基化Asn的,因此,其糖基化应该受MAGT1影响较小。免疫沉淀证实,VEGF121和VEGF121C68S在WT和ERO1 KO细胞中均存在MAGT1免疫反应带(图6C)。用MAGT1-HA转染的WT和ERO1 KO细胞的NEM烷基化允许在非还原免疫印迹上解析 MAGT1 的不同氧化还原形式。来自ERO1 KO细胞的MAGT1出现在大约52 kDa的缓慢迁移带中,这在 WT 细胞中不可见,表明 MAGT1 在 ERO1 KO 细胞中的氧化还原介导的相互作用(图6D)。在WT和ERO1 KO细胞中,MAGT1和STT3B的缺失导致VEGF121和VEGF121C68S的低糖基化,表明VEGF121及其突变体都是STT3B/MAGT1的底物(图6E)。然而,VEGF121C68S(最接近天冬酰胺的半胱氨酸突变体)的N-糖基化对 STT3B/MAGT1干扰不敏感。这些发现表明,ERO1缺失通过MAGT1增强了STT3B与VEGF121底物之间的相互作用,导致其N-高糖基化。

图6 ERO1-KO细胞中VEGF121及其半胱氨酸突变体与MAGT1的相互作用增强
6、缺乏ERO1的乳腺肿瘤异种移植瘤显示糖基化改变
为探究ERO1在肿瘤中的生理性影响,构建ERO1缺失或未缺失的三阴性乳腺肿瘤模型。用两种具有不同糖特异性的凝集素:小麦胚芽凝集素(WGA)和隔离素B4(IB4)对异种移植物切片进行染色。结果如图7所示,虽然IB4染色在两种基因分化肿瘤中表现相似,但ERO1 KO细胞中的WGA染色平均比WT细胞高1.5倍,并在KO细胞中表现出斑片状聚集模式。对这些肿瘤簇所占体积的定量分析显示KO肿瘤与WT肿瘤相比增加了5倍,表明ERO1缺陷在调节糖基化方面具有广泛的作用。

图7 ERO1-KO乳腺肿瘤表现为N-高-糖基化蛋白模式
综上所述,本研究证实ERO1缺失会导致较少的氧化ER氧化还原平衡。这导致 VEGF121中二硫键形成延迟,这有利于其N-高糖基化并增加MAGT1捕获潜力,进一步增加其在N75上的糖基化。这反过来减慢了ERO1耗尽细胞中生长因子的分泌,如图8所示。
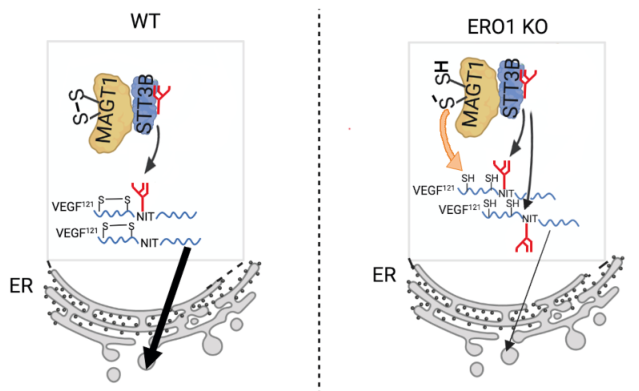
图5 机制模式图
参考文献:
Varone Ersilia., Chernorudskiy Alexander., Cherubini Alessandro., Cattaneo Angela., Bachi Angela., Fumagalli Stefano., Erol Gizem., Gobbi Marco., Lenardo Michael J., Borgese Nica., Zito Ester.(2022). ERO1 alpha deficiency impairs angiogenesis by increasing N-glycosylation of a proangiogenic VEGFA. Redox Biol, 56(undefined), 102455. doi:10.1016/j.redox.2022.102455






