磷脂酶调控线粒体,改善肥胖的一大妙招
线粒体是真核生物进行氧化代谢的部位,是糖类、脂肪和氨基酸最终氧化释放能量的场所。磷脂酶D2(PLD2)通过其酶活性调节肿瘤细胞的增殖和迁移。然而,PLD2在肥胖和2型糖尿病中的作用此前没有被研究过。本研究强调靶向脂肪细胞中的PLD2,通过提升线粒体的质量和数量增强生热程序,解决饮食诱导的产热缺陷。本研究于2022年2月发表于《J Exp Med》IF=17.579期刊上。
技术路线:

主要研究结果:
1、脂肪细胞中PLD2与UCP1呈负相关
作者首先检测PLD亚型在不同脂肪组织中的表达,调查PLD在脂肪组织中的作用。腹股沟白色脂肪组织(ingWAT)和棕色脂肪组织(BAT)中PLD1和PLD2 mRNA水平高于附睾白色脂肪组织(epiWAT)中PLD1和PLD2 mRNA水平(图1)。作者接着探究在急性膳食诱导的生热和肥胖中PLD亚型的表达的改变。有趣的是,长时间高脂肪饮食(HFD)喂养的小鼠BAT中UCP1(解偶联蛋白1)和PLD2水平成负相关(图1B)。然而,PLD1在蛋白水平上没有检测到,(图1B)。类似地,在热中性条件下(30℃)解除热应激的小鼠中,HFD喂养四周后,BAT中UCP1水平增加,但PLD2水平减少(图1C)。
膳食诱导的生热被认为是由交感神经系统(SNS)及随后β肾上腺素能受体(βARs)介导的。因此,作者研究SNS和βARs的刺激是否足以压制PLD2水平。寒冷暴露(SNS和βAR激活)或β3AR兴奋剂CL316, 243(CL)处理在室温和热中性下均显著降低PLD2的表达,再次显示出与BAT和ingWAT中UCP1水平的负相关关系(图1D,E)。正如预想的一样,SNS和βARs的激活也降低PLD活性(图1F)。
作者发现热中性条件下4周的HFD增加BAT和ingWAT中的蛋白酶体活性(图1G)。β3AR拮抗剂SR59230A或蛋白酶体抑制剂硼替佐米,而不是溶酶体抑制剂氯喹,逆转了βAR兴奋剂异丙肾上腺素诱导的原代棕色脂肪细胞中PLD2的减少(图1H和I)。这表明在饮食诱导的产热过程中蛋白酶体活性的增加可能会诱导PLD2降解。然而,HFD喂养12周逆转了蛋白酶体活性的增加(图1J),与HFD喂养4周相比,HFD喂养12周小鼠UCP1水平的逆转一致(图1B)。上述所有结论表明在适应性产热过程中观察到PLD2降解;然而,蛋白酶体活性的钝化和长期HFD喂养后PLD2的补偿性增加可能是PLD2在脂肪组织中的表达增加的原因。
在本研究中,作者发现在适应性产热过程中,PLD2在BAT上降解。异丙肾上腺素诱导的PLD2减少被硼替佐米阻断,但氯喹不阻断(图1I),这表明βAR兴奋剂刺激的PLD2减少是由棕色脂肪细胞中的蛋白酶体途径介导的。此外,异丙肾上腺素诱导的PLD2降解被SR59230A阻断(图1H),提示β3AR在这一过程中起关键作用。这些结果表明适应性产热过程中β3AR的激活可能通过蛋白酶体途径导致PLD2的降解。

图1 HFD喂养后脂肪组织中PLD2的表达与UCP1的表达呈负相关
2、PLD2调节脂肪组织中的生热程序
基于PLD2和UCP1水平的负相关关系,作者询问PLD2是否抑制脂肪组织中的生热程序。在PLD2 Ad-KO小鼠中,与对照窝鼠相比,ingWAT和BAT呈现更深的红色(棕色)和更高的线粒体和产热程序基因诱导(图2A,B),这也得到H&E和UCP1组织染色的支持(图2C)。PLD2 Ad - KO小鼠在BAT中表现出更高的温度,并在4小时冷暴露中保持更高的直肠温度(图2D,E),这支持了PLD2在产热程序中的作用。此外,注射PLD2特异性抑制剂CAY10594 7天的小鼠也产生与PLD2 Ad - KO小鼠相似的产热棕色和米色脂肪(图2F-H),提示PLD2酶活性参与脂肪组织的产热激活。
标准化为瘦体重,脂肪组织中PLD2的耗竭或抑制在黑暗阶段增加EE(脂肪消耗),而且不影响呼吸交换率(RER)、自发活动或食物摄入量(图2I-L)。此外,在22℃或热中性条件下,在一次注射βAR兴奋剂CL后,PLD2 Ad - KO小鼠的最大产热能力显著高于对照组(图2M)。总之,这些结果表明脂肪组织中的PLD2通过抑制其产热能力来抑制EE。
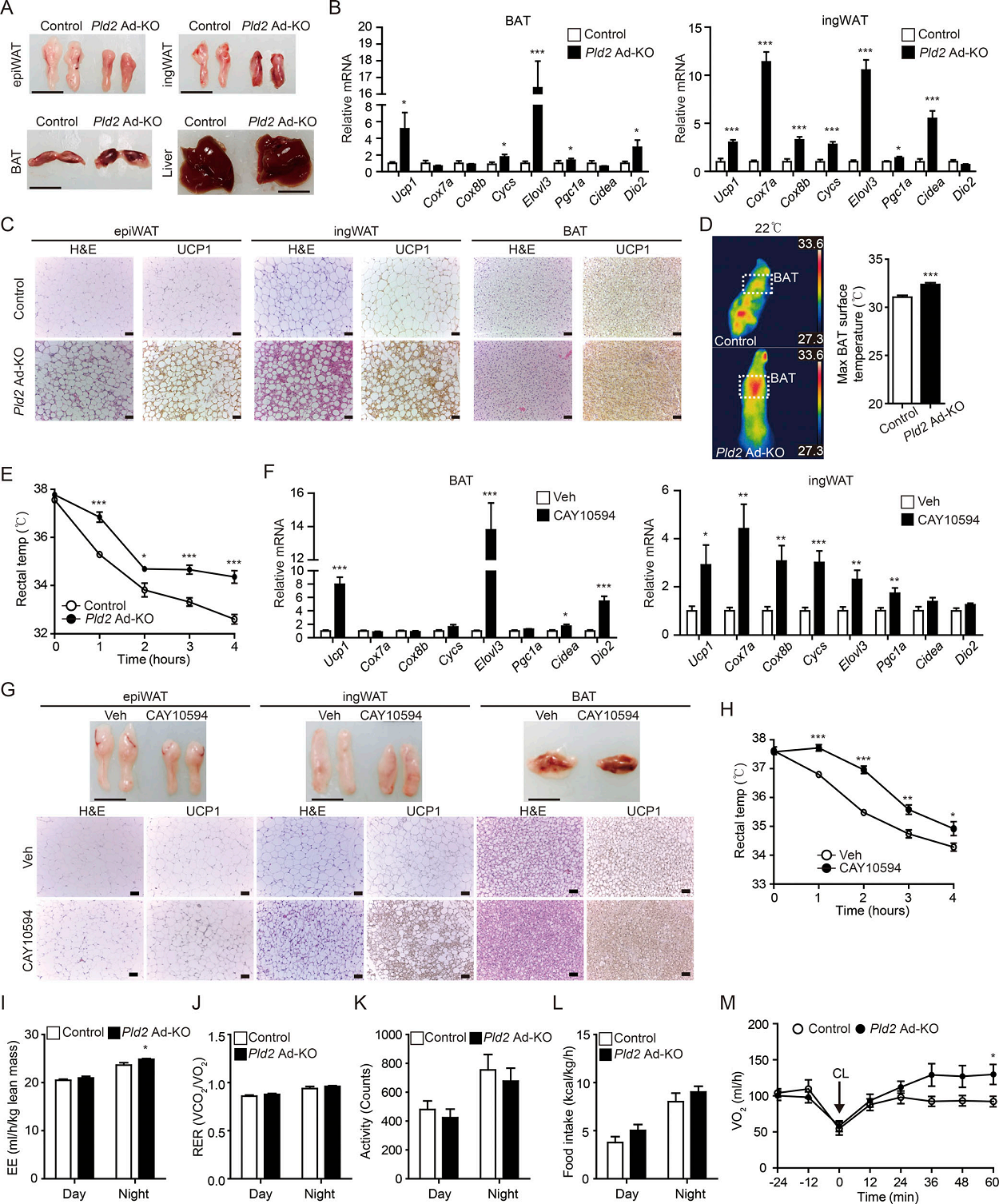
图2脂肪细胞特异性PLD2缺乏或药物抑制激活脂肪组织中的生热程序
3、脂肪细胞PLD2消融或药物抑制可抵抗HFD诱导的肥胖和胰岛素抵抗
作者下面研究CAY10594在诱导轻度肥胖后对小鼠的治疗作用(图3A)。CAY10594处理10周的肥胖小鼠,可以在不影响摄食量的情况下抑制体重增加(图3B-D)。在肥胖小鼠中抑制PLD2活性显著降低脂肪质量以及epiWAT、ingWAT和肝脏的组织重量(图3E-F)。众所周知HFD诱导的表型肥胖,如脂肪肝和脂肪细胞肥大的组织学证据在注射CAY10594的小鼠在HFD上被阻止(图3G)。与降低肥胖一致,在肥胖小鼠中注射CAY10594增强暗期的EE(图3H)。重要的是,在饮食诱导的肥胖过程中抑制PLD2显著改善口服葡萄糖耐量和胰岛素敏感性(图3I-J)。
接下来作者探索脂肪细胞特异性敲除PLD2对HFD诱导的肥胖的影响。与对照小鼠相比,PLD2 Ad - KO小鼠对HFD诱导的肥胖具有抵抗力(图3K-L),尽管食物摄入量与没有差异(图3M)。与对照小鼠相比,PLD2 Ad - KO小鼠的脂肪质量、脂肪组织重量以及脂肪组织和肝脏中的脂质积累在HFD处理12周后有所减少(图3N-R)。脂肪组织中PLD2的耗竭,无论喂食或禁食都降低葡萄糖和胰岛素水平(图3S-T)。与此一致的是,与对照组小鼠相比,HFD喂养的PLD2 Ad - KO小鼠的糖代谢和胰岛素敏感性有所改善(图3U-V)。脂肪细胞特异性敲除PLD2增强胰岛素刺激的Akt和GSK3 β磷酸化(图3W)。这些结果表明,靶向PLD2活性可以预防饮食诱导的肥胖和葡萄糖不耐受。
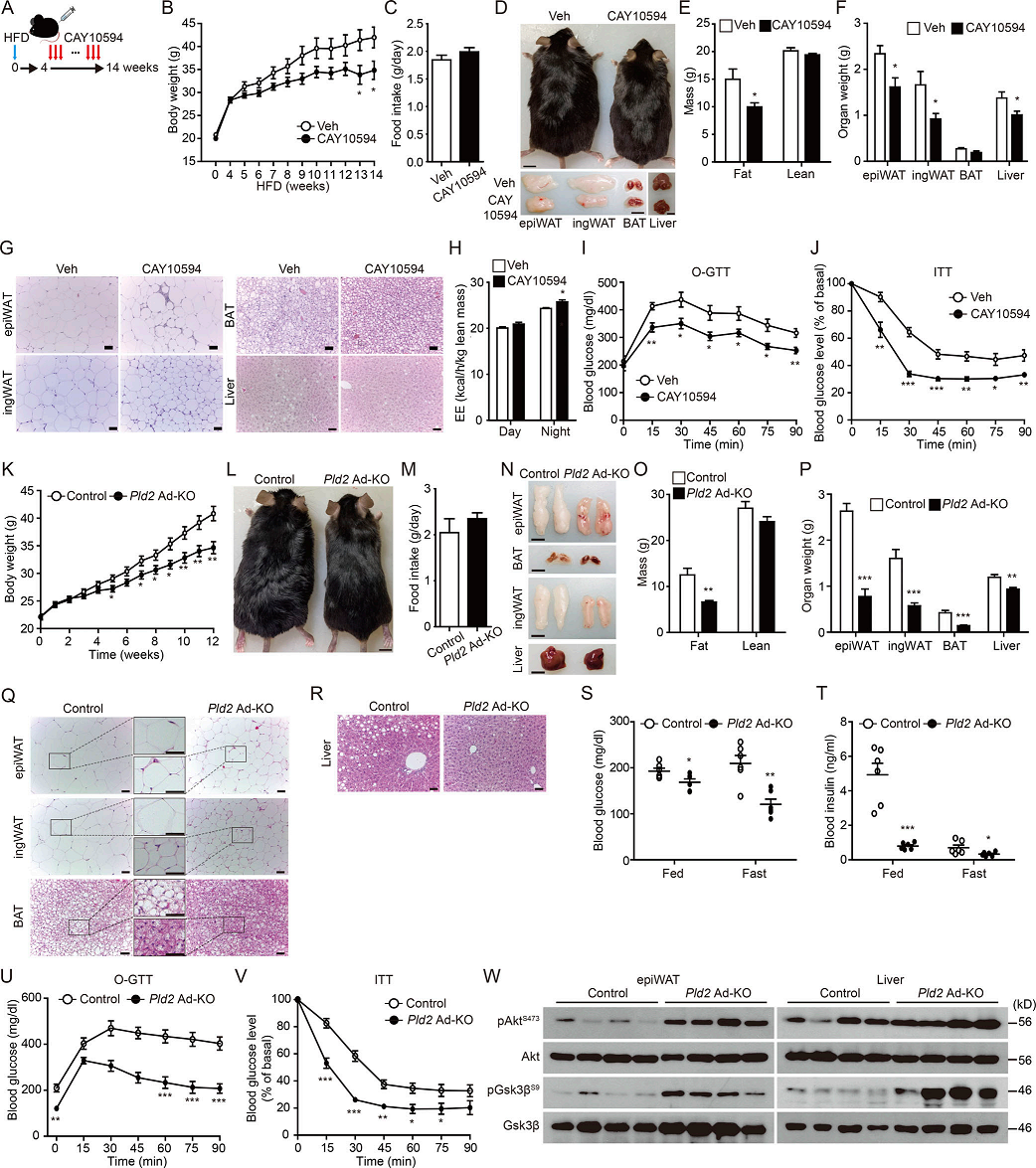
图3 PLD2靶向小鼠的肥胖和2型糖尿病的改善
4、PLD2通过p62调节线粒体质量和数量
先前的报道表明BAT线粒体内稳态需要自噬,p62在通过调节线粒体自噬控制线粒体质量方面具有重要作用。于是作者研究脂肪细胞特异性PLD2缺失或抑制对HFD喂养小鼠ingWAT和BAT中p62表达的影响。注射PLD2 Ad-KO和CAY10594的小鼠显示ingWAT和BAT中p62和UCP1水平显著升高(图4A和B)。为评估PLD2对p62表达的直接作用,作者抑制PLD2在蛋白和mRNA水平上显著诱导p62表达,类似于β3AR激动剂CL的作用(图4C),表明PLD2活性对p62具有细胞自主作用。此外,作者证明p62通过敲除CAY10594处理过的原代棕色脂肪细胞中的PLD2抑制对UCP1水平和产热基因表达的影响(图4D-E)。
基于p62在改善线粒体功能中的作用,作者接下来询问PLD2是否也调节线粒体功能。CAY10594处理后3小时增强p62在线粒体中的定位(图4F)。透射电镜和线粒体DNA /核DNA比值分析表明,与对照相比,PLD2缺失或抑制显著增加线粒体数量和质量(图4G-J)。作者想知道除了增加线粒体数量外,靶向PLD2是否也能改善线粒体质量。研究使用棕榈酸盐破坏线粒体膜电位,通过四甲基罗丹明甲酯(TMRM)评估线粒体功能。棕榈酸增加原代BAT的TMRM低群体,但减少TMRM高线粒体群体,而这一群体被PLD2抑制剂CAY10594的治疗有效地逆转了(图4K)。在棕色脂肪细胞中抑制或耗竭PLD2显著增强耗氧速率和寡霉素不敏感呼吸的程度(图4L-O)。总之,PLD2负调控p62,线粒体功能和能量。结果表明PLD2参与线粒体生物学的多个方面。
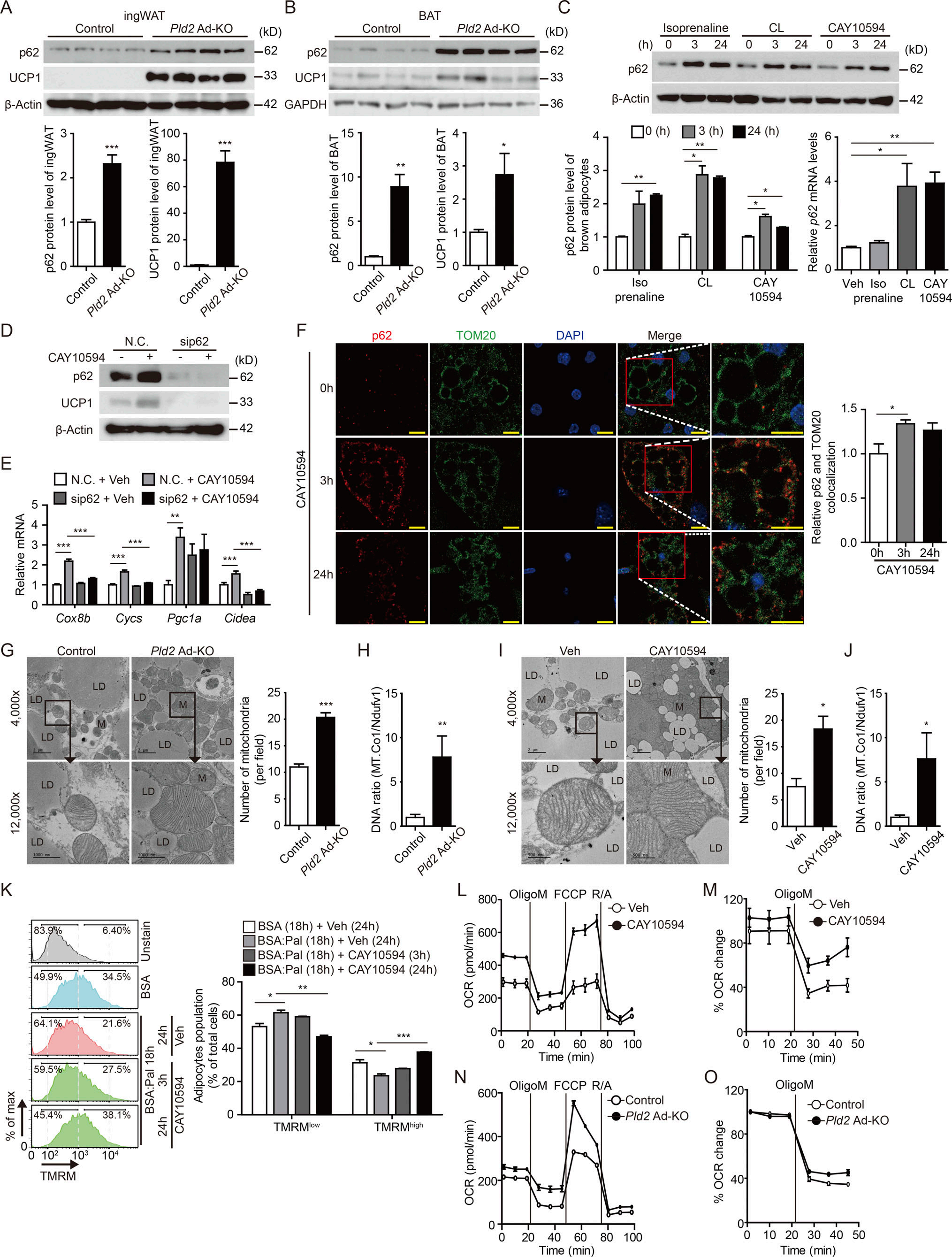
图4 p62调节脂肪细胞特异性PLD2消融或PLD2药物抑制管理小鼠的线粒体质量和数量

结论
在这项研究中,作者证明在饮食诱导的适应性产热和肥胖过程中,PLD2和UCP1水平之间存在反比关系。通过在脂肪组织中进行基因敲除或对PLD2进行药理学抑制,本研究认为PLD2是脂肪细胞产热和EE的负调控因子,是预防肥胖、胰岛素抵抗和葡萄糖不耐受的潜在靶点。
参考文献
Kim HS, Park MY, Yun NJ, Go HS, Kim MY, Seong JK, Lee M, Kang ES, Ghim J, Ryu SH, Zabel BA, Koh A, Bae YS. 2022. Targeting PLD2 in adipocytes augments adaptive thermogenesis by improving mitochondrial quality and quantity in mice. J Exp Med. 219(2):e20211523. doi: 10.1084/jem.






