6张图一区15分文章——T细胞外泌体过表达嗜酸性粒细胞阳离子蛋白诱导干扰素-γ和组织炎症
T细胞在系统性红斑狼疮(SLE)的发病机制中起关键作用。SLE患者血清来源的外泌体增加,并与疾病严重程度相关。作者确定嗜酸性粒细胞阳离子蛋白(ECP,也称为人RNase III)在SLE T细胞衍生的外泌体中过度表达。迄今为止,ECP在T细胞功能和自身免疫性疾病发病机制中的作用仍然未知。在这项研究中,作者表征了来自SLE患者的T细胞衍生的外泌体,并将ECP鉴定为致病性外泌体蛋白。该研究于2022年1月发表在《Arthritis & Rheumatology》,IF:15.483。
技术路线:
主要研究结果:
1. SLE患者T细胞衍生外泌体中CD9和CD63表面标志物的鉴定
在收集T细胞衍生的外泌体之前,纯化和培养SLE患者和健康对照的外周血T细胞72小时。为鉴定SLE患者中富集的外泌体表面蛋白,对T细胞上清液中的外泌体进行MACSPlex检测(图1A)。与健康对照组(n=12)相比,SLE患者(n=12)的T细胞上清液中T细胞衍生的外泌体数量显著增加。在37种表面蛋白中,16种外泌体表面蛋白在SLE患者中增加(图1B)。SLE患者中T细胞衍生的CD9+、CD63+、CD62P+和CD45+外泌体数量较高(信号大于20%),并且与健康对照组相比显著增加(图1B和C)。CD9和CD63是2个众所周知的外泌体表面标志物;有趣的是,与对照组相比,T细胞衍生的CD9+和CD63+外泌体在SLE患者中的诱导倍数最高。
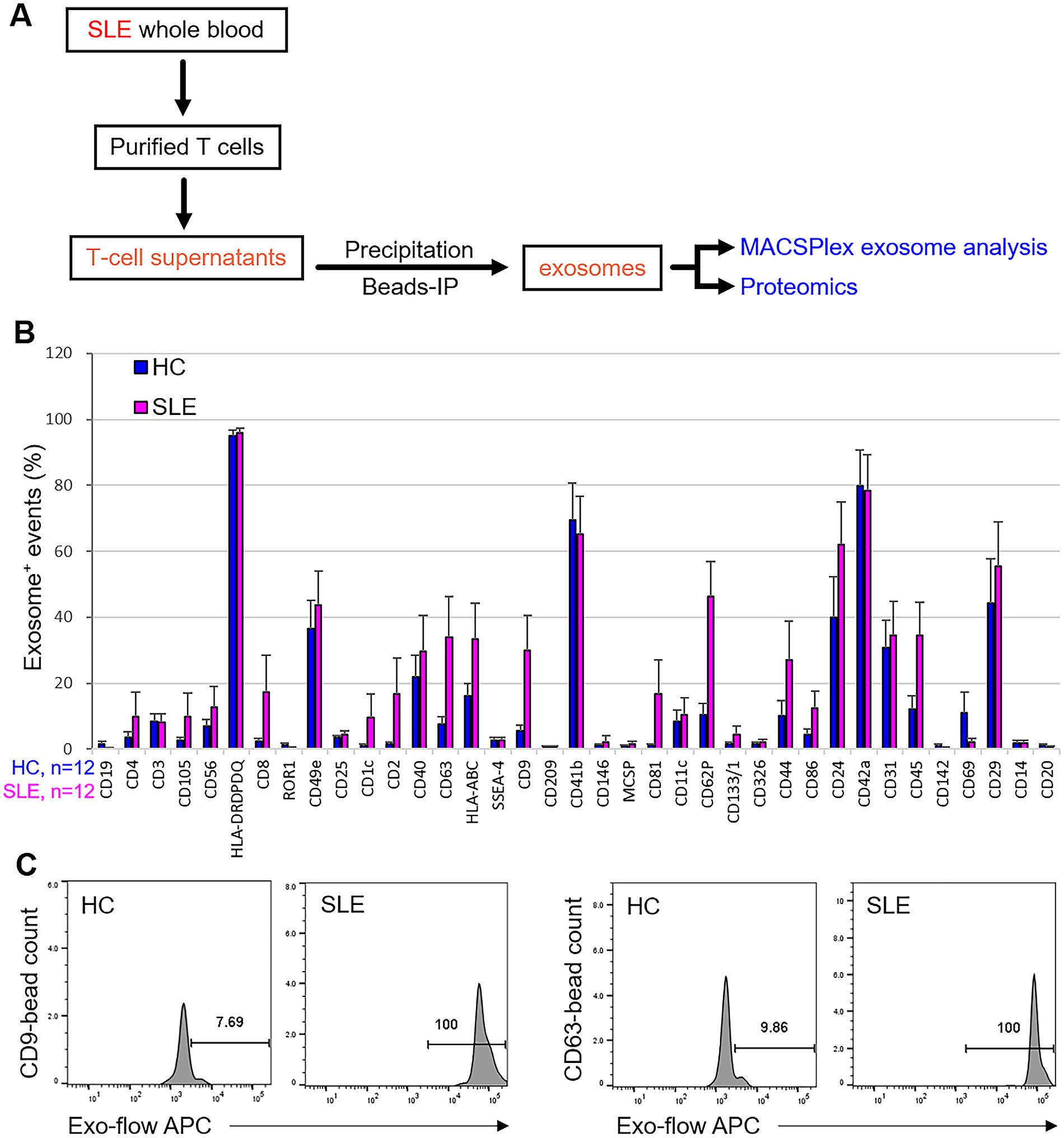
图1. SLE患者中T细胞衍生的CD9+和CD63+外泌体数量增加
2. SLE患者的T细胞衍生外泌体中存在ECP
为表征来自SLE患者的T细胞来源的外泌体的特性,通过基于质谱的蛋白质组学分析了从SLE患者和健康对照中分离的T细胞来源的CD9+和CD63+外泌体。蛋白质组学数据显示,SLE患者的T细胞衍生的CD9+外泌体和CD63+外泌体中分别过表达了130和140种蛋白质,而健康对照组则没有(图2A)。此外,在富含类风湿关节炎(RA)的外泌体中也观察到了许多鉴定的外泌体蛋白。在SLE患者中,只有15个CD9+外泌体蛋白和21个CD63+外泌体蛋白选择性富集,而RA患者则没有(图2A)。值得注意的是,在质谱分析中包括的所有5个SLE患者样本的T细胞外泌体中都检测到了一种蛋白评分最高的外泌体蛋白ECP(图2B)。

图2. SLE患者T细胞衍生的CD9+和CD63+外泌体中ECP的诱导
3. Lck-ECP-转基因小鼠出现严重炎症
为研究富含SLE的外泌体ECP是否在SLE的发病机制中发挥重要作用,作者生成并表征了Lck-ECP-转基因小鼠。ECP在来自Lck-ECP-转基因小鼠的T细胞衍生的外泌体中成功过表达(图3A)。T细胞衍生的外泌体的直径大多小于200 nm(图3B)。与同龄的野生型小鼠相比,两个月大的Lck-ECP-转基因小鼠的血清促炎细胞因子IFN-γ水平自发升高(图3C)。2个月大的Lck-ECP-转基因小鼠的血清IL-1β、TNF-α和IL-6水平没有显著升高,而8个月大的Lck-ECP-转基因小鼠的血清IL-1β和TNF-α水平升高(图3C)。此外,通过组织学染色检测到10个月大的Lck-ECP-转基因小鼠表现出严重的肝脏、肾脏和关节炎症(图3D)。血清肌酐和甘油三酯水平升高也分别提示Lck-ECP-转基因小鼠发生肾炎和肝炎(图3E)。为研究含有ECP的外泌体是否浸润到肝脏和肾脏的发炎组织中,从小鼠组织样本中分离出外泌体并进行免疫印迹。结果证实Lck-ECP-转基因小鼠组织含有ECP阳性外泌体(图3F)。这些结果表明,Lck-ECP-转基因小鼠自发地发展出多种组织类型的炎症。

图3. T细胞特异性ECP-转基因(Lck-ECP-转基因)小鼠自发发展为严重炎症
4. 从Lck-ECP-转基因小鼠过继转移T细胞衍生的外泌体后诱导受体小鼠的炎症反应
为证明含有ECP的外泌体的病理功能,来自纯化的Lck-ECP-转基因小鼠T细胞的外泌体通过静脉注射过继转移到野生型受体小鼠中。共聚焦显微镜显示,来自Lck-ECP-转基因小鼠的T细胞的外泌体(以下简称ECP外泌体)浸润到野生型受体小鼠的肝脏、肾脏和爪子组织中(图4A)。在过继转移ECP外泌体4周后,受体小鼠在肝脏、肾脏和关节滑膜中显示出浸润性免疫细胞的诱导(图4B)。苏木精和伊红染色提示ECP外泌体受体小鼠出现肝炎、肾炎和关节炎(图4B)。来自ECP外泌体受体小鼠的肝脏、肾脏和关节组织也显示出高水平的IFN-γ(图4C)。此外,ECP外泌体的过继转移刺激了野生型受体小鼠的血清肌酐和甘油三酯水平(图4D),分别表明受体小鼠患肾炎和肝炎。受体小鼠的血清ANA和RF水平,而非抗dsDNA水平也升高(图4E),表明ECP外泌体诱导自身免疫反应。总之,这些结果表明T细胞衍生的外泌体ECP有助于炎症反应。

图4. 从Lck-ECP-转基因小鼠过继转移T细胞衍生的外泌体后WT小鼠的炎症反应
5. 通过在T细胞中过表达ECP诱导生长激素(GH)、TNF超家族(TNFSF8)和肌联蛋白
为了解驱动Lck-ECP-转基因小鼠自发性炎症的潜在T细胞反应,分离了来自8个月大的Lck-ECP-转基因小鼠的T细胞并进行了单细胞RNA测序。Seurat的降维/聚类分析根据基因表达将来自Lck-ECP-转基因和野生型小鼠的T细胞分为11个不同的簇(图5A)。簇1、2、5、10和11被鉴定为CD4+T细胞,而簇3、4、6、7、8和9被鉴定为CD8+T细胞(图5A)。T细胞中ECP过表达导致初始CD8+T细胞数量减少(第3组)、效应CD8+T细胞数量增加(第4组)和记忆CD4+T细胞数量增加(第2组) (图5A)。在Lck-ECP-转基因小鼠T细胞中,包括CD28和CD69在内的51个基因的表达水平显著上调(图5B)。在Lck-ECP-转基因小鼠T细胞中,多个炎症相关基因(如TNFAIP3、TNFSF8、S100a6和IFN-γ)的表达也显著增加(图5B和C)。这些结果表明T细胞中的ECP过表达诱导T细胞活化和炎症反应。

图5. 通过在T细胞中过表达ECP诱导TNF-α信号传导和IFN-γ产生
6. 在Lck-ECP-转基因小鼠中,滤泡辅助T(Tfh)细胞和浆B细胞数量以及自身抗体水平增加
Lck-ECP-转基因小鼠T细胞对IL-21、CXCR5和诱导型共刺激物的mRNA有显著诱导(图5D),它们是Tfh细胞的细胞标志物。值得注意的是,程序性死亡1(PD-1)mRNA水平在Lck-ECP-转基因小鼠T细胞中没有显著增加(图5D)。
为研究Lck-ECP-转基因小鼠中Tfh细胞群或浆B细胞群是否增加,通过流式细胞术分析了鼠脾细胞和骨髓细胞。发现与野生型小鼠相比,8周龄Lck-ECP-转基因小鼠的CD4+IL-21+T细胞和CD4+CXCR5+T细胞的百分比均增加(图6A);这2个T细胞亚群在16周龄小鼠中进一步增强(图6A)。此外,在16周龄而非8周龄Lck-ECP的脾脏中,成熟B细胞(B220+CD21+)的百分比增加,而幼稚B细胞(B220+CD23+)的百分比降低(图6B)。8周龄Lck-ECP-转基因小鼠的骨髓中浆B细胞百分比(B220lowCD138+)适度增加,并在16周龄Lck-ECP-转基因小鼠中进一步增加(图6C)。与野生型小鼠相比,8周大的Lck-ECP-转基因小鼠的血清ANA水平略有诱导,而16周大的Lck-ECP-转基因小鼠的血清ANA水平进一步升高(图6D)。16周龄而非8周龄的Lck-ECP-转基因小鼠的血清RF水平也有所增加(图6D)。这些发现表明,在Lck-ECP-转基因小鼠中诱导Tfh细胞导致血浆B细胞数量增加,从而促进随后的自身抗体产生。

图6. 在Lck-ECP-转基因小鼠中,滤泡辅助T(Tfh)细胞和浆B细胞数量以及自身抗体水平增加
结论:
T细胞或T细胞衍生的外泌体中的ECP过表达通过内在和外在事件诱导T细胞过度活化和促炎细胞因子产生,导致多器官炎症和自身免疫反应。因此,过表达ECP的T细胞和含有ECP的外泌体是SLE的潜在生物标志物。






