铁死亡抑制剂治疗原发性卵巢功能不全
原发性卵巢功能不全(POI)是一种以原始卵泡过早衰竭为特征的卵巢功能障碍的临床综合征。POI能引起不孕不育、严重的日常生活紊乱和长期的健康风险。然而,POI的潜在机制在很大程度上仍不清楚。本文揭示了基于BNC1缺陷的POI的病理机制,提示YAP和铁死亡抑制剂在POI治疗中的潜在价值。本文于2022年10月发表在《Nature Communications》IF:17.694期刊上。
技术路线:

主要实验结果:
1、Bnc1截断突变导致卵泡过度激活和闭锁
为确定Bnc1突变对卵泡发生的影响,从用10 IU孕母马血清促性腺激素(PMSG)超排卵的4周龄和12周龄小鼠中收集生发囊(GV)卵母细胞,比较野生型(Bnc1tr/tr)和Bnc1纯合子突变(WT,Bnc1+/+)的卵泡发生的变化。结果显示与WT小鼠比较,Bnc1突变小鼠的卵母细胞增多,但卵巢反应随年龄的增加而下降(Fig. 1a–b)。作者猜想Bnc1tr/tr小鼠的卵巢储备也随着年龄的增长而下降。为验证该猜想,比较WT和Bnc1tr/tr小鼠在出生后1天(PD1)和3, 4, 12, 16周时的卵泡数量。结果显示,与WT比较,Bnc1tr/tr小鼠的卵泡数量在PD1时无差异(Fig. 1c),在3周时卵泡数量减少,卵泡过度激活,但未观察到卵泡闭锁(Fig. 1d),在4周时也是(Fig. 1e)。在12和16周时,表型和4周时类似,但是还观察到闭锁卵泡数量显著增加,而原始卵泡耗竭率下降(Fig. 1f, g)。总之,这些数据表明,在具有Bnc1突变的小鼠POI模型中,卵泡过度激活(Fig. 1h-i),闭锁卵泡数量随着年龄的增长而增加。

2、条件敲除卵母细胞中Bnc1可通过卵泡过度激活和卵泡闭锁诱导POI
采用Fig. 2a的方法构建选择性敲除卵母细胞Bnc1的小鼠,结果显示Bnc1突变小鼠的卵巢重量/体重比和卵巢大小均小于WT小鼠(Fig. 2b),并且突变小鼠都不孕(Fig. 2c);组织学和形态分析显示Bnc1突变小鼠卵巢卵泡数量减少(Fig. 2d);这种表型提示BNC1在卵母细胞中起作用,并在原始卵泡期起作用。此外,选择性敲除卵母细胞Bnc1的小鼠的卵巢动态变化和Bnc1tr/tr小鼠的类似,其卵泡数量减少,卵泡过度激活和卵泡闭锁(Fig. 2e-g)。这些数据表明,在卵母细胞特异性敲除Bnc1的小鼠中,卵泡被过度激活,闭锁卵泡的数量增加。
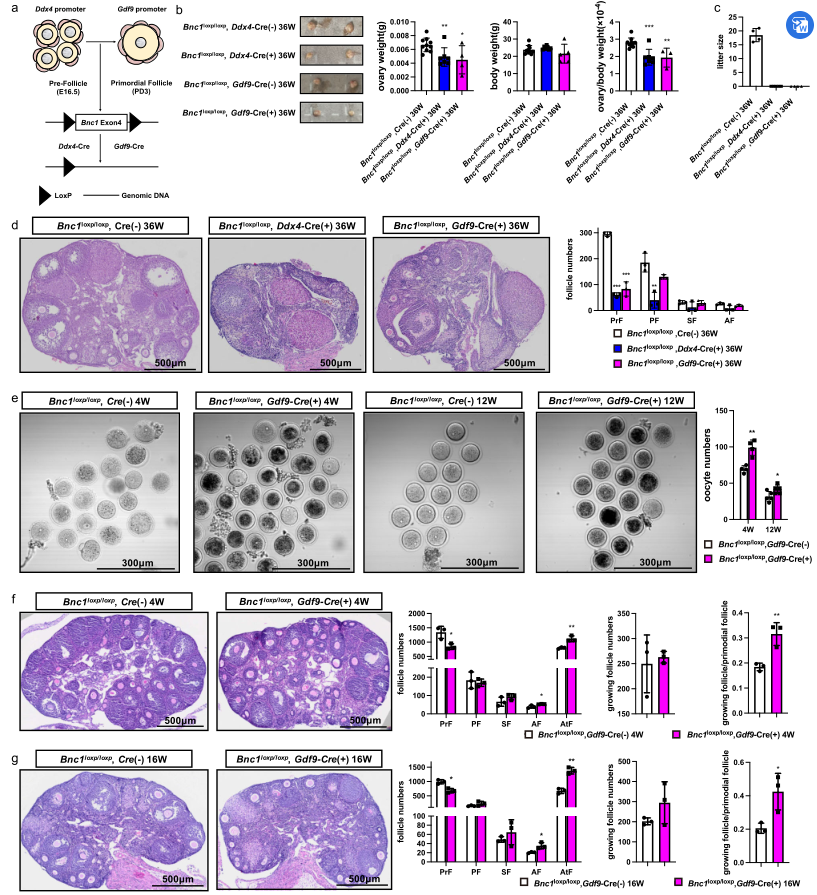
图2 Bnc1通过影响卵母细胞影响卵泡发育
3、Bnc1突变通过非凋亡性细胞死亡诱导卵泡闭锁
由于文献报道细胞凋亡参与了卵泡闭锁,所以作者想确定细胞凋亡是否参与了Bnc1突变小鼠的卵巢卵泡闭锁。然而,WB结果显示WT和Bnc1tr/tr小鼠的卵巢中这些凋亡标志物的表达无差异(Fig. 3a-b)。Annexin V染色也显示WT小鼠和卵母细胞特异性敲除Bnc1小鼠在早期的细胞凋亡方面无差异(Fig. 3c)。类似地,DNA损伤标志物也在两种小鼠间无差异(Fig. 3d)。这些结果表明Bnc1突变小鼠的卵泡闭锁不是通过由凋亡介导而是通过非凋亡细胞死亡通路实现的。
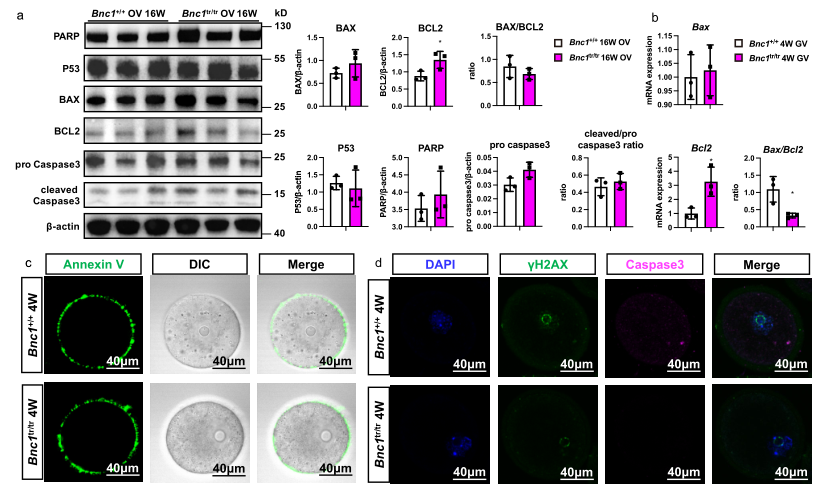
4、异常的脂质代谢和铁死亡参与卵泡闭锁
为揭示Bnc1突变导致卵泡闭锁的分子机制,对卵巢组织进行RNA测序,总计获得523个差异表达基因(Fig. 4a)。KEGG和GSVA揭示相比于WT小鼠,突变小鼠的卵巢表现出脂质代谢紊乱(Fig. 4b, c)。此外,卵母细胞Smart-seq获得了类似的结果,总计收获4554个差异表达基因(Fig. 4d, e),GO分析提示他们参与异常的线粒体功能和脂质代谢受损(Fig. 4f, g),KEGG显示它们参与Hippo和铁死亡通路(Fig. 4h, i)。鉴于线粒体介导的脂质过氧化是铁死亡的关键,所以这些结果提示铁死亡可能参与Bnc1突变导致的POI进展。

图4 Bnc1突变可能通过铁死亡诱导卵泡闭锁
为表征Bnc1突变是否导致卵母细胞铁死亡,采用透射电镜和扫描电镜观察突变小鼠的GV卵母细胞,结果发现Bnc1突变导致过多的脂质积累(Fig. 5a);线粒体分布异常,聚集异常;线粒体膜的密度增加(Fig. 5b);GV卵母细胞和小鼠卵巢的尼罗红染色也证实了脂质积累(Fig. 5c)。此外,选择性敲除卵母细胞Bnc1的小鼠和Bnc1tr/tr小鼠的卵母细胞中ROS和MitoSOX的水平均显著增加(Fig. 5d, e),且在卵母细胞中发现线粒体分布缺陷,线粒体位于细胞膜下方(Fig. 5e)。JC-1染色显示两种突变鼠卵母细胞中的线粒体膜电位明显升高(Fig. 5f)。两种突变鼠卵母细胞中的脂质ROS产量也显著增加(Fig. 5g),而GPX4的表达显著下降(Fig. 5h, i),Nox1和Cox2的表达增加,其余铁死亡标志物的表达也异常改变(Fig. 5j)。进一步研究发现。铁死亡诱导剂RLS3和抑制剂Fer-1可分别显著增强或抑制Bnc1缺陷诱导的小鼠卵母细胞脂质过氧化(Fig. 5k)。综上所述,这些结果表明,卵母细胞的Bnc1突变和敲除可诱导铁死亡。
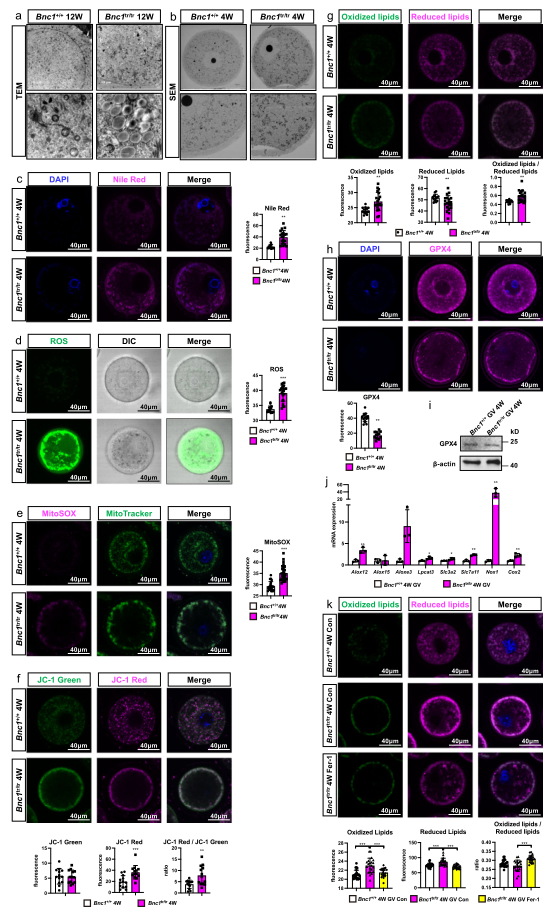
图5受Bnc1突变影响的卵母细胞对铁死亡更加敏感
6、BNC1缺乏通过NF2-YAP途径引发卵母细胞铁死亡
为探究Bnc1缺失诱导卵母细胞铁死亡的分子机制,进行了ChIP-seq,发现NF2可能是Bnc1的靶基因。据文献报道敲除NF2和激活Hippo可促进铁死亡。所以作者探究了Bnc1缺失是否通过调控NF2诱导卵母细胞铁死亡。ChIP-qPCR和双荧光素酶实验都证实了Bnc1可与NF2的启动子区域结合(Fig. 6a, b)。此外,启动子缺失试验确定片段(1-500 bp)是Bnc1调控Nf2所需的(Fig. 6b)。免疫荧光和免疫组化结果显示,相比于WT小鼠卵巢,Bnc1tr/tr小鼠的卵母细胞中NF2的表达显著下降,YAP的核定位及下游基因TFRC和ACSL4的表达显著增加(Fig. 6c-g);Fe2+含量显著增加(Fig. 6h)。过量铁依赖的PUFA的过氧化可诱导铁死亡。靶向脂质组学揭示相比于WT小鼠,Bnc1突变小鼠卵母细胞中PUFA组分的水平显著增加,如(PE) (18:1/18:2),PE (16:0/20:4),PE (18:2/18:2),PE (18:1/20:4),(PS) (14:0/20:4)和(PI)(18:0/18:2)(Fig. 6i)。这些结果表明,Bnc1靶向NF2介导Hippo-YAP通路,参与铁死亡的调控。
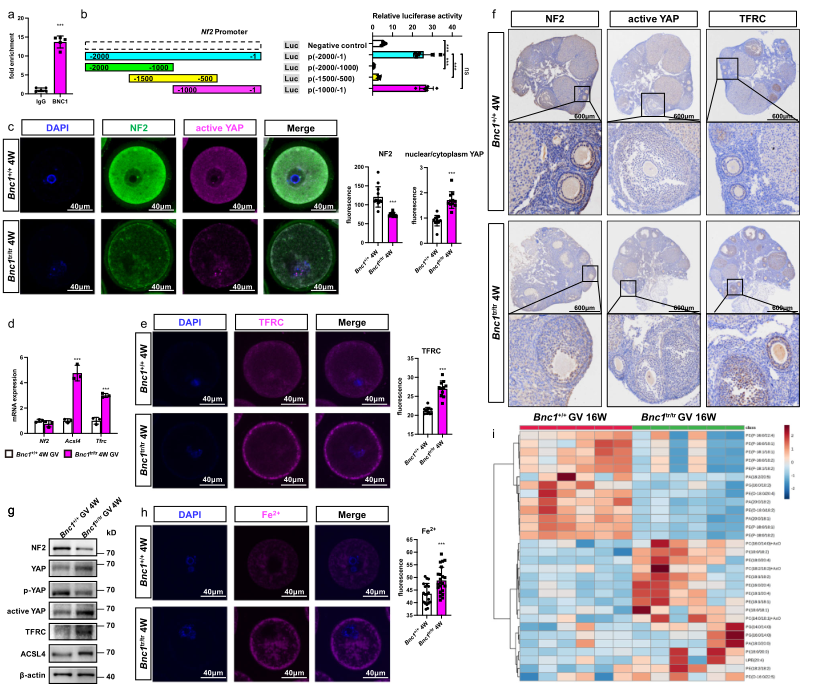
图6 Bnc1截断突变通过调节NF2-YAP信号使卵母细胞对铁死亡敏感
7、靶向NF2-Hippo/YAP通路挽救Bnc1突变诱导的铁死亡
为进一步探究Bnc1通过调控NF2介导铁死亡的分子机制,将Nf2 mRNA微注射到GV卵母细胞中,然后检测NF2和活化的YAP的水平。结果显示补充Nf2 mRNA后Bnc1tr/tr小鼠卵母细胞中NF2的表达显著增加,而核YAP的水平显著减少(Fig. 7a)。然后检测了YAP特异性抑制剂VP靶向YAP的效果。结果显示,与Bnc1tr/tr小鼠比较,注射VP的Bnc1tr/tr小鼠的原始卵泡的数量增加,过度激活
的卵泡减少(Fig. 7b),TFRC和COX2的表达下降(Fig. 7c, d),Fe2+含量显著下降(Fig. 7e),脂质过氧化下降(Fig. 7f)。以上结果表明靶向NF2-Hippo/YAP通路可挽救Bnc1突变诱导的铁死亡。
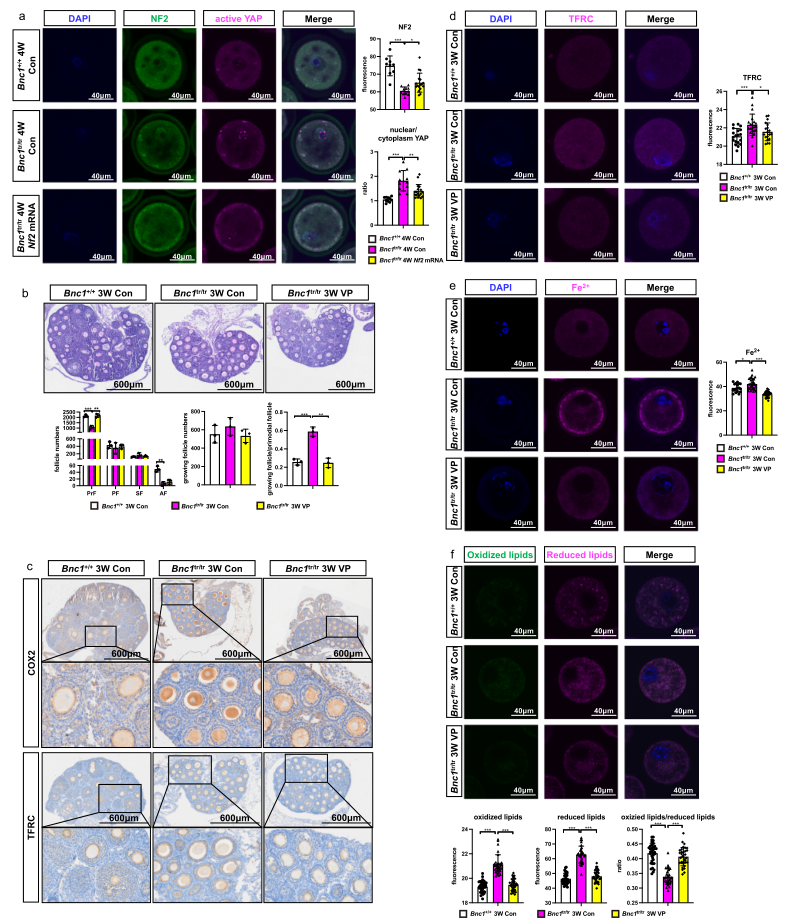
图7靶向NF2-Hippo/YAP信号通路挽救Bnc1突变诱导的铁死亡
最后作者探究了铁死亡抑制剂Fer-1对小鼠POI的药理改善作用。结果如图8所示,与Bnc1tr/tr小鼠比较,Fer-1处理的Bnc1tr/tr小鼠的卵巢重量增加,卵巢/体重比升高(Fig. 8a, b),闭锁卵泡数量无显著变化(Fig. 8c),紊乱发情周期的持续时间缩短(Fig. 8d),脂质过氧化水平下降(Fig. 8e),GPX4表达升高和COX2表达升高(Fig. 8f)。这些结果表明Fer-1阻断铁死亡可改善Bnc1缺失引起的POI。

图8 Fer-1可部分改善Bnc1截断突变的POI表型
总之,BNC1直接调控Nf2的表达。BNC1缺失下调NF2表达,降低YAP磷酸化,促进YAP核积累。YAP的激活上调了Tfrc和Acsl4的表达,随之而来的是铁的吸收增加和脂质ROS的产生增强,最终导致卵母细胞铁死亡(图9)。

图9 BNC1-Merlin-Hippo-YAP signaling-Ferroptosis信号轴示意图。
参考文献:
Wang Feixia., Liu Yifeng., Ni Feida., Jin Jiani., Wu Yiqing., Huang Yun., Ye Xiaohang., Shen Xilin., Ying Yue., Chen Jianhua., Chen Ruixue., Zhang Yanye., Sun Xiao., Wang Siwen., Xu Xiao., Chen Chuan., Guo Jiansheng., Zhang Dan.(2022). BNC1 deficiency-triggered ferroptosis through the NF2-YAP pathway induces primary ovarian insufficiency. Nat Commun, 13(1), 5871. doi:10.1038/s41467-022-33323-8






