长链非编码RNA LINC00518通过miR-335-3p/CTHRC1轴促进肺腺癌的增殖和转移
在当今社会,肺癌仍然位居全球肿瘤相关死亡的首位,其发病率以每年10%的速度稳步上升。肺腺癌(LUAD)是肺癌的主要类型之一。因此,迫切需要探索LUAD的增殖、转移和耐药机制。长基因间非蛋白编码RNA 518 (LINC00518) 被认为会在LUAD中引起癌症增殖和转移。尽管如此,LINC00518在LUAD中的准确作用和分子机制仍未确定。该研究发表于《Cell Death Discovery》,IF: 7.109。
技术路线:
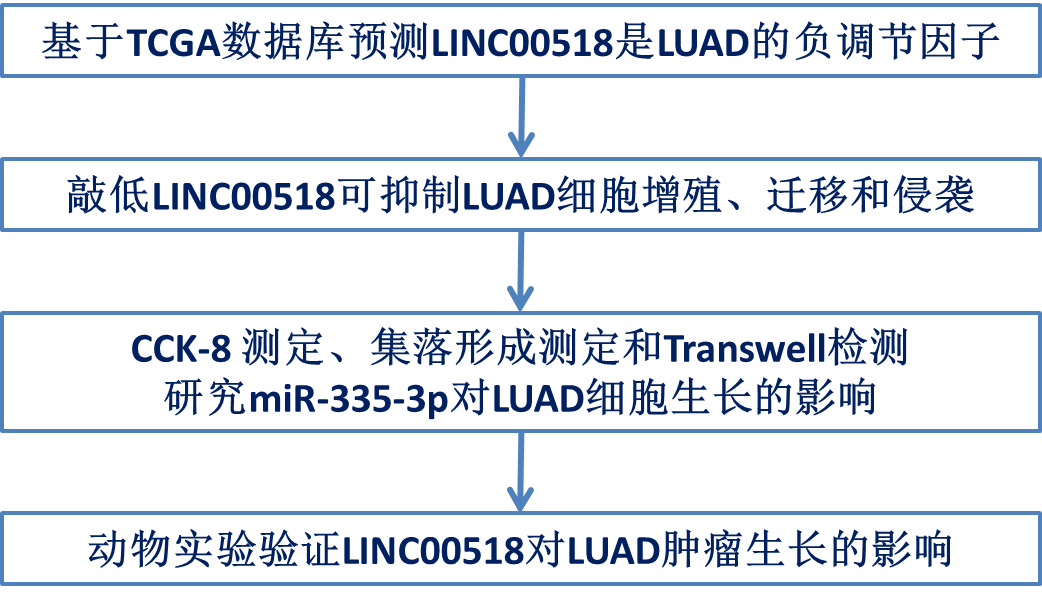
主要研究结果:
1. LINC00518在肺腺癌(LUAD)组织中上调,并作为预后因素发挥重要作用
为了筛选LUAD中潜在的致癌lncRNA,作者比较了从TCGA数据库下载的LUAD和正常组织中的lncRNA表达。火山图显示了来自TCGA的LUAD中所有差异表达的lncRNA(图1A)。然后作者使用COX和LASSO回归分析所有差异表达的lncRNA。LASSO回归的lambda模型如图1B所示。作者选择了最小的lambda,并选择了39个lncRNA(图1C)。接下来,作者检测了39个lncRNAs的表达,发现LINC00518在肺腺癌组织中的表达更高,使用GEPIA(http://gepia.cancer-pku.cn/)(图1E)。为了验证这一结论,作者分析了20个LUAD组织和癌旁组织样本中的LINC00518水平,并发现了相同的结果(图1F)。作者分析了483名LINC00518高或低表达的LUAD患者的总生存期 (OS)、无病生存期 (DFS)、疾病特异性生存期 (DSS) 和无进展生存期 (PFS)。关于LUAD进展的集体结果表明,较差的预后与 LINC00518 的较高表达密切相关(图1D)。
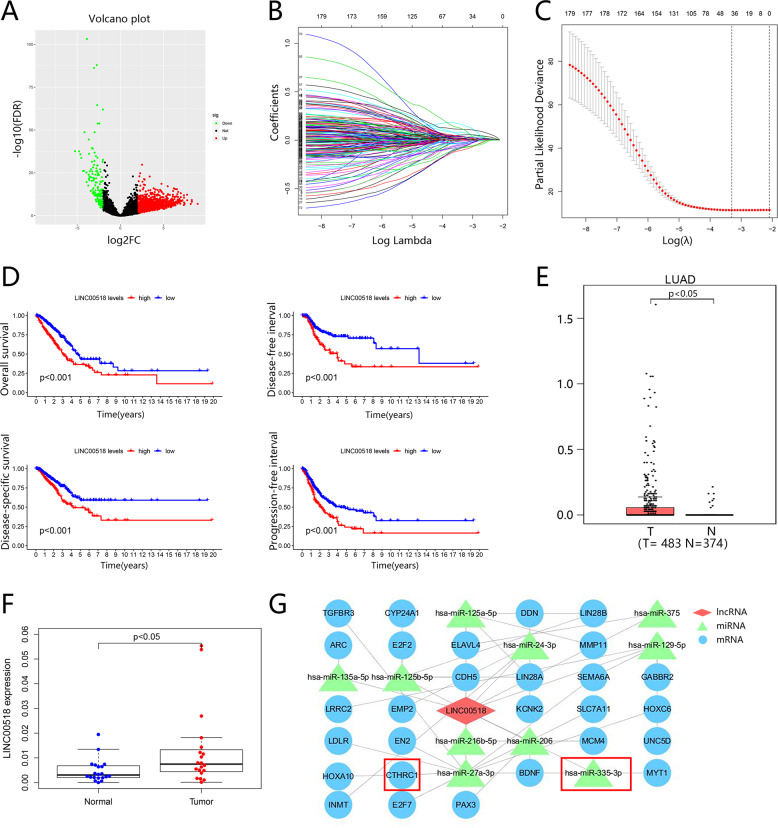
图1 上表达的LINC00518是LUAD生存的一个危险因素
2. LINC00518的ceRNA
通常有报道称,其他一些人类肿瘤的增殖是通过上游LINC00518控制的miRNA或mRNA来加剧的。为了探索哪些miRNA或mRNA在肺腺癌中同样起作用,软件Cytoscape (v3.6.0) 用于显示关于LINC00518的ceRNA相互关系的视觉网络(图1G)。令人惊讶的是,miR-335-3p与LINC00518有很强的相关性,在作者之前的研究中发现其相应的miRNA,miR-335-5p在LUAD中被下调。此外,许多研究预测miR-335-3p的靶基因是CTHRC1,该基因在LUAD中增加。通过这项工作验证如下,预测的ceRNA网络在LINC00518调节的 LUAD中显示极可能的miR-335-3p / CTHRC1轴。
3. LINC00518敲低抑制LUAD细胞增殖、集落形成、迁移和侵袭,并阻止细胞周期
肺腺癌细胞(A549和H1299)表达的LINC00518水平高于人支气管上皮细胞(BEAS-2B)(图2A)。在确定siRNA功效后,Cell Counting Kit-8测定和集落形成测定发现,与对照相比,LINC00518减少的细胞中的增殖显着降低(图2B,C)。接下来,作者可以使用伤口愈合和transwell检测来分别测量LINC00518对LUAD细胞迁移和侵袭的影响(图2D, E)。为了确定LINC00518敲低如何抑制LUAD细胞中的细胞增殖,作者通过Gene Set Enrichment Analysis (GSEA) 4.1.0软件使用TCGA数据库进行了KEGG通路分析。结果表明,LINC00518可能对细胞周期和粘着斑至关重要(图2F)。然后,作者通过流式细胞术检测到LUAD细胞中S期细胞的比例有效降低,而G0/G1期细胞比例有效地增加(图2G)。
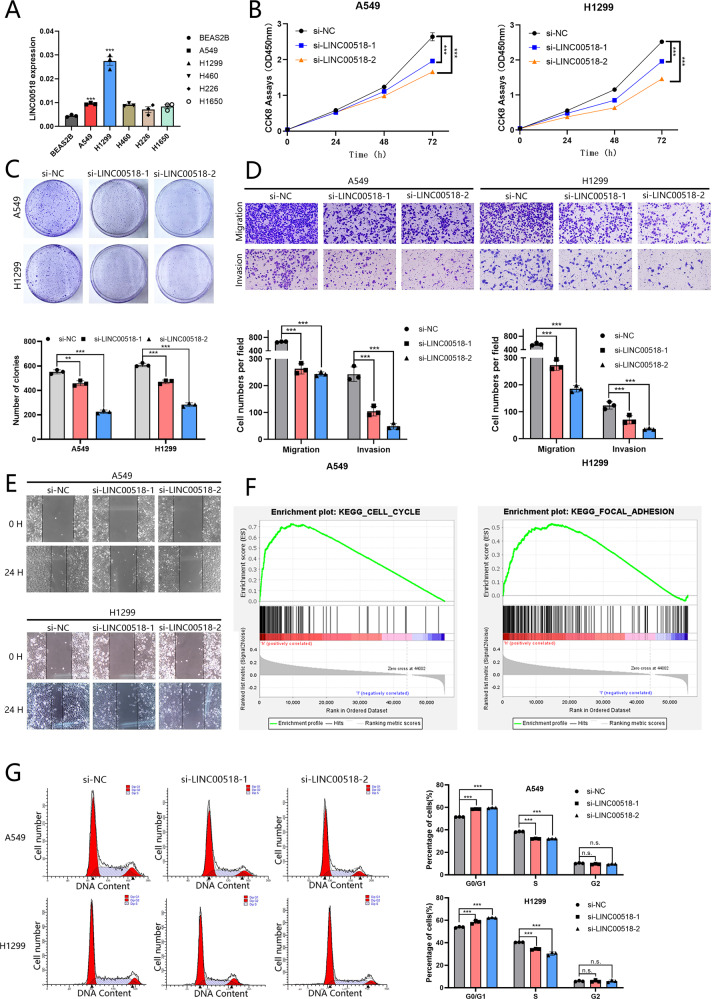
图2 LINC00518的敲低抑制了细胞增殖和转移,并降低了活力
4. MiR-335-3p被LINC00518直接靶向,抑制LUAD细胞增殖、集落形成、迁移和侵袭
首先,在A549和H1299细胞中,作者检测了转染miR-335-3p的LINC00518的表达。使用qRT-PCR检测到LINC00518的水平与miR-335-3p的表达一致,在转染miR-335-3p模拟物的细胞中下调(图3A)。为了确保这一预测,作者接下来构建了含有野生型和突变型 miR-335-3p 结合位点的LINC00518荧光素酶质粒,如图3B所示。此外,RIP检测进一步验证了LINC00518和miR-335-3p之间的直接相互作用(图3C)。
作者通过使用模拟物诱导LUAD细胞中miR-335-3p的过表达,并通过CCK-8测定和集落形成测定研究了它们对细胞生长的影响(图3D, F)。为了确定miR-335-3p转染在 A549/H1299细胞中的作用,进行了伤口愈合试验和transwell试验,如图3E,G。

图3 LINC00518直接靶向miR-335-3p,促进CTHRC1表达,而miR-335-3p抑制LUAD细胞增殖和转移
5. CTHRC1受miR-335-3p调节并增加LUAD细胞的增殖、迁移和侵袭能力
通过qRT-PCR测定,对应于miR-335-3p的CTHRC1水平在用miR-335-3p模拟物转染的细胞中下调(图3H)。为了确定这一预测,作者构建了CTHRC1野生型3'-UTR和CTHRC1 MUT 3'-UTR,并在A549和H1299细胞中进行了双荧光素酶报告基因测定(图3I)。
作者在A549和H1299细胞中建立了靶向CTHRC1的小干扰RNA (siRNA)。与具有低 CTHRC1表达的细胞相比,通过CCK-8和集落形成测定法测定的对照细胞的生长明显得到促进(图4A、B)。此外,CTHRC1的敲低抑制了A549和H1299细胞的迁移和侵袭能力,通过伤口愈合和transwell测定显示(图4C,D)。流式细胞仪结果还表明,CTHRC1可以通过影响LUAD细胞的细胞周期来促进增殖(图4E)。
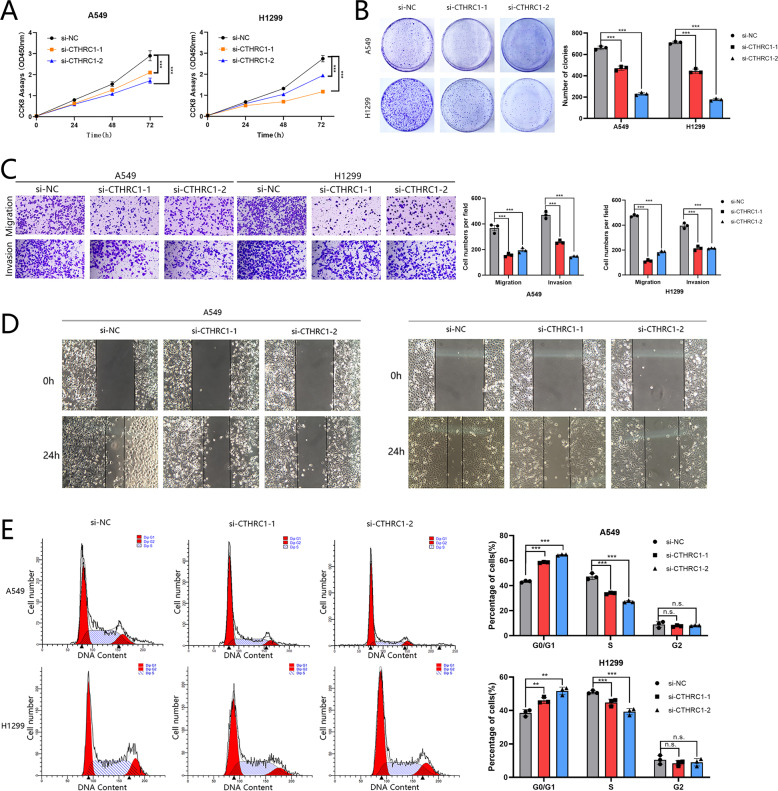
图4 CTHRC1的敲低抑制了细胞增殖和转移,并降低了活力
6. CTHRC1可能影响整合素β3/FAK信号传导,LINC00518可能是FAK抑制剂VS-6063的潜在协同治疗靶点
首先,从TCGA数据库下载LUAD中mRNA的表达数据,作者对CTHRC1和整合素的共表达进行了分析(图5A)。然后,将信息放入DAVID数据库(https://david.ncifcrf.gov/)进行功能分析,包括来自TCGA数据库的数据,之前进行的共表达分析,CTHRC1系数为0.3,P <0.05,和选定的基因。可以看出,CTHRC1可以聚集在细胞周期和粘着斑通路中(图5B)。为了确定CTHRC1是否可以影响整合素β3/FAK信号传导,作者使用了蛋白质印迹分析(图5C)。通过整合素β3和CTHRC1的共免疫沉淀可以揭示LUAD细胞的内源性整合素β3被CTHRC1抗体免疫沉淀(图5D)。然后作者使用H-Score来判断CTHRC1和整合素β3的表达。IHC染色结果显示它们在组织中的表达存在相关性(图5E)。
为进一步探索该研究的临床意义,作者检测了FAK抑制剂VS-6063在A549和H1299细胞中的IC50,结果表明miR-335-3p抑制剂可以提高VS-6063的IC50(图5G)。CCK-8测定还显示,具有VS-6063(5μmol/L)的细胞具有显着降低的增殖能力(图5F,H)。此外,作者使用Transwell分析表明,当miR-335-3p被抑制时,VS-6063可以抑制LUAD细胞的迁移和侵袭能力(图5I)。VS-6063的药物靶点FAK信号通过蛋白质印迹分析诱导(图5J)。
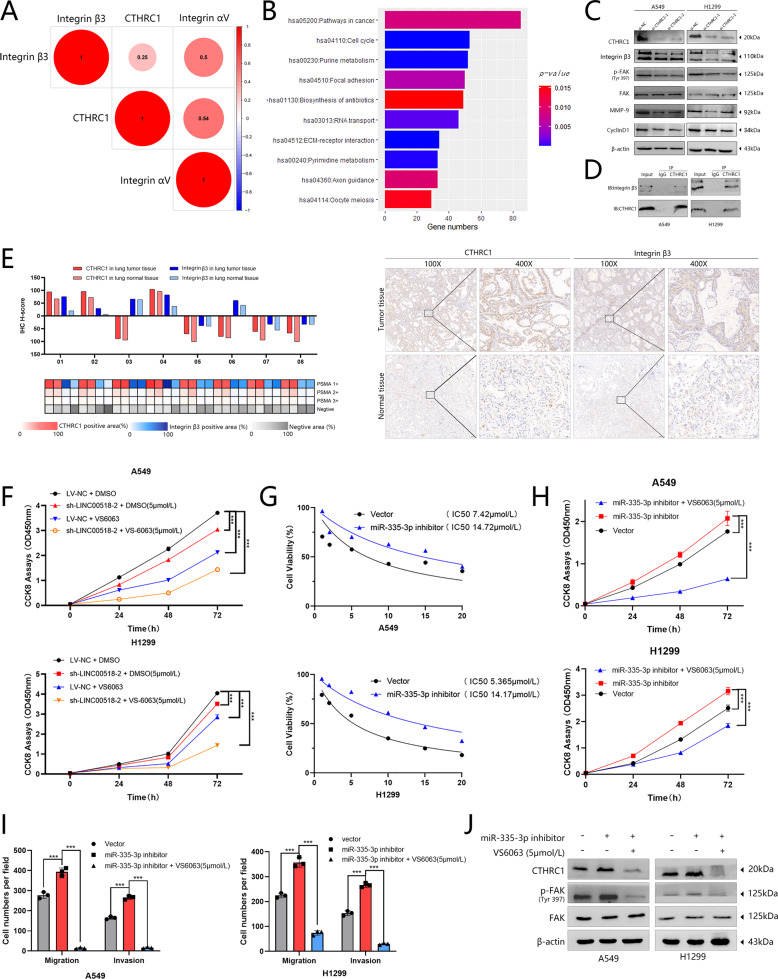
图5 CTHRC1可以影响整合素β3/FAK信号
7. LINC00518在体内LUAD细胞中的作用
首先,使用异种移植小鼠模型来确认LINC00518在体内LUAD细胞中的作用。如图所示(图6A,B),由LINC00518敲低细胞形成的肿瘤在尺寸上明显小于由对比细胞形成的肿瘤。根据这些结果,发现LINC00518敲低的细胞中的肿瘤重量更轻(图6C)。接下来,作者从异种移植肿瘤中切除组织,并通过蛋白质印迹和qRT-PCR对其进行分析以验证 LINC00518和CTHRC1(图6D,E)。

图6 敲除LINC00518可抑制体内LUAD肿瘤生长
8. 下调miR-335-3p可逆转LINC00518敲低诱导的细胞增殖、迁移、侵袭和集落形成的抑制作用
用sh-LINC00518转染A549和H1299细胞会降低细胞增殖,同时抑制miR-335-3p会逆转这种作用(图7A)。此外,通过集落形成试验发现,LINC00518沉默细胞中的细胞存活能力显着降低,而这种对细胞存活的负面印象可以通过miR-335-3p的低表达来逆转(图7B)。此外,Transwell分析表明,LINC00518 与调节LUAD细胞的侵袭和迁移有关,miR-335-3p 抑制剂逆转了LINC00518敲低诱导的迁移和侵袭抑制(图7C)。流式细胞术结果还表明,敲低LINC00518对A549和H1299细胞的细胞周期的影响可以被miR-335-3p抑制剂逆转(图7D)。通过蛋白质印迹证实,敲除A549和H1299细胞中LINC00518的表达降低了CTHRC1 的蛋白质水平,而miR-335-3p抑制剂逆转了这种作用(图7E)。这种搜索的示意图如图8所示。
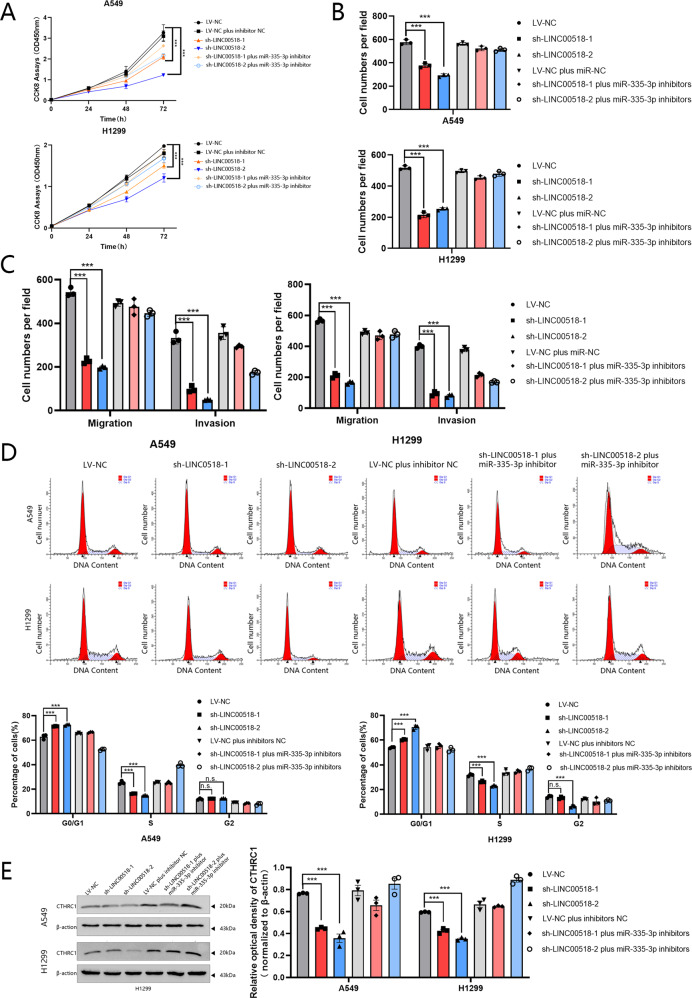
图7 LINC00518通过miR-335-5p/CTHRC1轴促进LUAD细胞增殖和转移
结论:
该研究阐明了LUAD中细胞质lncRNA LINC00518的临床意义和生物学功能。LINC00518作为调节CTHRC1的分子海绵,通过整合素介导的粘着斑信号促进LUAD生长和迁移。此外,LUAD样本中LINC00518的表达高于正常,LINC00518的表达是LUAD患者预后的指标。LINC00518 /miR-335-3p /CTHRC1轴可能会拓宽FAK抑制剂VS-6063在 LUAD中的应用。该研究结果表明,LINC00518可以作为LUAD中FAK抑制剂的预后和协同治疗靶点的有前途的生物标志物。
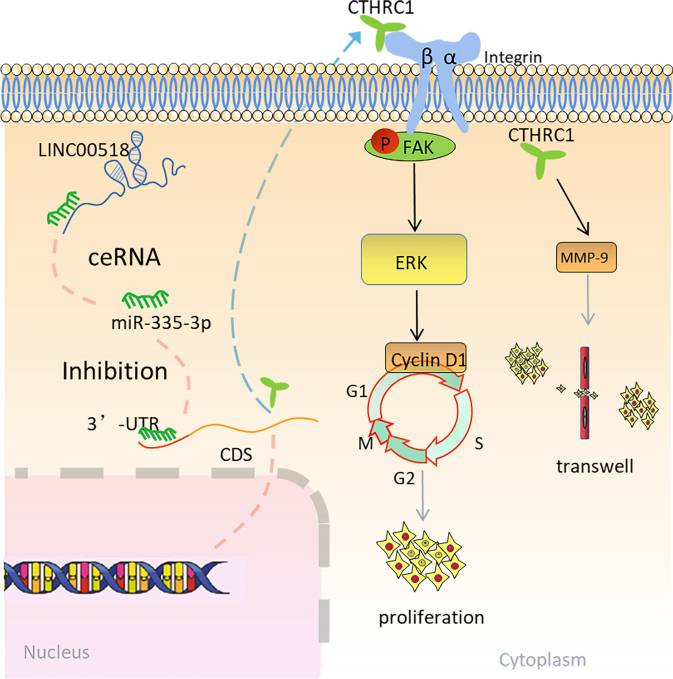
图8 本研究的模型
LINC00518/miR-335-3p/CTHRC1轴的模型受整合素β3/FAK信号通路的控制
参考文献:
Shen R, Cai X, Shen D, Zhang R, Zhang W, Zhang Y, Li Y, Wang A, Zeng Y, Zhu J, Liu Z, Huang JA. Long noncoding RNA LINC00518 contributes to proliferation and metastasis in lung adenocarcinoma via the miR-335-3p/CTHRC1 Axis. Cell Death Discov. 2022 Mar 4;8(1):98. doi: 10.1038/s41420-022-00905-w. PMID: 35246517; PMCID: PMC8897435.






