MiR-125b-5p调节Treg细胞在肿瘤微环境中的功能
TNFR2主要由CD4+FoxP3+调节性T细胞(Treg)表达,特别是存在于肿瘤微环境中的Treg细胞。证据表明TNFR2在Treg的激活、扩展和表型稳定性中起着至关重要的作用,并促进肿瘤免疫逃避。了解Treg中TNFR2表达的表观遗传调控可能有助于制定癌症免疫治疗的新策略。在本研究中,我们发现TNFR2是miR-125b-5p的直接靶点。miR-125b-5p过表达可降低Treg的比例及其TNFR2的表达,进而通过调节代谢相关信号通路抑制其增殖和抑制功能。此外,在结肠癌荷瘤小鼠中,Ago-125b-5p显著抑制肿瘤生长,这与肿瘤环境中Treg的减少和IFNγ+CD8+T细胞的增加有关。在人结肠癌患者中,我们证实miR-125b-5p表达下调,miR-125b-5p低水平与不良预后相关。有趣的是,miR-125b-5p的表达与TNFR2呈负相关。我们的研究结果表明miR-125b-5p具有抑制TNFR2表达和Treg免疫抑制活性的能力,从而增强抗肿瘤疗效。miR-125b- 5p的这一特性可能被用于治疗人类癌症。本文于2022年9月发表于“Journal for ImmunoTherapy of Cancer”(IF=12.469)上。
技术路线

结果
1)TNFR2是miR-125b-5p的直接靶点
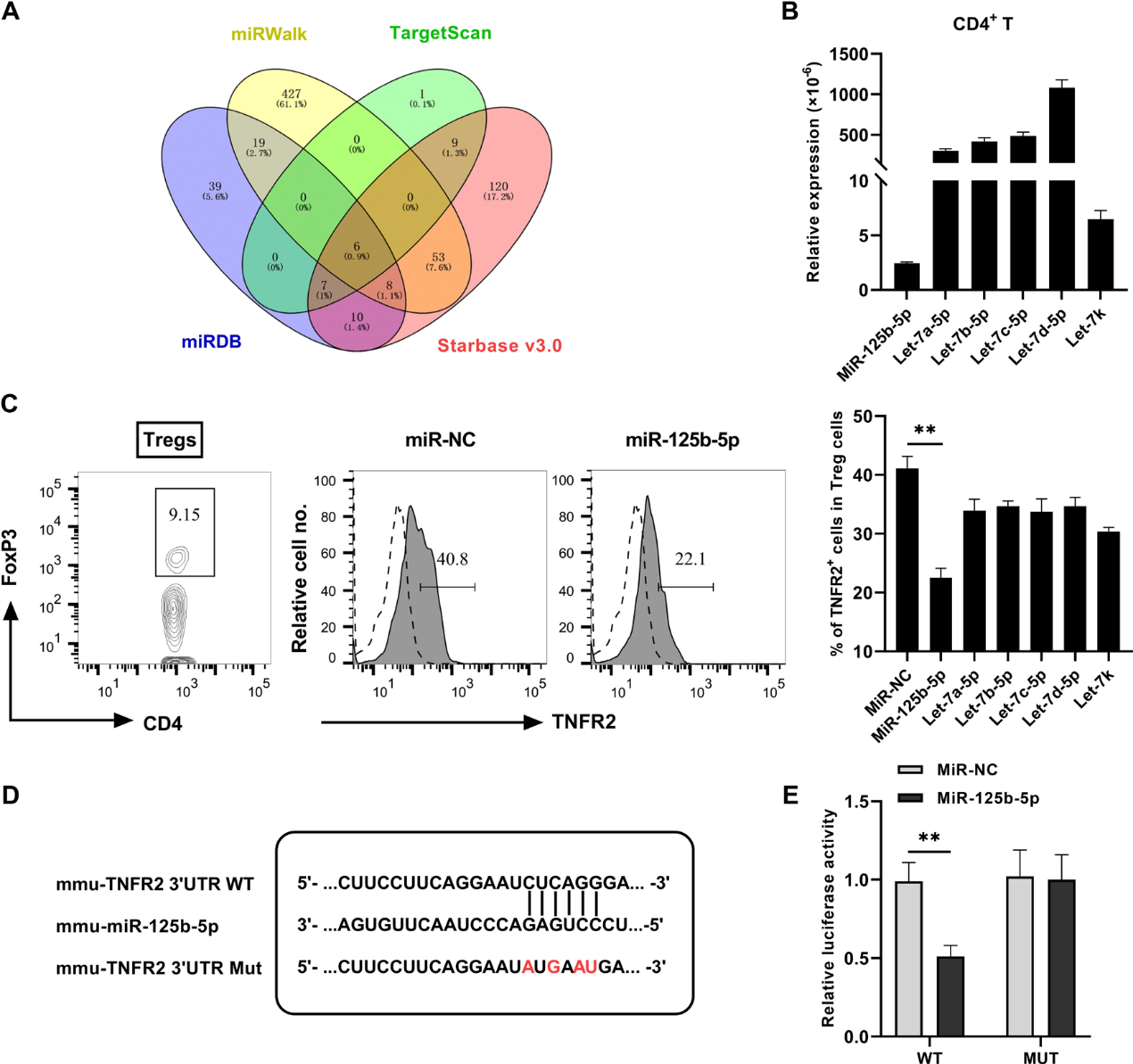
为了确定miR-125b-5p对TNFR2的影响,我们利用Targetscan、miRDB、miRWalk和Starbase V.3.0等网站的在线资源来预测miRNAs与TNFR2 3 'UTR的假定结合。从四个数据库的分析中得到六种常见的潜在miRNAs,如图1A所示。为了验证真正负责靶向TNFR2的miRNA,我们检测了CD4+T细胞中miRNAs的表达。如图1B所示,miR-125b-5p在CD4+T细胞中的表达明显低于其他5种miRNAs。然后我们合成并转染这6种miRNAs模拟物到CD4+T细胞中,发现TNFR2+ Treg的比例明显降低。有趣的是,miR-125b-5p过表达对TNFR2表达的抑制作用比其他五种过表达的要强得多(图1C)。含有miR-125b-5p内互补结合位点的TNFR2的3'UTR如图1D所示。此外,我们观察到miR-125b-5p的过表达降低了TNFR2的WT 3'UTR中荧光素酶的活性(图1E)。这些数据表明miR-125b-5p可以直接靶向TNFR2。
2)miR-125b-5p下调Treg中TNFR2的表达
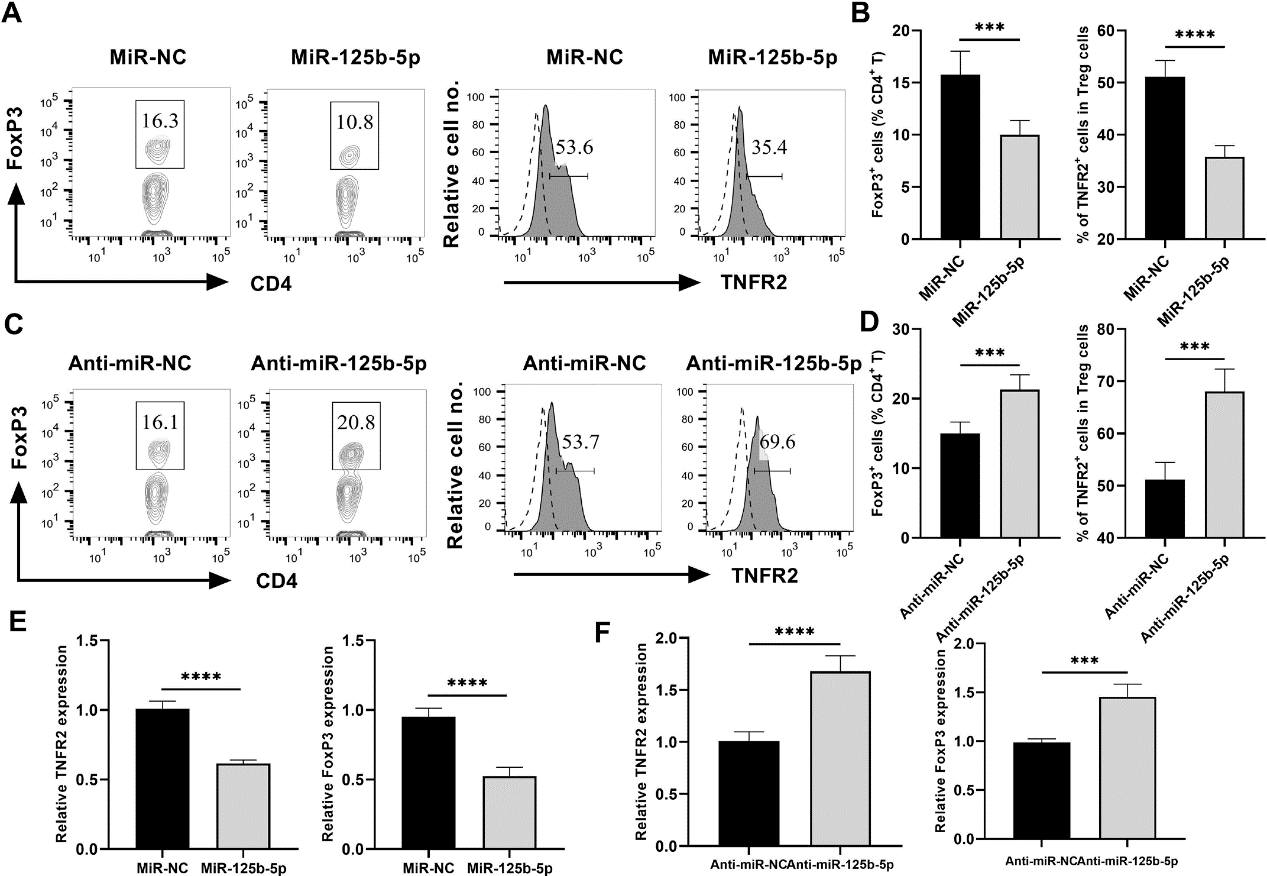
此前我们发现TNFR2在Treg表型和功能稳定性中起着至关重要的作用,TNF- TNFR2信号刺激Treg的激活并增强其抑制活性。因此,miR-125b-5p可能通过下调TNFR2表达降低Treg的稳定性。结果显示,miR-125b-5p在CD4+T细胞中过表达后,FoxP3+ Treg细胞比例显著降低40%,TNFR2表达下调40%左右(图2A,B)。与此形成鲜明对比的是,miR-125b-5p表达的沉默导致Treg在CD4+ T细胞中的比例增加30%,使TNFR2表达增加~25%(图2C,D)。有趣的是,在miR-125b-5p过表达的Treg中,TNFR2和FoxP3的转录水平也显著降低(图2E),而anti-miR-125b-5p处理后,TNFR2和FoxP3的表达水平升高(图2F)。因此,我们的数据表明miR-125b-5p可以显著降低Treg中TNFR2和FoxP3的表达。
3)miR-125b-5p抑制Treg的增殖,减弱Treg的抑制活性
有令人信服的证据表明,Treg中TNFR2表达是其免疫抑制功能所必需的。因此,miR125b-5p降低TNFR2的表达可能会减弱Treg功能。为了验证这种可能性,对正常C57BL/6J小鼠的Treg细胞进行MACS-纯化(图3A)。结果显示,miR- 125b-5p过表达可使Treg细胞增殖减少40%(图3B,C)。相比之下,miR-125b-5p沉默后,Treg细胞增加30%(图3D,E)。此外,miR-125b-5p过表达的Treg细胞的抑制活性明显降低(图3F,G),说明miR-125b-5p能够调节Treg的功能,这至少部分是由于下调TNFR2所致。

4)miR-125b-5p抑制Treg中的代谢相关信号通路
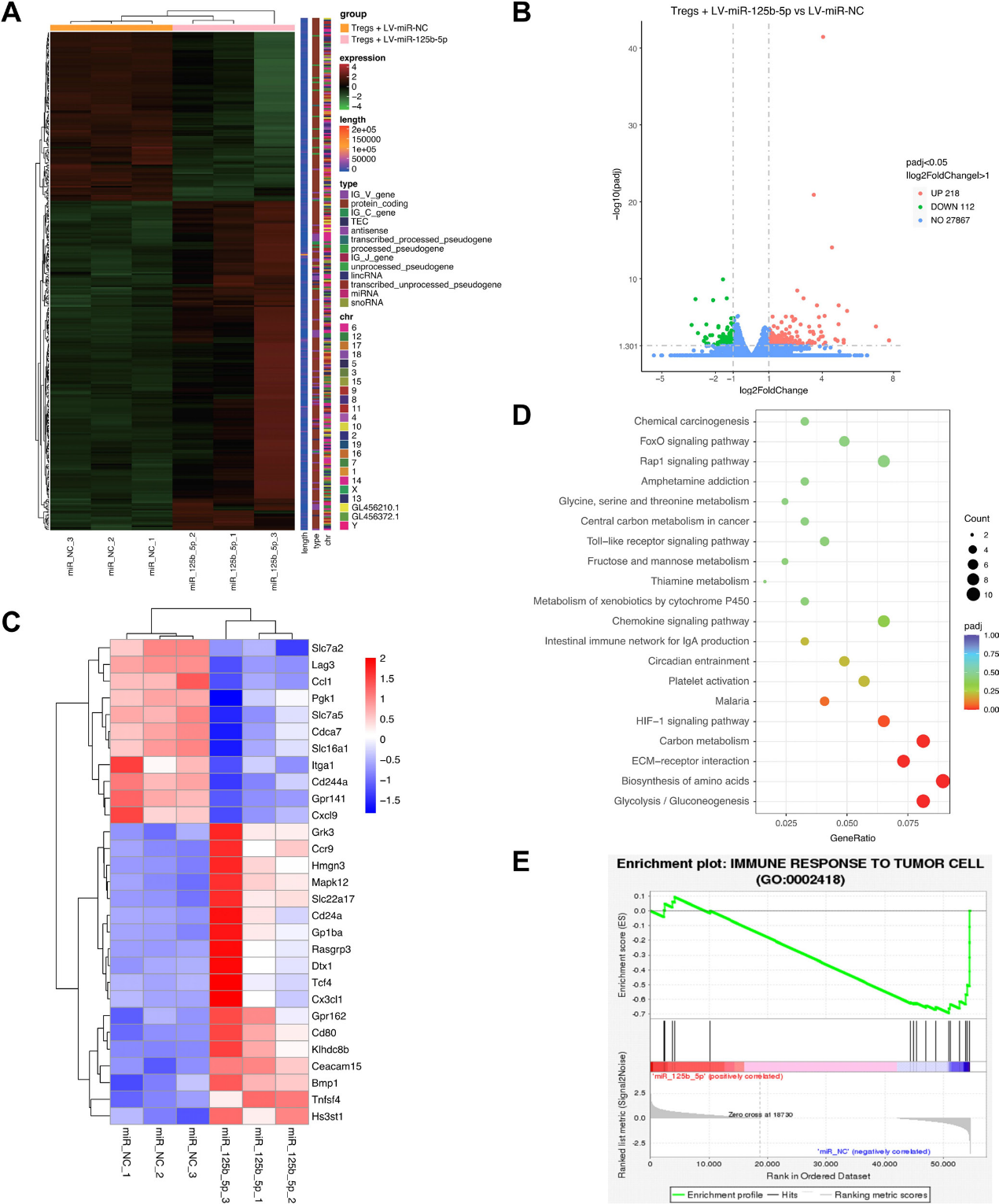
为了进一步了解miR-125b-5p对Tregs调控作用的分子基础,LV-miR-125b-5p转染Tregs的转录组序列呈现差异表达基因模式(图4A),其中下调112个基因,上调218个基因(图4B)。如图4C所示,上调最多的基因有Tnfsf4、Bmp1、Hs3st1、Cd80、Gpr162,表达下调的基因有Lag3、Ccl1、Pgk1、Cxcl9、Itga1等。GO和KEGG通路分析显示,差异表达的基因主要参与糖酵解、碳代谢和HIF-1信号通路,这些信号通路是已知的细胞代谢调节因子(图4D)。此外,GSEA分析显示miR-125b-5p的表达影响对肿瘤细胞进展的免疫应答(图4E)。综上所述,这些发现进一步阐明了miR-125b-5p在调节Treg功能中的重要作用。
5)在小鼠MC38肿瘤模型中,Ago-125b-5p的抗肿瘤作用与TNFR2表达的Treg的减少有关
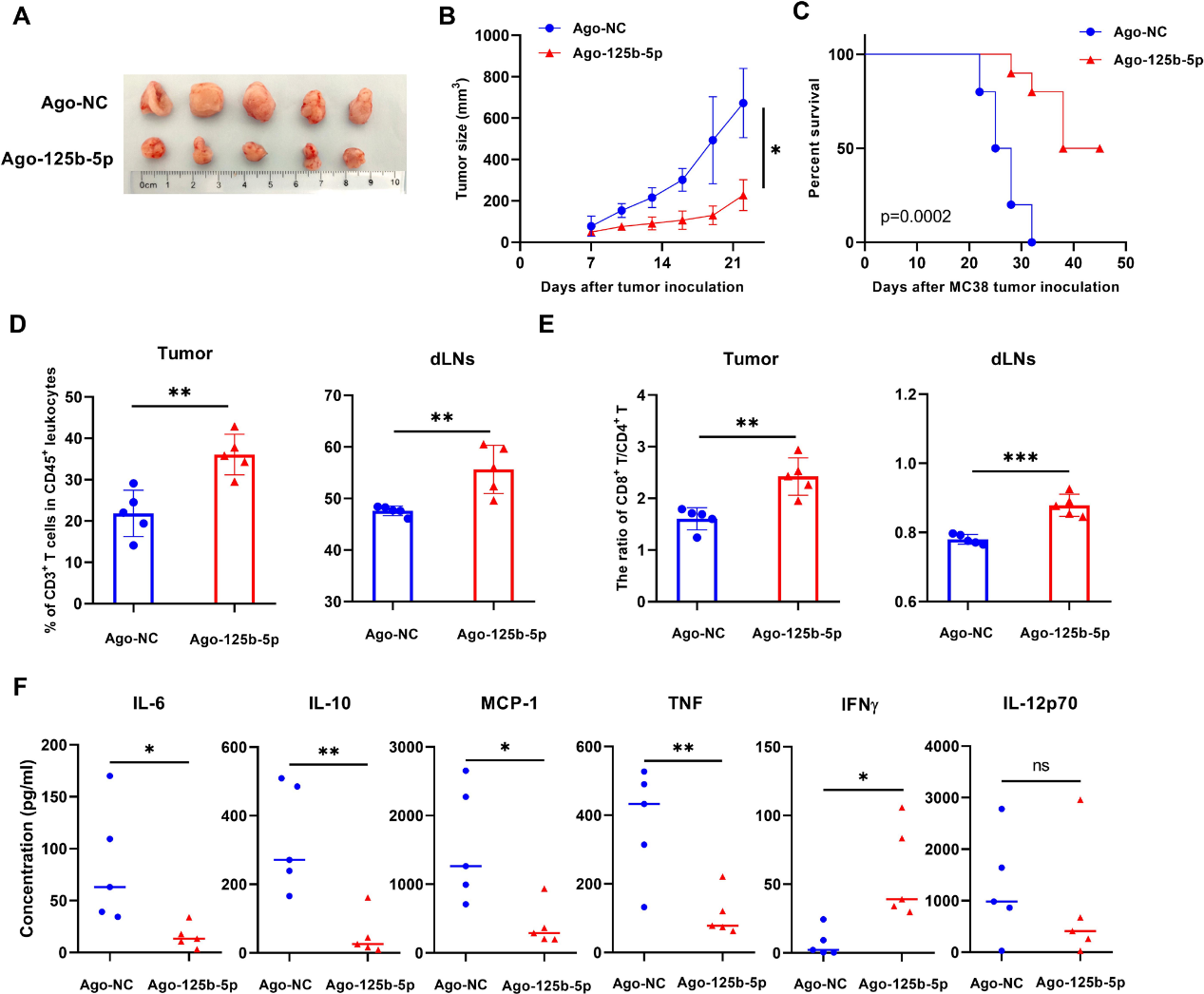
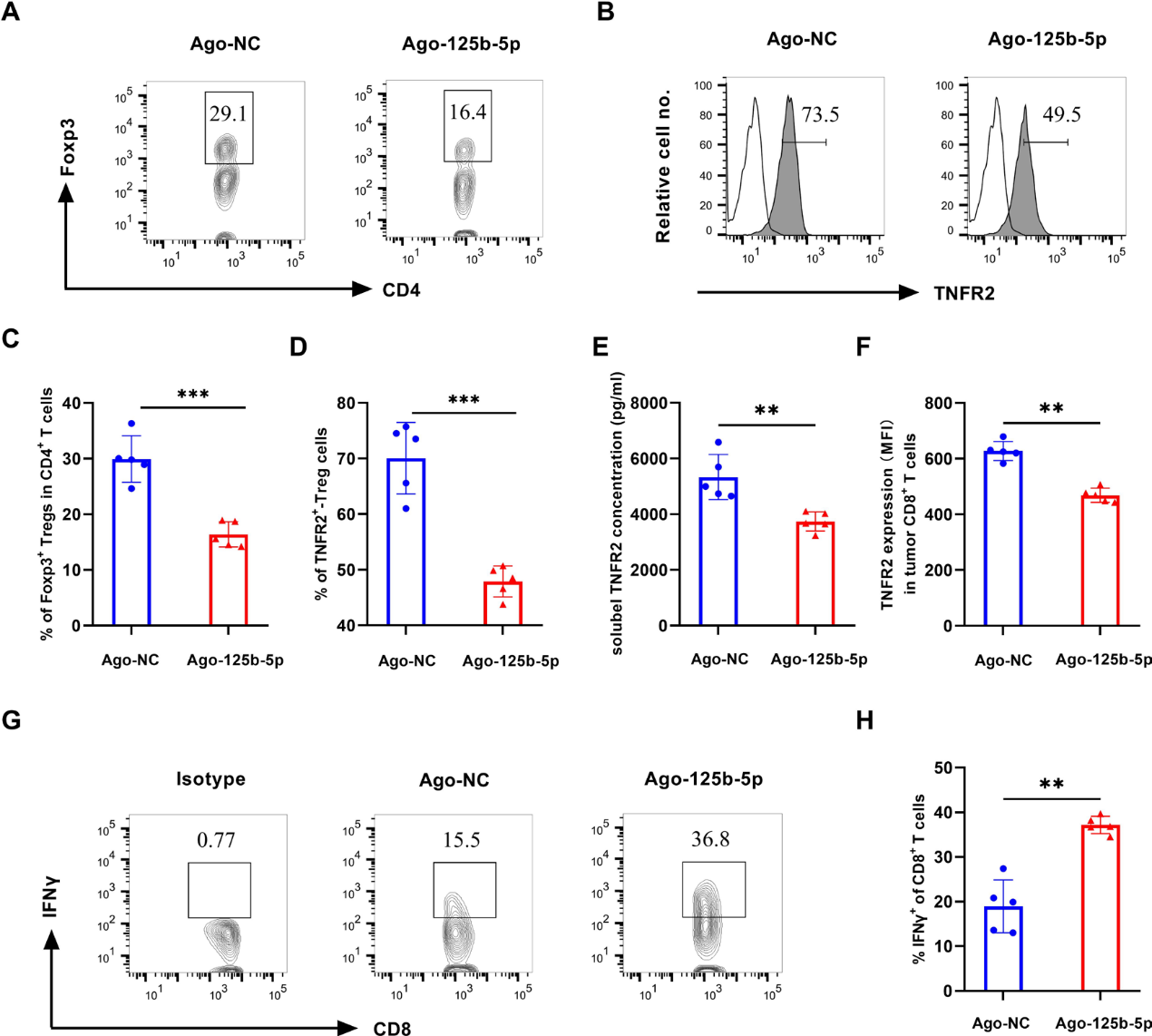
为了进一步研究miR-125b-5p过表达对肿瘤生长的影响,C57BL/6J小鼠皮下MC38肿瘤建立后瘤内注射Ago-125b-5p,观察肿瘤生长情况。结果表明,Ago- 125b-5p能显著抑制肿瘤生长(图5A,B),并能有效延长荷瘤小鼠的生存时间(图5C)。Ago-125b-5p处理后,肿瘤内CD3+ T淋巴细胞浸润明显增加,并引流LNs (图5D),而肿瘤组织中CD8/CD4 T细胞比值增加,同时引流LNs (图5E)。此外,Ago-125b-5p治疗显著降低了荷瘤小鼠血清中IL-6、IL-10、TNF和MCP- 1的水平,而IFNγ水平升高(图5F)。我们进一步分析Treg及其TNFR2在肿瘤环境中的表达,发现Ago-125b-5p处理小鼠肿瘤浸润CD4+ T细胞中Foxp3+ Treg细胞的比例显著降低(图6A,C),同时Treg细胞TNFR2的表达显著降低(图6B,D)。有趣的是,Ago-125b-5p治疗小鼠血清中TNFR2的可溶性水平降低(图6E)。Ago- 125b-5p处理的肿瘤浸润的CD8+ T细胞中TNFR2表达下调(图6F),而肿瘤组织中CD8+T细胞中IFN-γ表达升高(图6G,H)。这些结果表明表达TNFR2的Treg细胞的减少和CD8+T细胞的调动至少部分归因于miR-125b-5p的抗肿瘤作用。
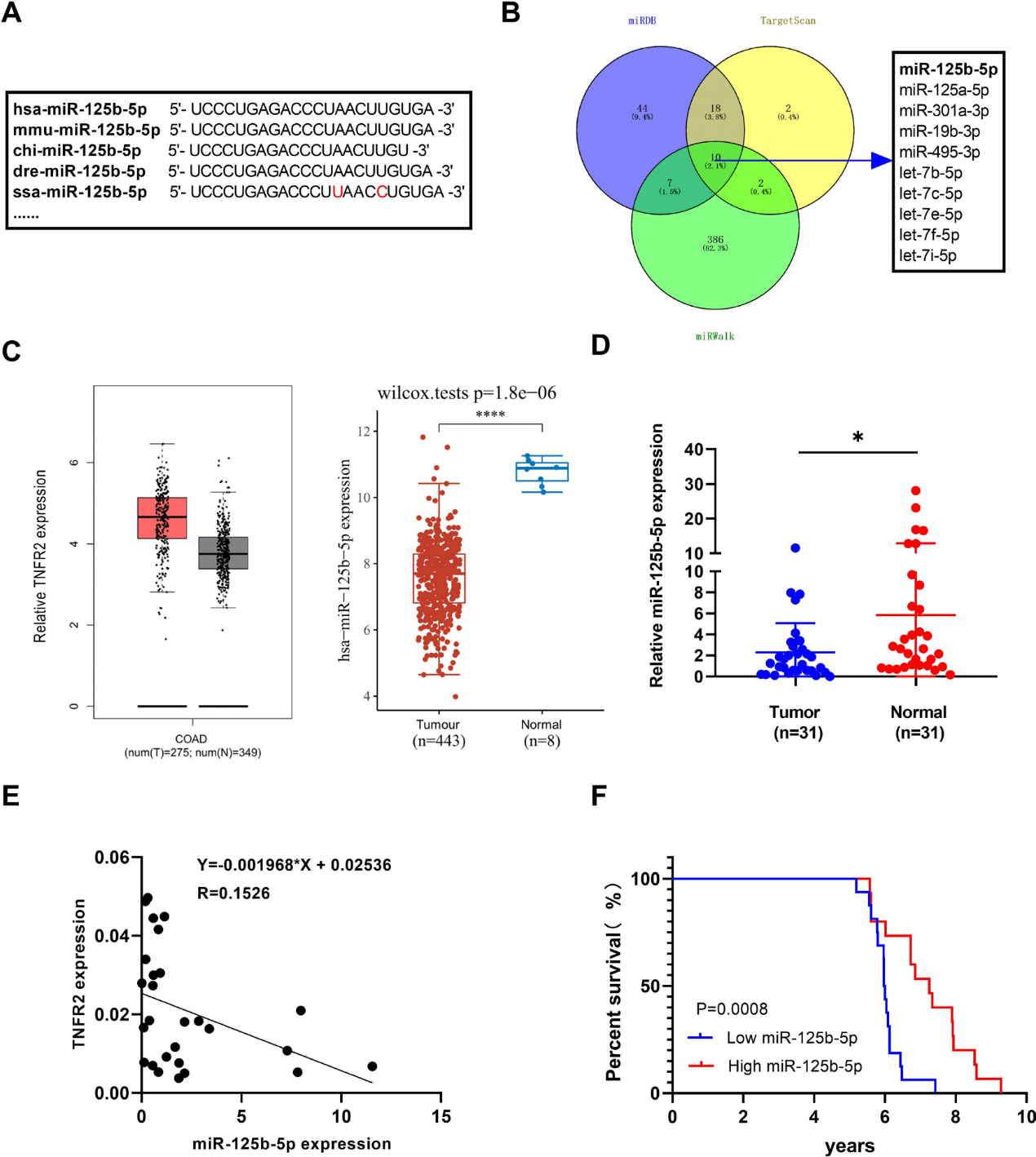
6)miR-125b-5p低表达的临床相关性可能与人结肠癌患者TNFR2高表达相关
通过生物信息学分析,我们发现miR-125b-5p的成熟序列在大多数脊椎动物物种中高度保守,包括人类和小鼠(图7A)。为了预测在人类TNFR2的3'UTR中具有结合位点的假定miRNAs,我们分析了在线数据库(Targetscan、miRDB和miRWalk)。结果表明miR-125b-5p也可以直接靶向人类TNFR2(图7B)。根据TCGA队列的数据,我们还发现与邻近正常组织相比,人类COAD肿瘤组织中TNFR2表达水平较高,miR-125b-5p表达水平较低(图7C)。此外,对31对结肠癌肿瘤组织进行qRT- PCR分析,证实miR-125b-5p在肿瘤组织中明显降低(图7D)。TNFR2表达与miR-125b-5p在人类癌症中的关系如图7E所示。Kaplan- Meier生存分析显示,癌症患者预后不良与miR-125b-5p低表达相关(图7F)。总之,miR-125b-5p与TNFR2在人肿瘤组织中的表达呈负相关。
结论:
我们的数据支持TNFR2表达下调至少部分归因于miR-125b-5p对Treg活性的负调控。靶向miR-125b-5p可能是一种通过消除肿瘤浸润的TNFR2表达的Treg的癌症免疫治疗新策略。
参考文献:
Jiang M, Yang Y, Niu L, Li P, Chen Y, Liao P, Wang Y, Zheng J, Chen F, He H, Li H, Chen X. MiR-125b-5p modulates the function of regulatory T cells in tumor microenvironment by targeting TNFR2. J Immunother Cancer. 2022 Nov;10(11):e005241. doi: 10.1136/jitc-2022-005241.






