单细胞测序显示肝细胞癌中的免疫抑制景观
肝细胞癌占原发性肝癌病例的75-85%,是全球第三大癌症相关死亡原因。近日,有研究的通过检测肝细胞癌肿瘤免疫微环境(TIME),对单细胞和大块组织测序数据的综合分析来研究肝细胞癌的时间,揭示了肝细胞癌的时间格局,突出了主要免疫细胞类型的异质性及其在形成免疫抑制环境中的潜在机制。作者认为阻断时间的形成可能是治疗肝癌的一种有用的治疗策略。该研究发表于《Frontiers in immunology》,IF:8.786。
技术路线:
主要研究结果:
1. 单细胞转录组分析确定了细胞组成
该研究纳入了7个HCC样本和相应的正常组织。通过质控的细胞共有39667个,其中21121个来自肿瘤组织,其余来自正常组织。然后这些细胞被分成36个簇(图1A),前5个最重要的基因突出显示在热图上(图1B)。HCC中有9种主要的细胞类型,除肝细胞、平滑肌细胞、内皮细胞、组织干细胞外,还有许多免疫细胞(PRPTC+),包括T细胞、单核细胞、自然杀伤(NK)细胞、巨噬细胞、B细胞(图1D、E)。在研究9种细胞系的分布时,作者注意到肿瘤组织中的主要细胞类型为肝癌细胞,而正常组织中的主要细胞类型为T细胞(图1C)。瘤内和瘤周组织中T细胞和NK细胞的差异很大。作者认为,肿瘤组织中T细胞和NK细胞的耗竭与免疫抑制的形成有关,与肿瘤的进展有不可分割的联系。与T细胞和NK细胞相比,HCC肿瘤组织中巨噬细胞和单核细胞的比例增加(图1F)。新抗原是肿瘤特异性抗原(TSAs),来源于癌细胞中突变基因的表达,在正常组织中不存在。这些新抗原可吸引巨噬细胞以及单核细胞分化的DCs,后者可吞噬和呈递这些新抗原,导致巨噬细胞和单核细胞在HCC肿瘤组织中聚集。随后,分析了肿瘤组织与正常组织之间的基因表达差异(表S1),选出了表达量最高的5个基因,分别是肿瘤组织中的SPP1、AKR1C2、AKR1B10、AGT、EPHX1和正常组织中的NKG7、KLRD1、KLRB1、CCL5、CST7。然后标记上述基因在各细胞系中的表达情况(图1G, H)。正常组织中的高表达基因主要分布在T细胞和NK细胞中,且NKG7、KLRD1、KLRB1是T细胞和NK细胞的标记基因。
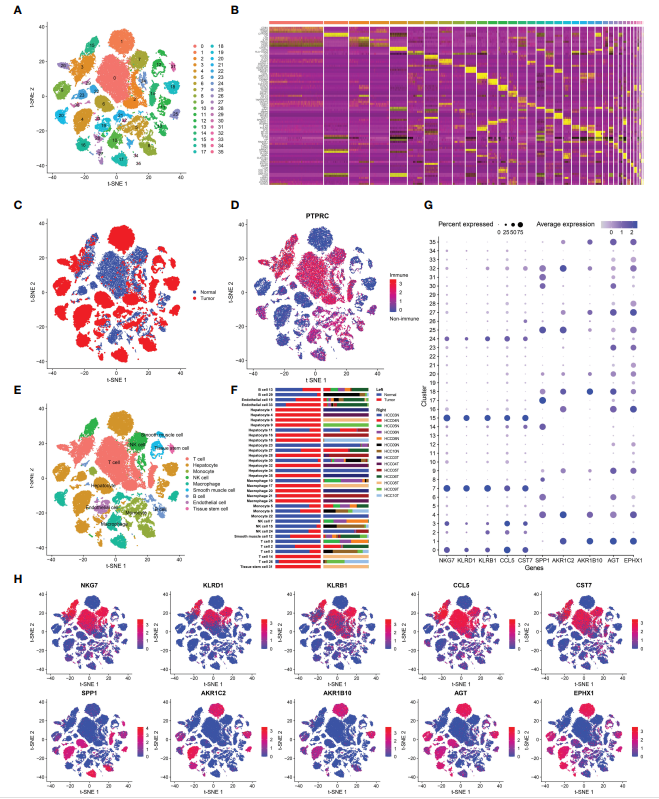
图1 肝癌的细胞类型分类
2. Treg细胞在HCC中富集,具有明显的代谢特征
为了研究T细胞的异质性,将12,884 个T细胞分为15个亚组,主要有4种细胞亚型:CD8+Tem、CD4+Tem、CD8+Tcm和Treg细胞。其中,CD8+ Tem细胞在正常组织中所占比例最高,而CD4+ Tem、CD8+ Tcm、Treg细胞主要在HCC组织中发现(图2C, D)。四种t细胞亚型的前三种标记基因如图2E所示。接下来,作者确定了四种t细胞亚型中免疫检查点的表达水平(图2F)。一些抑制检查点,如TIGIT, CTLA4, TNFRSF4和TNFRSF9,仅在Treg细胞中过表达。尽管Treg细胞是免疫细胞的次要组成部分,但在时间网络中发挥着关键作用。Treg细胞抑制抗癌免疫,阻碍对癌症的保护性免疫监视,阻止有效的抗肿瘤免疫反应的形成,从而促进肿瘤的发生发展。上述仅在Treg细胞中高表达的免疫检查点可以被认为是在HCC中恢复对癌细胞免疫的潜在治疗靶点。此外,坐着利用Monocle2 R包绘制了T细胞分化轨迹(图2G, H)。来自HCC组织的Treg细胞主要分布在分化轨迹的起点和终点,而CD8+ Tem细胞主要分布在分化轨迹的中间。通过调控Treg细胞分化和发育来耗尽和控制Treg细胞的策略值得进一步探索。此外,GSEA结果显示,与其他t细胞亚型相比,Treg细胞富集了糖酵解、糖异生、谷胱甘肽代谢、淀粉和蔗糖代谢等代谢途径(图2I),表明HCC中Treg细胞不受代谢抑制,具有代谢的灵活性。该项研究结果将有助于更好地理解异常Treg细胞代谢的促肿瘤机制及其对分化和发展过程的影响。
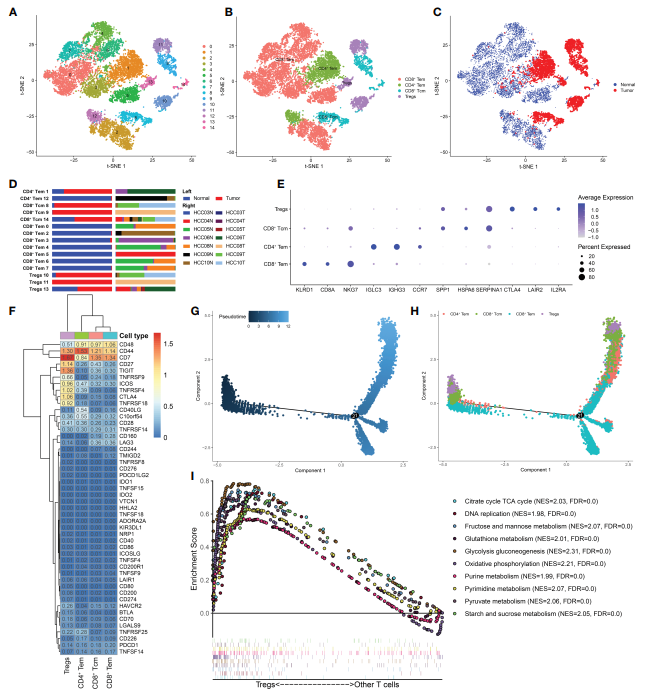
图2 Treg细胞在HCC中富集,具有明显的代谢特征
3. 巨噬细胞与肝癌的免疫抑制环境有关
为了研究HCC微环境中的相互作用网络,采用基于python的细胞-细胞通讯分子分析工具CellphoneDB识别TME中的配体-受体对。使用Cytoscape对生成的网络进行可视化。在HCC组织中,除了上皮细胞和平滑肌细胞外,巨噬细胞与其他细胞类型的交流最为丰富(图3A),可见巨噬细胞在TME中起着重要作用。为了评估巨噬细胞的异质性,作者将所有巨噬细胞聚为8个亚簇(图3B)。通过对细胞来源的注释,簇1、2、4和7仅来自癌症组织,而簇3和8仅来自正常组织。此外,簇5和簇6同时来自癌症组织和正常组织(图3C, D)。由于越来越多的证据显示TREM2在肿瘤相关巨噬细胞(TAMs)和骨髓源性抑制细胞(MDSCs)中发挥作用,作者分析了TREM2在8个簇中的表达,发现TREM2在簇1、簇2和簇4中表达高(图3E),这些簇都来自癌症组织。为了进一步研究TREM2的临床价值,将TCGA LIHC队列中360例HCC患者根据TREM2的表达水平分为两组。过表达TREM2组的预后明显较差(图3F),提示TREM2可能在TME的免疫抑制中起重要作用。随后,确定免疫检查点在8个聚类中的表达。簇1和簇4的LAIR1表达水平高于其他簇(图3G)。LAIR1可以阻断LAIR1和TGF-b信号通路来重塑TME,使PD - L1介导的肿瘤根除成为可能。作者的结果也表明PD - L1介导的肿瘤根除可能是一种潜在的治疗策略。GSVA显示,聚类4的细胞中脂肪生成、脂肪酸代谢和胆油酸代谢通路富集,而炎症反应以及M2-like TAMs的特征,补体和干扰素(IFN)通路被显著抑制(图3H)。树突状细胞在与肿瘤代谢密切相关的过程中更显著地富集,如上皮-间质转化、缺氧和血管生成。最后,分析了TFs在各个子组中的表达情况。与其他簇相比,簇1和簇4的KLF6、PRDM1、STAT1、JUNB和HES1表达更高(图3I)。这些结果表明巨噬细胞在TME免疫抑制中的重要作用,以及参与这一过程的潜在机制和TFs。
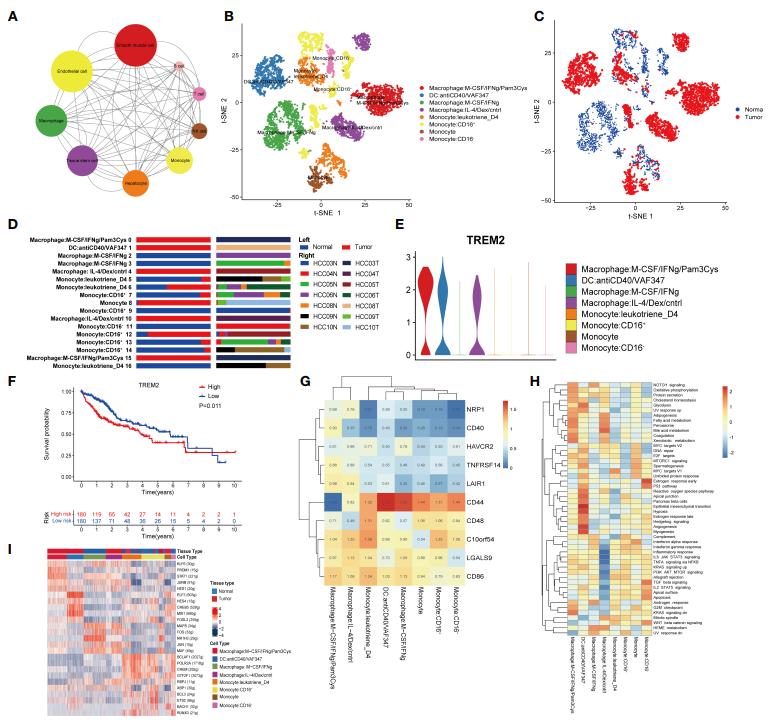
图3 巨噬细胞与TME的免疫抑制环境有关
在瘤周和肿瘤组织中分别检测到3151个和187个NK细胞,并将其聚类为11个子集(图4A, B)。如前所述,与正常组织相比,肿瘤组织中NK细胞的比例显著降低。在HCC中NK细胞明显减少,提示癌细胞形成了一种抑制NK细胞增殖的环境,可能通过缺氧或代谢抑制,直接导致NK细胞抵抗攻击。NK细胞在肿瘤和正常组织间的差异基因如图4C所示(图4C)。另外,肿瘤来源的NK细胞分布在簇9和10中,而其他簇的NK细胞则来自正常组织(图4A、B)。为了研究簇9和簇10的异质性,检测了NK细胞激活受体CD160、NCR3、IFNG (IFNG)和FASLG在簇9、簇10和正常组织中的表达(图4D):与簇9的细胞相比,簇10的细胞具有更强的细胞毒性,而簇9的细胞则呈现出衰竭状态,这表明NK细胞在肿瘤和慢性感染的情况下会耗尽,表现出低细胞毒性和效应功能。伪时间分析发现,簇10细胞出现在分化轨迹的开始阶段,而簇9细胞则出现在分化轨迹的结束阶段,这是一个耗尽的NK细胞子集(图4E)。作者认为cluster 10细胞逐渐转化为cluster 9细胞,肿瘤浸润并形成TME。随后,通过SCENIC分析发现,CEBPD、FOS和JUN调控的基因在cluster 10中显著激活(图4F)。这些结果证实了在HCC中存在两种具有不同细胞毒性的NK细胞簇,并提示TME可能逐渐发展出多种抑制NK细胞免疫毒性的机制。
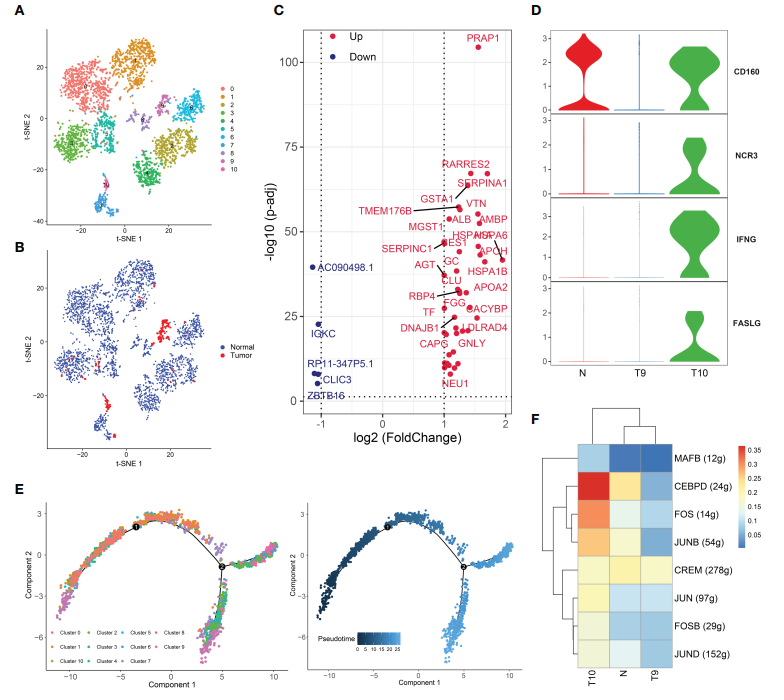
图4 两种不同的NK细胞亚群在HCC中具有不同的细胞毒能力
5. HCC中记忆B细胞低活性状态
1395个B细胞,分为6个簇,并标注为4个亚型:B细胞、未成熟B细胞、记忆B细胞和浆细胞(图5A)。几乎所有未成熟B细胞都来自正常组织,而记忆B细胞则来自肿瘤组织(图5B, C)。对记忆B细胞子集进行了进一步的分析,确定了肿瘤组织和正常组织之间记忆B细胞亚群的差异(图5D)。利用CytoTRACE预测肿瘤来源记忆B细胞具有更高的分化潜能(图5E, F)。同样,比较不同组织来源记忆B细胞亚型的细胞周期发现,肿瘤来源记忆B细胞更大比例处于G2/M期,表明其增殖能力更强,与肿瘤来源记忆B细胞低分化状态相一致(图5G)。另外,肿瘤组织中处于激活状态的记忆B细胞明显少于瘤周组织(p = 0.011),这可能与抗肿瘤反应的发生有关(图5H)。鉴于TME和癌细胞之间的串扰在肿瘤发生发展中的重要作用,作者比较了癌细胞和记忆B细胞之间的受体-配体对。发现与CD74+CXCR4+和CD74+CD44+相互作用的巨噬细胞迁移抑制因子(MIF)在肿瘤样本中特异性表达(图5I)。这也是首次发现MIF可抑制HCC中的记忆b细胞活性,抑制MIF-CD74轴可能是一种新的治疗策略。
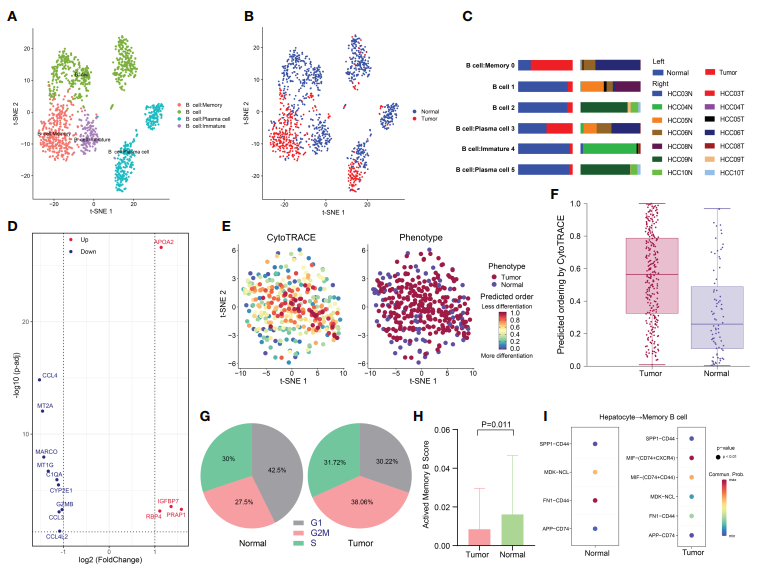
图5 HCC中记忆B细胞低活性状态
6. 肝癌细胞的高代谢和免疫抑制
作者发现肝癌细胞中存在明显的CNV。同时,肝癌细胞中APOA2、APOA1、AMBP、TTR、APOH、ASGR1表达水平高。此外,来自同一患者的肝癌细胞往往聚集在一起(图6A),这表明不同患者的肝癌细胞之间存在显著的异质性。通过scRNA-seq数据分析检测肝癌细胞与肝细胞之间的DEGs:MT1M, MT1H, MT1G, MT1F, MT1E, MT1X和MT1A,在癌细胞中显著下调 (Table S2和Figure 6B)。GO富集分析显示,上调的DEGs主要富集于核糖核苷酸代谢过程、嘌呤核苷酸代谢过程、前体代谢物和能量产生(图6C)。GSVA结果与GO富集分析结果基本一致(图6D),癌细胞的炎症反应受到明显抑制。SCENIC分析显示,HSF1在癌细胞中显著上调,HSF1通过诱导热休克蛋白的表达来维持应激环境下的蛋白稳定(图6H)。
为了根据癌细胞分化程度对HCC患者进行分层,并提供精确的治疗建议,作者又进行了癌细胞分化轨迹(图6E)。不同的肿瘤细胞分化状态影响肿瘤细胞分化、进展以及患者预后。因此,使用ConsensusClusterPlus根据这些DEGs将TCGA LIHC患者分为3个簇(图6F)。K-M分析显示,聚类2组患者的OS明显短于聚类1和聚类3组患者(图6G)。聚类2组患者中晚期及肿瘤低分化患者较多,说明不同分化程度的癌细胞具有不同的侵袭能力,影响癌症进展。
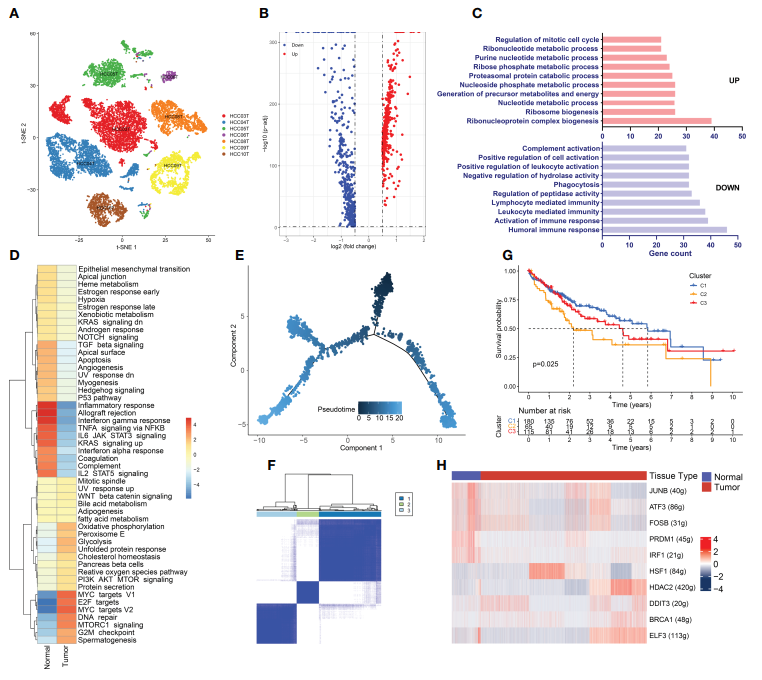
图6 肝癌细胞的高代谢与免疫抑制
结论:
这项研究揭示了HCC的时间格局,强调了主要免疫细胞类型的异质性及其在免疫抑制环境形成中的潜在机制,为调节HCC的时间提供了新的理论基础,并将有助于新的免疫疗法的开发。






