23分文章揭示外泌体介导肺腺癌新机制
最近的研究表明,癌细胞除了消耗葡萄糖,可能还偏向肿瘤微环境中特定的能源物质。然而,相关机制尚不清楚。本研究强调靶向CAF特异性lncRNA以抑制谷氨酰胺流入和逆转LUAD的肿瘤活性的治疗潜力。LINC01614可能是LUAD的潜在生物标志物和治疗靶标。本研究于2022年10月发表于期刊《J Hematol Oncol》(IF:23.168)。
技术路线:

主要研究结果:
1、来自CAFs的外泌体包装RNA增强谷氨酰胺的摄取和LUAD细胞进展
作者首先验证了CAFs(癌症相关成纤维细胞)在LUAD(肺腺癌)中的作用。在LUAD的组织微阵列(TMA)中通过α-SMA免疫组织化学(IHC)染色鉴定活化成纤维细胞的数量(图S1A)。与正常肺组织相比,α-SMA在LUAD中高度过表达(图S1B)。α-SMA + CAF密度与T阶段呈正相关(图S1C)。α-SMA的高表达与较差的总生存期相关(图S1D)。使用原代CAF和来自人LUAD样品的配对正常成纤维细胞(NFs)进行体外功能实验(图S1E-F)。作者建立共培养Transwell系统后,发现与CAFs共培养的LUAD细胞系(谷氨酰胺敏感的A549和谷氨酰胺不敏感的H1975)比单独培养或与NFs共培养的LUAD细胞系表现出更高的增殖,迁移和入侵能力(图S1G-I)。
为鉴定CAF介导的LUAD进展的分子机制,作者进行了RNA-seq分析,转录组的反应体途径分析和基因集富集分析(GSEA)显示,在与CAFs共培养的A549细胞中,参与氨基酸和衍生物代谢的基因显著上调(图1A,B)。然后作者分别检测在单独培养的A549和与NFs和CAFs共培养的A549中线粒体耗氧率(OCR)和细胞外酸化率(ECAR),线粒体活性和糖酵解的量度的变化,发现与CAFs共培养的LUAD细胞表现出更高的线粒体OCR和ATP合成(图1C,D)。此外,作者通过代谢组学研究鉴定用指定外泌体处理的A549条件培养基中差异表达代谢物(图1E)。随后发现CAF衍生的外泌体显著增强了线粒体OCR、谷氨酰胺消耗率、谷氨酰胺流入、ATP合成,来自谷氨酰胺分解代谢的TCA中间体的丰度以及LUAD细胞的增殖、迁移和侵袭(图1F-K)。更重要的是,使用anti-CD31抗体消耗CAFs CM中的外泌体显著抑制它们在促进谷氨酰胺代谢和LUAD细胞增殖、迁移和侵袭中的作用(图1F-K)。这些结果表明,CAF衍生的外泌体增强了谷氨酰胺的流入并促进了LUAD细胞的发展。另外,作者观察预处理的外泌体与RNase和Triton-X-100消除了CAFs对LUAD细胞的影响(图1L-N)。这些数据证实来自CAFs的部分外泌体包装RNA有助于增强谷氨酰胺代谢LUAD。
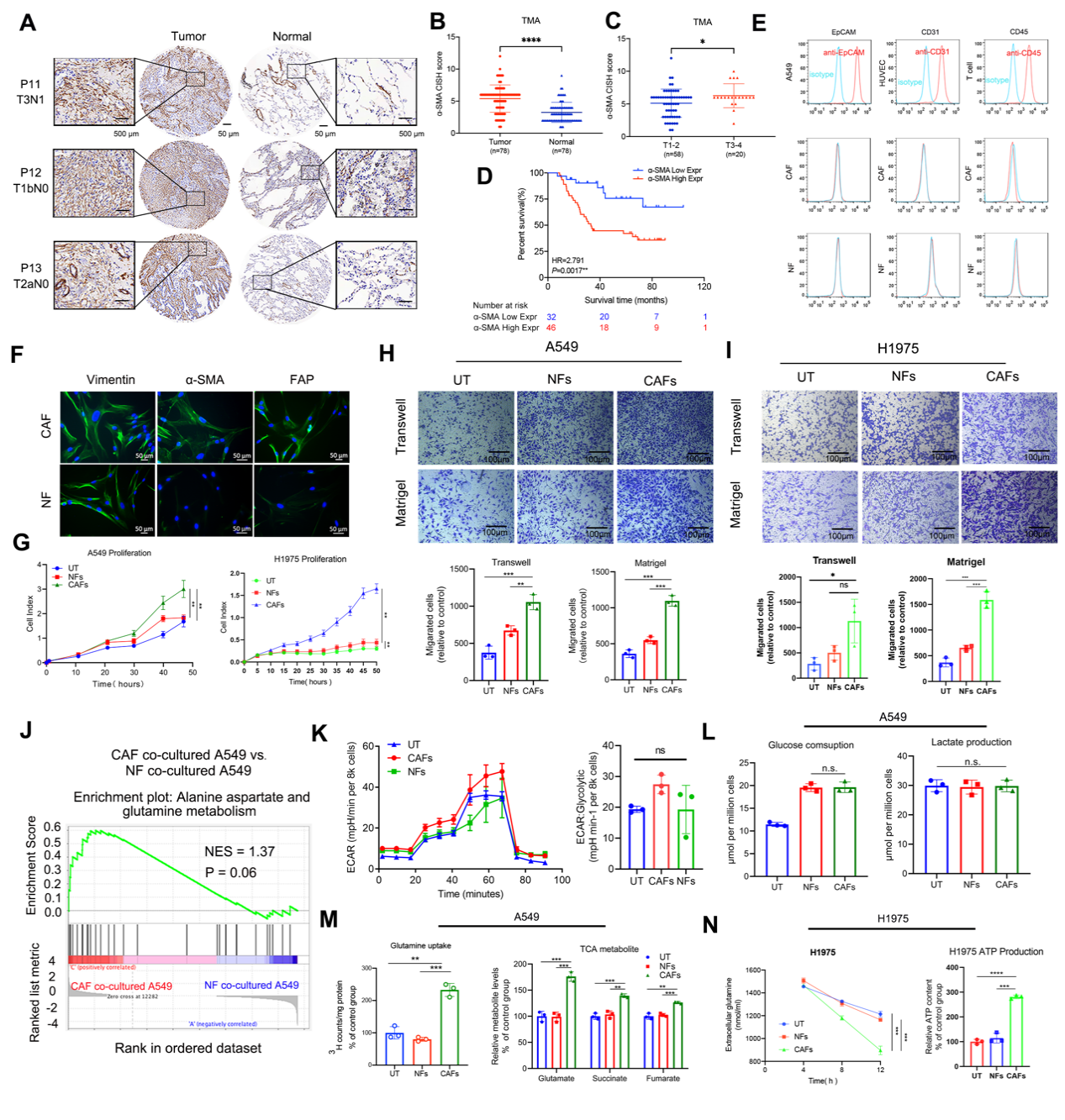
图S1 CAFs促进LUAD进展,增强LUAD细胞的谷氨酰胺代谢
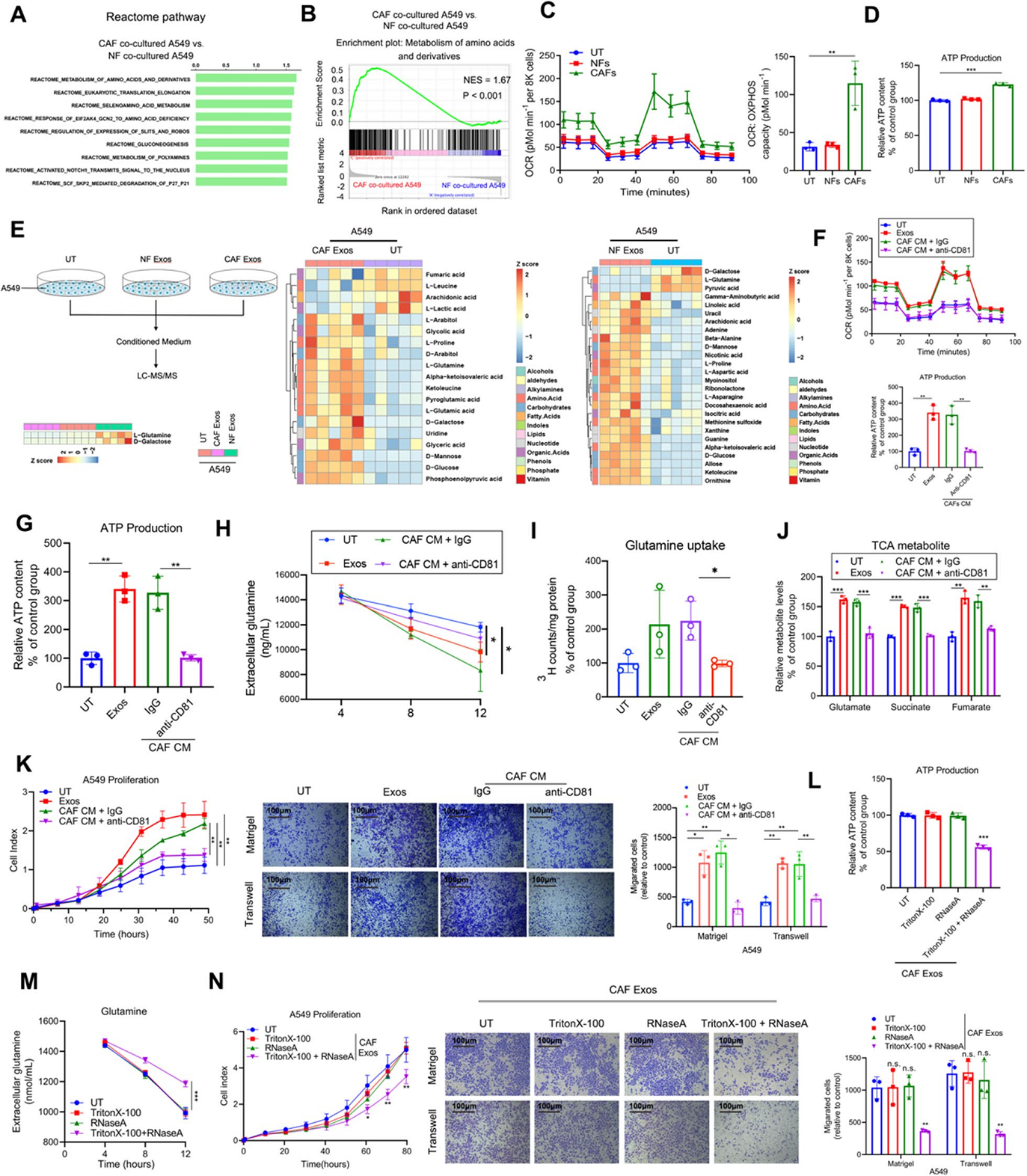
图1来自CAFs的外泌体包装RNA增强LUAD细胞中谷氨酰胺的摄取和进展
2、特定于CAF的lncRNA LINC01614的验证和转移
为了证明CAF特异性lncRNA是否介导LUAD细胞的谷氨酰胺addicting,作者根据NJLCC队列筛选了CAF特异性lncRNA。作者检查了TCGA数据及其在外泌体中的存在,共纳入149例非小细胞肺癌患者。为筛选CAF相关的lncRNA,首先进行了一项分析,以基于TCGA LUAD数据集鉴定LUAD组织中过表达的lncRNA。发现649个lncRNA在LUAD组织中被上调(图2A)。此外,作者基于NJLCC队列和TCGA LUAD数据集确定195个lncRNA与TME群体的相关性。在195个与TME相关的lncRNA中,20个lncRNA与20种类型的LUAD基质细胞高度正相关,包括两种与CAFs高度正相关的lncRNA(LINC01614(ENSG000000230838和ENSG00000261327)(图2B)。
qRT-PCR实验发现,与LUAD细胞系、MRC5细胞(人胚肺成纤维细胞)和paired NFs相比,LINC01614而不是ENSG00000261327在CAFs中高表达(图2C)。然后,作者通过荧光激活细胞分选(FACS)从LUAD组织中分离出CAFs,并且LINC01614而不是ENSG00000261327主要在CAFs中表达,而不在非CAF细胞中表达(图2D)。鉴于CAF exosomal RNA增强了谷氨酰胺流入和LUAD的进展,作者调查了LINC01614是否可以从CAFs中以外泌体的方式释放。在RNase处理后,CAF CM中LINC01614的表达没有改变,但是当与RNase和Triton-X-100共孵育时LINC01614的表达显著降低(图2E),这表明LINC01614可以从CAF释放,并且细胞外LINC01614主要被膜包裹而不是直接释放。此外,与NFs相比,CAFs外泌体中LINC01614增加了五倍以上,在与CAF衍生的外泌体共培养的A549细胞中增加了三倍以上(图2F)。qRT-PCR结果表明,与炎性CAF (iCAF) 和antigen-presenting CAF (apCAF)相比,LINC01614在肌成纤维细胞 (myCAF) 中过表达。
为确认与CAF共培养的A549细胞中LINC01614的增加是否由外来体传播引起,作者在共培养前分别敲除了CAFs中外切体分泌的关键酶LINC01614和RAB27,以消除LINC01614的释放和外切体分泌(图2G)。抑制外泌体分泌也抑制了与CAFs共培养的A549细胞中LINC01614的上调(图2G)。重要的是,CAFs中的沉默LINC01614降低CAF外泌体中LINC01614的水平,而过表达LINC01614增加了CAF外泌体中的LINC01614水平(图2G)。
此外,荧光原位杂交 (FISH) 和免疫荧光 (IF) 分析表明LINC01614在CAFs中过表达,并通过LUAD组织的α-SMA IF staining确定LINC01614的表达与CAF浸润密度呈正相关(图2H)。为进一步确认CAF衍生的LINC01614是否伴随外泌体转移,在与荧光标记的A549细胞共培养之前,作者用5-ethynyl uridine (EU) 标记CAF RNA。通过EU-modification with azide-linked fluorescein 评估,24小时后,A549细胞获得CAF RNA(图2I)。此外,当CAF类似地用4-thiouridine (4sU) 标记时,CAF CM处理导致LINC01614从CAFs转移到A549细胞。相反,当使用exosome inhibitor GW4869,外泌体从CM中耗尽时,LINC01614没有转移到A549细胞(图2J)。这些数据表明CAF特异性lncRNA-LINC01614可以被释放,并通过外泌体从CAFs转移到LUAD细胞。
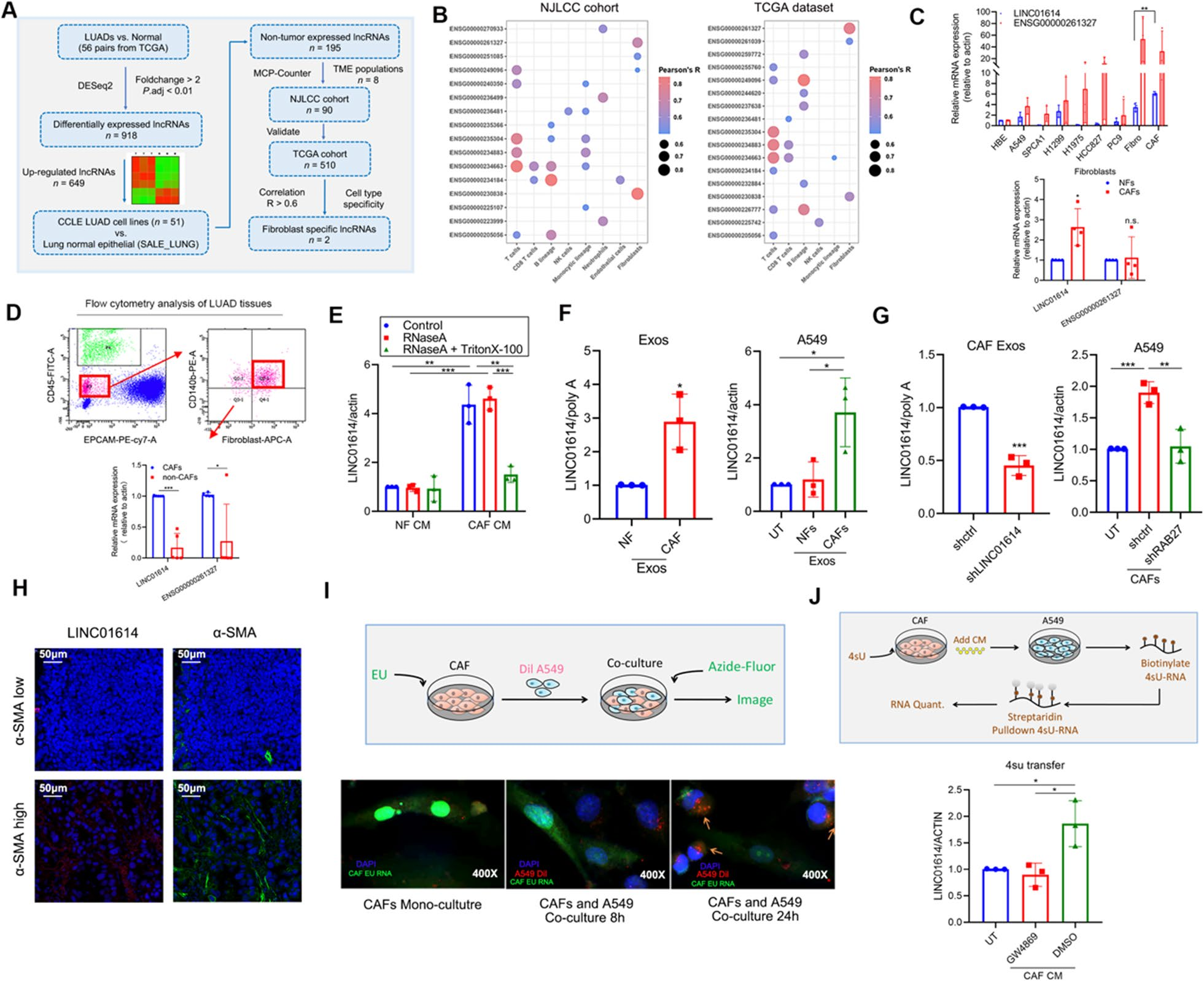
图2 外泌体在CAF特异性lncRNA LINC01614细胞间的转移
3、CAF-exosome packed LINC01614是一种致癌lncRNA,通过上调氨基酸转运蛋白来增强LUAD细胞的谷氨酰胺摄取
敲低shLINC01614沉默CAFs中LINC01614,或击倒RAB27抑制外泌体分泌都可以消除CAF诱导的LUAD细胞中谷氨酰胺的流入和利用(图3A,B)。异位LINC01614表达增强了LUAD细胞中谷氨酰胺的利用(图3C,D)。当处理LUAD细胞时,来自LINC01614-silencing CAFs的外泌体抑制了细胞增殖、迁移和侵袭,而来自CAFs的外泌体LINC01614异位表达促进这些能力(图3E,F)。此外,异位表达LINC01614还显著促进了LUAD细胞的恶化表现(图3G,H)。接下来,作者研究了LINC01614对LUAD细胞进展的相关作用是否与癌细胞的特异性谷氨酰胺addicting有关。结果表明,随着补充的谷氨酰胺浓度的增加,A549和H1975细胞对谷氨酰胺的addicting日益增加。异位LINC01614的表达增强了LUAD细胞的增殖,迁移和侵袭行为,但是当谷氨酰胺被剥夺时,未能增强LUAD细胞的恶性行为(图3I,K)。总的来说,这些数据进一步证实了LINC01614促进了对谷氨酰胺特异性上瘾的LUAD细胞进行的恶性进展。沉默LINC01614减弱了SLC38A2和SLC7A5,而过表达LINC01614增强了CAF外泌体处理的A549细胞中的表达(图3L,M)。此外,A549细胞中异位LINC01614的表达增强了SLC38A2和SLC7A5的表达(图3N)。这些数据表明,CAFs通过外泌体传递CAF特异性lncRNA-LINC01614,增强了谷氨酰胺的流入和利用以及LUAD细胞的恶化表现。
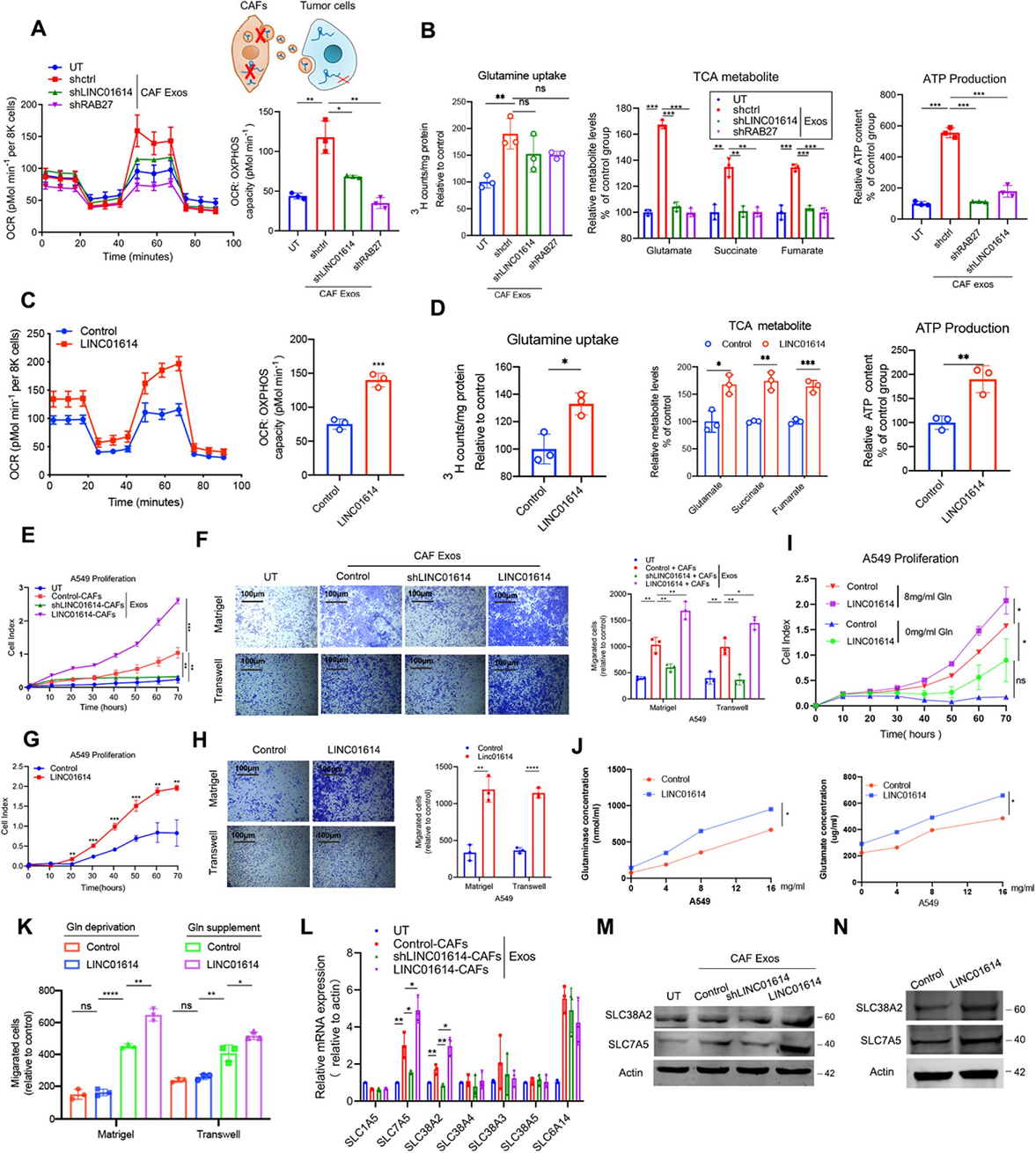
图3 CAF-exosome packed LINC01614通过上调氨基酸转运蛋白来增强LUAD细胞的谷氨酰胺摄取
4、LINC01614增强了ANXA2和p65的相互作用,促进NF - κB的激活
FISH assays验证LINC01614主要分布在CAF细胞质中。Immunoblotting和RNA immunoprecipitation (RIP) assays证实p65 (Rela)和Annexin A2 (ANXA2)与LINC01614相关(图4A,C)。此外,LINC01614与ANXA2可与p65共免疫沉淀(图4D),提示LINC0164、ANXA2和p65可形成一个三元络合物。LINC01614的加入,而不是反义的lncRNA,能有效地增强了p65和ANXA2之间的相互作用(图4E)。为进一步研究LINC01614与p65和ANXA2相关联的片段,作者生成了一系列LINC01614的截短片段。RTCA和Boyden chamber实验发现LINC01614的973-1775 nt与p65和ANXA2相互作用(图4F)。此外,一个缺乏LINC01614茎环结构的核苷酸突变减弱了p65和ANXA2之间的相互作用(图4G)。更重要的是,将LINC01614973-1775引入到含有重组p65和ANXA2的孵育系统中它们的相互作用增强了(图4H)。
为阐明LINC01614介导的谷氨酰胺内流的机制,作者对CAF外泌体处理的A549细胞的mRNA微阵列数据进行了GSEA分析。一组核因子kappa B (NF-κB) 靶基因,IL-6、CCL5和CXCL10与CAF-exosome-treated A549细胞中LINC01614显著共表达(图4I),同样,在用CAF外泌体处理的A549细胞中观察到上调的NF-κb转录活性和增加的p65核易位,而在CAFs中敲除LINC01614未能激活NF-κb转录和p65核易位(图4J-L)。此外,LINC01614的异位表达增加了A549细胞中的NF-κb转录活性和p65核易位(图4M,O)。总之,这些结果表明CAF衍生的LINC01614增强了p65和ANXA2的相互作用并促进了NF-κb的激活。
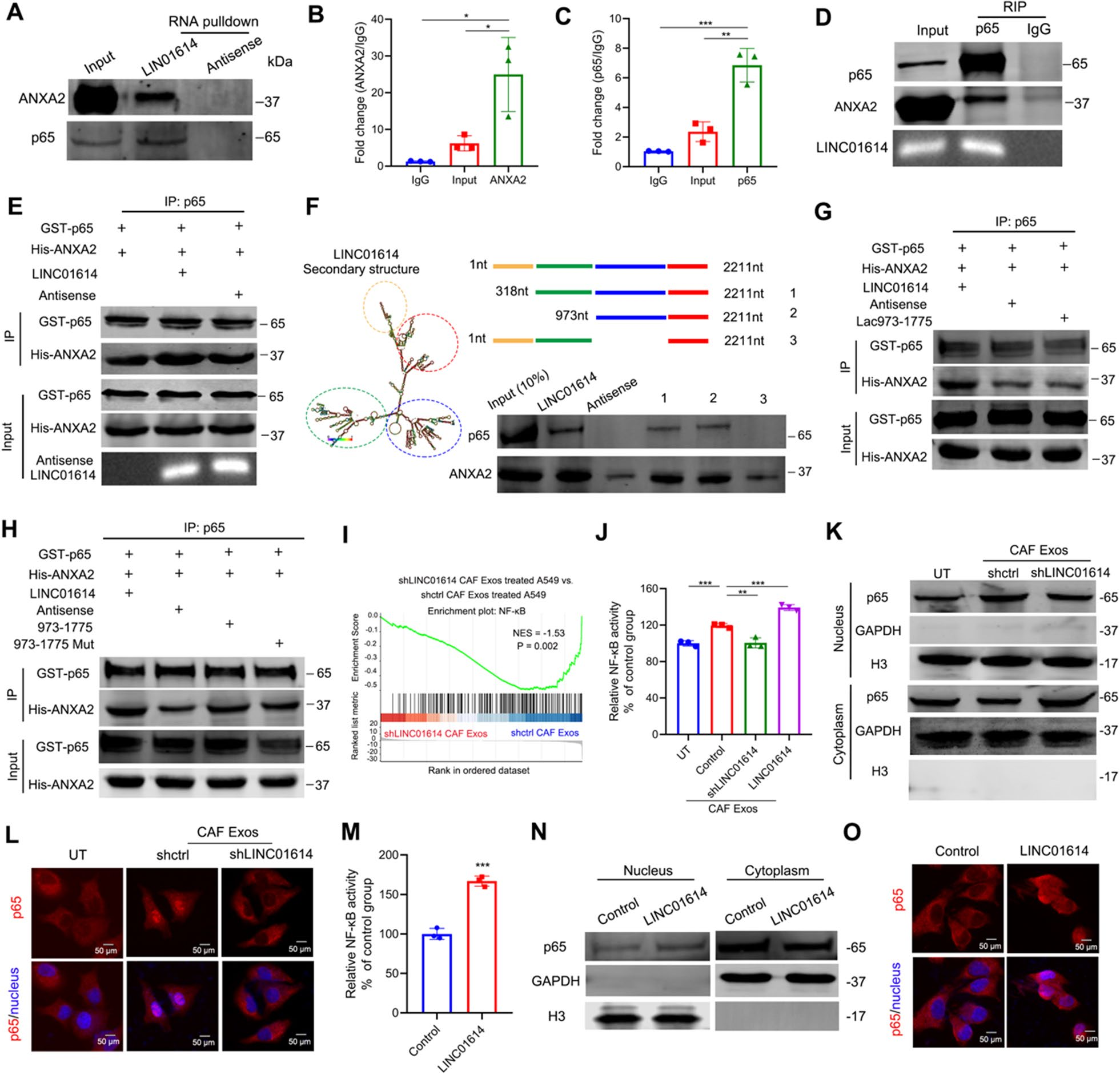
图4 LINC01614增强了ANXA2和p65的相互作用,促进NF - κB的激活
5、LINC01614促进ANXA2依赖性p65磷酸化以及SLC38A2和SLC7A5的转录
为研究LINC01614激活NF-κb途径的机制,作者评估了LINC01614对I κ Bα和IκB激酶(IKK)磷酸化的影响。然而,IKK和IκBα的磷酸化在A549细胞中不受异位LINC01614表达或CAF外泌体处理的影响(图5A,B)。一致地,抑制NF-κB核易位 (JSH-23) 或沉默p65但不抑制IKK (BAY 11-7082)可以消除LINC01614对p65核易位的影响(图5C)。从sh-LINC01614转导的CAF提取的外泌体减弱了Ser276处p65磷酸化的增强(图5D)。此外,A549细胞中的LINC01614或ANXA2过表达显著增强了Ser276处p65磷酸化(图5E)。蛋白质印迹、免疫荧光染色和荧光素酶报告基因分析所揭示,沉默ANXA2减弱了LINC01614诱导的Ser276 p65磷酸化、p65的核保留和A549细胞中的NF-κ B活化(图5F-H)。有趣的是,沉默p65降低了A549细胞中SLC38A2和SLC7A5的表达(图5I)。作者接下来评估了NF-κB激活是否促进了SCL38A2和SLC7A5的转录。JASPAR的序列分析表明,在SCL38A2和SLC7A5的启动子上,NF-κB有典型的结合序列(图5J)。重要的是,免疫沉淀(ChIP)分析和荧光素酶报告基因测定,分别确认了SLC38A2和SLC7A5启动子上的NF-κB结合位点。此外,编码的芯片测序数据证实了基因组位置SLC38A2和SLC7A5启动子上p65的峰(图5M)。这些数据表明,CAF衍生的LINC01614与p65和ANXA2相互作用,并促进Ser276处p65的ANXA2-induced磷酸化,从而导致LUAD细胞中两个谷氨酰胺转运蛋白SLC38A2和SLC7A5的转录的NF-κB活化。

图5 LINC01614促进了依赖于ANXA2的p65磷酸化和SLC38A2和SLC7A5的转录
6、CAF-衍生的LINC01614在体内促进LUAD肿瘤发生,是潜在的治疗靶标
异种移植肿瘤模型显示,肿瘤内注射CAF外泌体或共注射CAFs可促进肺癌生长(图6A,D)。来自shLINC01614转导的CAFs的外泌体抑制了异种移植物中的肿瘤生长,伴随着Ki67,SLC38A2和SLC7A5的表达降低(图6E)。此外,CAF外泌体治疗促进NCG(NODprkdc−/−IL-2Rg−/−)小鼠中LUAD细胞的肺转移,通过沉默CAFs中的LINC01614部分逆转其转移(图6F)。此外,CAFs在斑马鱼体内也表现出转移能力(图6G-J)。然而,在共注射或外泌体提取前,在CAFs中沉默LINC01614会减弱转移性癌细胞和CAFs的数量(图6G-J)。
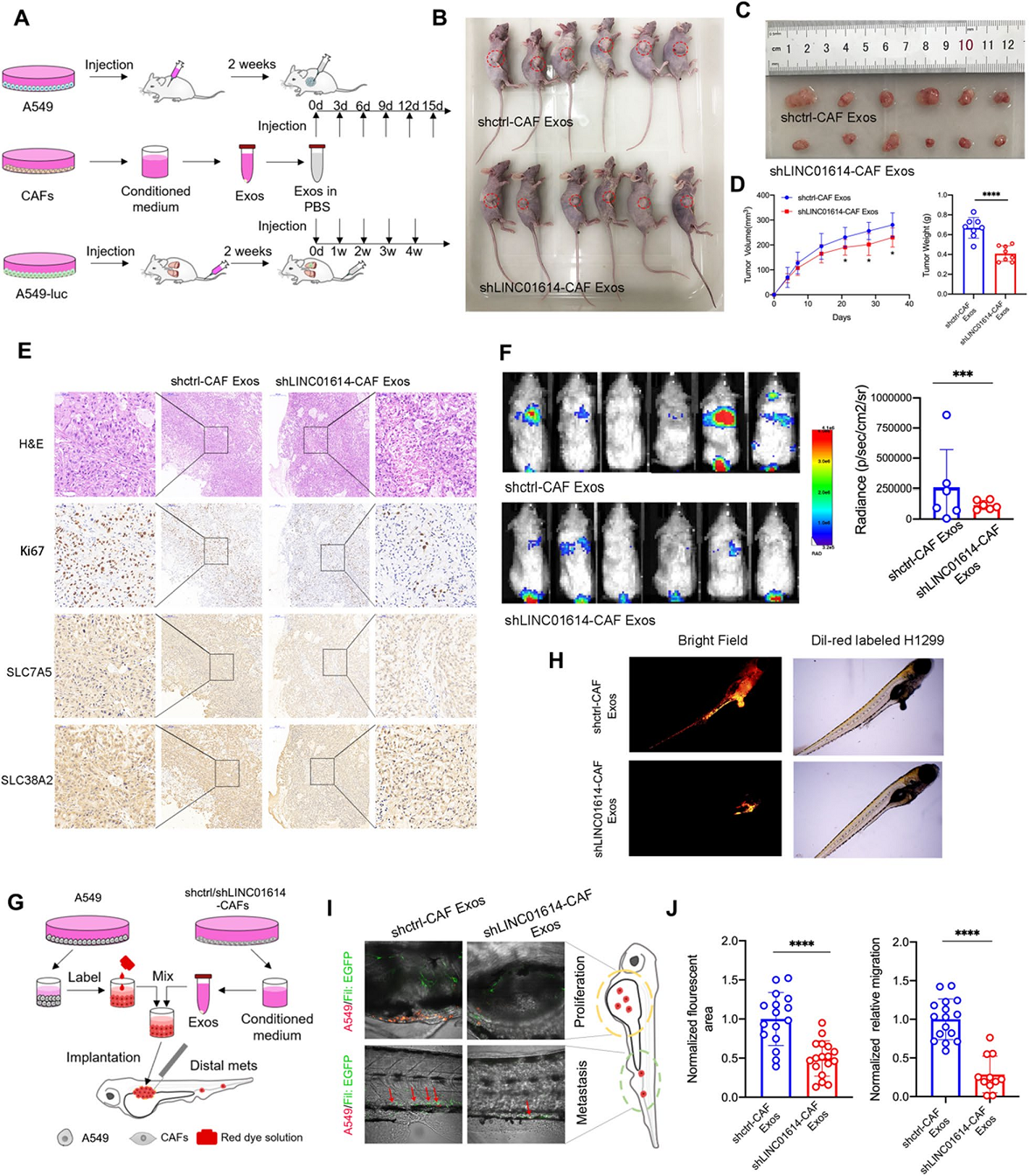
图6 CAFs在外泌体中释放LINC01614增强谷氨酰胺吸收和LUAD在体内的进展
7、LINC01614与谷氨酰胺转运蛋白和LUAD患者生存率差相关
为证实本研究发现是否与临床相关,作者在包含78对LUAD和邻近正常组织的TMA中对α-SMA进行免疫染色,分析了LINC01614表达与CAF浸润的相关性,观察到LINC01614在CAFs中大量表达。更重要的是,在78例具有丰富CAF浸润的LUAD患者中,有37例在肿瘤细胞中显示出增强的LINC01614杂交信号(图7A)。肿瘤中LINC01614的CISH评分与CAF的密度呈正相关(图7B)。LINC01614过表达与TNM队列中T stage和TNM stage相关(图7C,D)。Kaplan-Meier生存分析显示,LINC01614的高表达与LUAD患者的不良总生存期相关(图7E)。Cox比例风险模型表明LINC01614是LUAD的独立预后因素(图7F)。
此外,作者对10例LUAD患者进行SLC38A2、SLC7A5免疫染色,以α-SMA免疫染色表示CAF浸润,将LINC01614的表达与肿瘤谷氨酰胺转运蛋白相关联。LINC01614在CAFs中富集,并且肿瘤细胞的LINC01614表达与α-SMA CAFs的密度以及肿瘤中SLC38A2和SLC7A5的表达呈正相关(图7G)。此外,原代CAF中LINC01614的水平与配对的LUAD肿瘤细胞中SLC38A2和SLC7A5的mRNA水平呈正相关(图7H,I)。这些临床数据与实验发现一致,即LINC01614从CAFs传递到LUAD细胞,从而增强LUAD中谷氨酰胺的摄取。
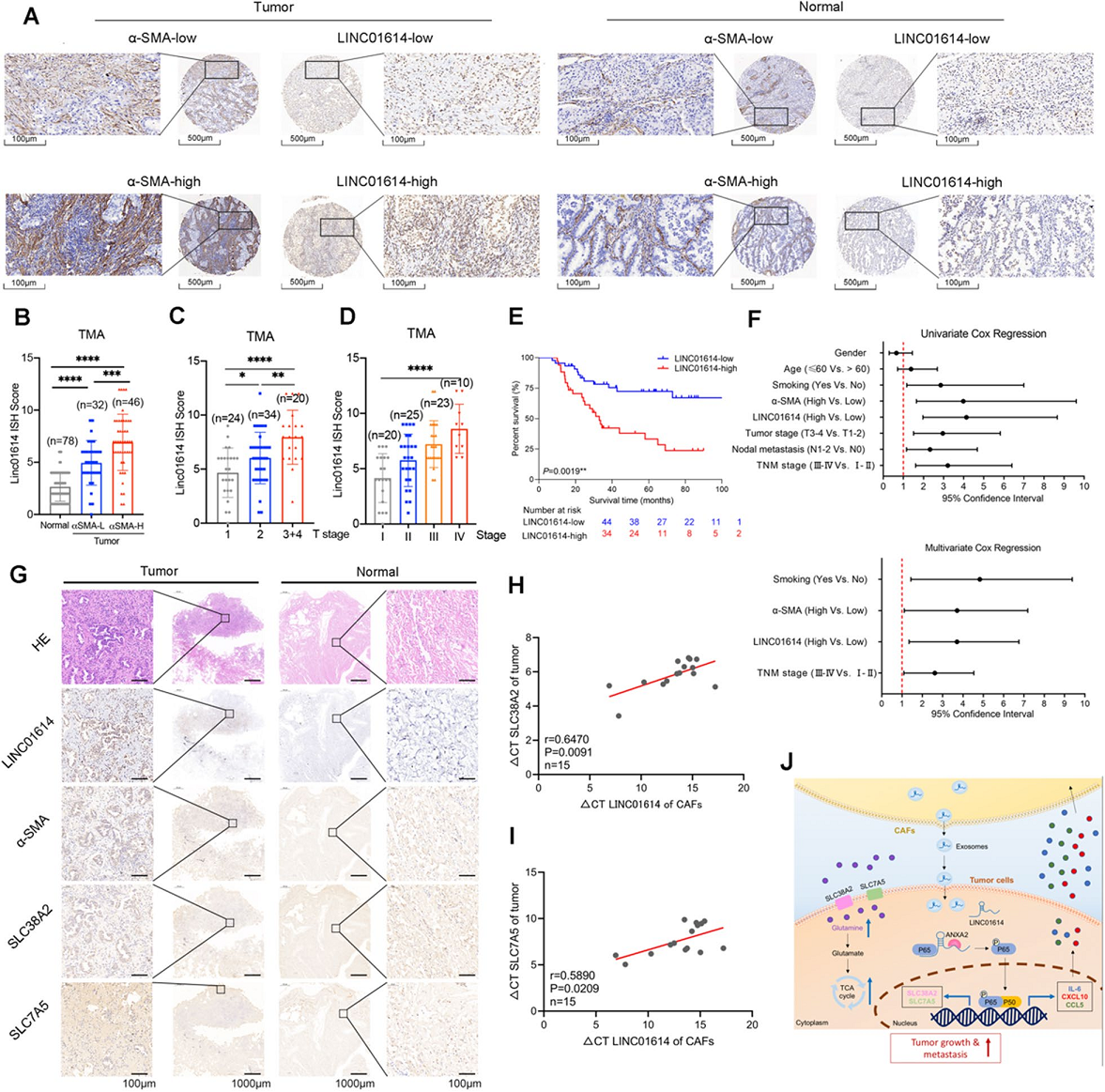
图7 LINC01614与谷氨酰胺转运蛋白和LUAD患者生存率差相关
结论
综上所述,本研究发现CAFs通过上调LUAD中的氨基酸转运蛋白而优先促进癌细胞对谷氨酰胺的成瘾。本研究证明了LINC01614通过外泌体从CAFs释放到LUAD细胞。在机制上,LINC01614直接与LUAD细胞中的ANXA2和p65相互作用,LINC01614是促进NF-κB磷酸化和活化的支架。值得注意的是,NF-κB激活不是IKK和IκB磷酸化的结果,而是依赖于p65的翻译后修饰。
参考文献
Liu T, Han C, Fang P, Ma Z, Wang X, Chen H, Wang S, Meng F, Wang C, Zhang E, Dong G, Zhu H, Yin W, Wang J, Zuo X, Qiu M, Wang J, Qian X, Shen H, Xu L, Hu Z, Yin R (2022) Cancer-associated fibroblast-specific lncRNA LINC01614 enhances glutamine uptake in lung adenocarcinoma. J Hematol Oncol. 15(1):141. doi: 10.1186/s13045-022-01359-4.






