APAF1结合长链非编码RNA通过阻断凋亡小体组装促进胃癌的肿瘤生长和多药耐药
胃癌(GC)是全球第五大最常见的恶性肿瘤和第三大癌症相关死亡原因,每年约有40% 的新病例和死亡发生在中国。化疗仍然是晚期GC治疗的基石。然而,耐药性和不可避免的严重毒性导致化疗失败。因此,迫切需要阐明更详细的分子机制并确定GC治疗的有效治疗靶点。该研究发表于《ADVANCED SCIENCE》,IF: 17.521。
技术路线:

主要研究结果:
1. ABL在GC中上调并预测GC患者的预后不良
为了分析GC中的lncRNAs表达,作者首先通过RNA测序(RNA-seq)分析了来自GC患者的四对癌性和匹配的相邻正常组织标本。代表性上调和下调的lncRNA(倍数变化>2或 <1/2,p值<0.05)显示在热图中(图1A)。有趣的是,两个名为RP3-512B11.3(ABL)和 LOC730102的lncRNA被确定为进一步研究的热门(图1B)。接下来,作者利用癌症基因组图谱(TCGA)和生物信息学工具GEPIA(http://gepia.cancer-pku.cn/)的数据分析了选定的 lncRNA表达与GC预后之间的关联,结果显示GC患者ABL 表达较高的结果较差(p=0.024),而LOC730102表达与GC预后无显著相关性(p=0.61)。因此,选择lncRNA ABL作为进一步研究的候选者。
使用5'- 和3'- cDNA末端快速扩增 (RACE) 测定法来确定ABL的整个序列,确认在BGC-823细胞中检测到的序列与存档的ABL转录本(ENST00000561592)相同UCSC数据库(http ://genome.ucsc.edu/)。随后,通过qRT-PCR测定ABL在GC组织中的表达,表明与配对的相邻正常组织相比,癌性GC组织中ABL表达显著上调(图1C)。进行了RNAscope和RNA荧光原位杂交(RNA-FISH)测定,证实了与GC组织中配对的正常胃粘膜细胞相比,GC细胞中ABL的显著丰度(图1D, E)。为了进一步研究ABL在GC中表达的临床相关性,作者使用队列1的组织微阵列进行了RNA-FISH测定,结果表明ABL在癌性GC组织中的表达远高于匹配的正常胃组织(n=81,p=0.024;图1F, G)。此外,Kaplan-Meier分析表明,ABL表达较高的GC患者总生存期降低(n=81,p=0.02968,对数秩检验;图1H)。多变量Cox回归分析表明ABL表达是GC患者预后的独立预测标志物(图1M)。为了进一步评估ABL表达的预测价值,作者进行了时间相关的受试者工作特征曲线分析。在队列1中,临床风险评分(TNM分期)和ABL风险评分的组合比单独的评分更准确(图1I)。例如,临床风险评分在第5年的曲线下面积(AUC)为0.712,而临床风险评分和ABL风险评分的组合显著增加至0.889。此外,队列1中的这些结果也得到了具有更多GC患者的独立队列(队列2,n=192)的支持,这表明ABL表达在预后不良的GC患者中显著增加(图1J,K)。此外,单变量/多变量Cox回归分析还显示,T、N和M类别以及ABL表达与GC患者的生存率显著相关(图1N)。AUC还表明,在队列2中,TNM分期和ABL风险评分的组合比单独的评分更准确(图1L)。总之,这些数据表明ABL表达在GC中显著增加,并且ABL可能是GC患者的独立预后因素。
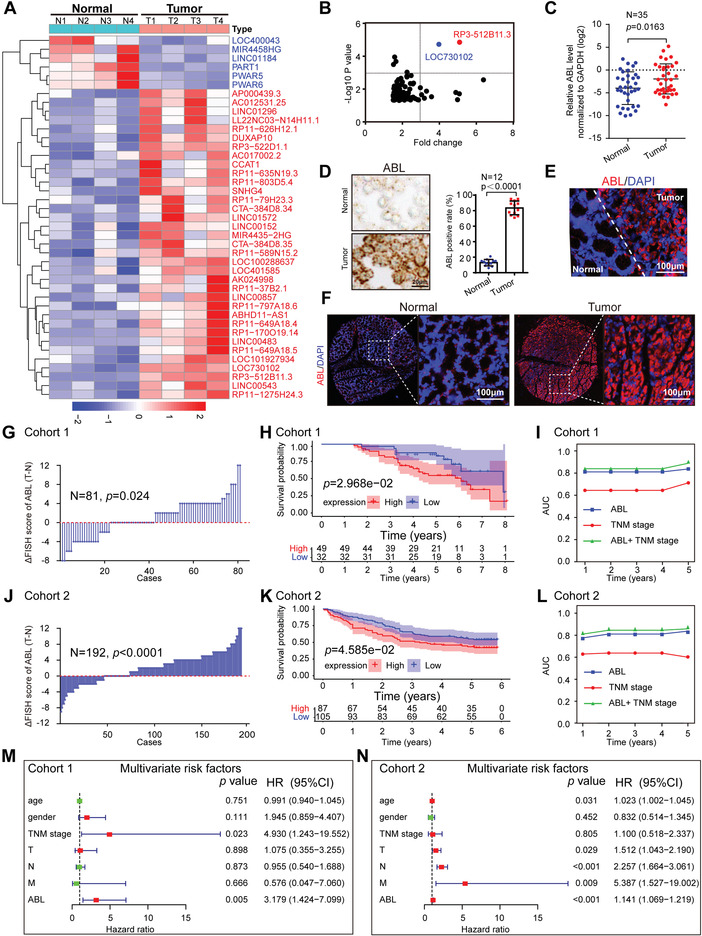
图1 ABL表达升高与GC患者的不良预后相关
2. ABL通过其WD1/WD2域直接绑定到APAF1
为了阐明ABL在GC中的功能作用,作者首先检查了它的亚细胞定位。RNA-FISH分析显示ABL主要位于细胞质中(图2A)。为了鉴定ABL的蛋白质伙伴,体外转录的生物素化ABL有义和反义转录物经过lncRNA pull-down和质谱(MS)分析。值得注意的是,有义ABL转录本与APAF1特异性相关(图2B)。然后,用细胞裂解物和RNA免疫沉淀(RIP)分析进行的RNA pull-down分析进一步证实了ABL与APAF1的特定关联(图2C, D)。此外,RNA-FISH结合免疫荧光(IF)显示ABL和APAF1的细胞质共定位模式(图2E)。为了确定负责APAF1结合的ABL序列基序,作者进行了体外RNA下拉,然后进行了如前所述的斑点印迹分析。由APAF1结合的ABL的基序序列被鉴定为包含nt 481-540(图2F)。此外,使用重组APAF1进行的体外RNA蛋白结合试验也证实ABL可以直接与APAF1相互作用,但ABL中相应序列(nt 481-540)的缺失完全消除了其与APAF1的相互作用(图2G)。此外,蛋白质结构域作图分析表明,ABL与APAF1 C末端氨基酸(aa) 613-1248的区域结合,包含15个WD40重复,构成两个β-螺旋桨,分别称为WD1 (aa 613-910)和WD2 (aa 922–1248) (图2H,I)。WD40结构域是一个非经典的 RNA 结合基序,这与作者发现APAF1的 WD1/WD2 结构域作为ABL的RNA结合结构域是一致的。有趣的是,RNA-蛋白质对接分析还显示,使用PDB2PQR服务器,ABL的nt 481-540区域与APAF1的WD1/WD2结构域完美相互作用(图2J)。基于这些结果,作者推测APAF1可能是一种RNA结合蛋白(RBP),作者接下来进行了互补DNA末端的线性扩增和测序(LACE-seq)以证实这一假设。LACE-seq 鉴定的APAF1结合位点映射到2493个转录本(4662个结合峰),分布在编码序列(CDS)、基因间区、内含子区、非编码RNA(ncRNA)、3' 非翻译区(UTR), 和5' UTR (图2K)。此外,作者发现APAF1在转录起始位点 (TSS) 周围显示出丰富的结合(图2L)。同时,通过Multiple Em for Motif Elimination tool (MEME)分析APAF1结合基序(图2M),并且“AACCUU_AG”共义序列可以映射到ABL转录本的481-540 nt中,与APAF1的 WD1/WD2 结构域相互作用。然后RIP-qPCR测定证实APAF1可以与LACE-seq中鉴定的mRNA或lncRNA显著相互作用。其中,ABL比其他RNA更丰富(图2N)。总的来说,这些结果表明ABL可以作为潜在的RBP直接与APAF1相互作用。
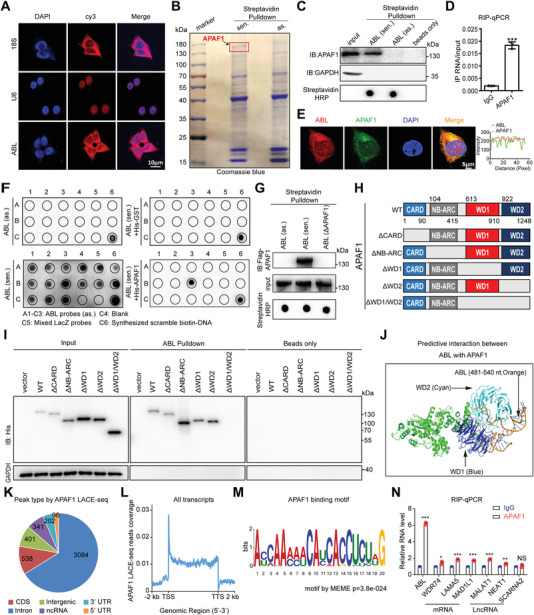
图2 ABL直接与APAF1结合
3. ABL促进GC细胞存活并抑制多种药物诱导的细胞凋亡
APAF1对内在途径介导的细胞死亡至关重要,细胞死亡是由发育谱系信息、癌基因激活、DNA损伤和营养缺乏诱导的,并与化学抗性有关。因此,作者推测ABL通过与APAF1 结合来调节这一过程。首先,作者生成了稳定的ABL敲低和ABL过表达的GC细胞(图3A)。此外,ABL的敲低明显抑制了超低附着培养板中GC细胞的生长,而ABL的上调则促进了细胞生长(图3B,C)。然后,集落形成试验表明,与相应的对照细胞的集落数相比,ABL缺陷细胞的集落数显著减少,但ABL过表达细胞的集落数增加(图3D-G)。此外,当细胞用指定剂量的顺铂 (DDP) 处理时,ABL缺陷细胞的集落数比对照细胞的集落数显著减少(图3D, E)。相反,与顺铂处理后的对照细胞相比,ABL过表达细胞的集落数显著增加(图3F, G)。作者进一步评估了ABL与5-Fu和PTX治疗的这种效果。结果还支持以下结论:ABL的敲低加速了5-Fu和PTX诱导的细胞凋亡,而ABL的过表达促进了有或没有5-Fu或PTX处理的细胞存活(图3H-K)。总之,这些数据表明ABL促进GC细胞存活并可能参与多药耐药性。
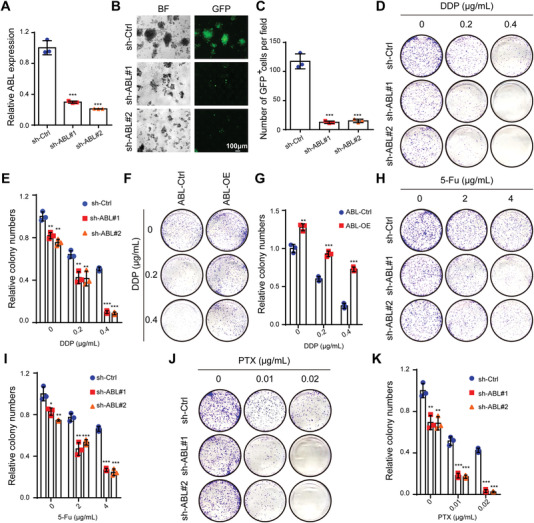
图3 ABL的敲低促进GC细胞凋亡和体外对多种药物的敏感性
4. ABL通过竞争性阻断Cyt c与APAF1的相互作用来拮抗GC细胞凋亡
为了进一步表征ABL调节细胞凋亡和化学抗性的机制,作者首先检测了参与内在凋亡途径的关键分子的蛋白质水平。ABL的上调降低了顺铂诱导的cleaved caspase-9/3的表达,但ABL的敲低增加了这种表达(图4A)。然而,APAF1和Cyt c的蛋白水平没有受到明显影响(图4A)。考虑到Cyt c夹在APAF1的WD1和WD2的两个正面之间,这也是ABL结合域,作者询问ABL与APAF1的结合是否竞争性地阻止了Cyt c与APAF1的相互作用。事实上,在用顺铂处理过的ABL过表达GC细胞中,APAF1与Cyt c结合的能力被显著抑制(图4B)。此外,作者发现与对照细胞相比,用顺铂处理的ABL过表达细胞中APAF1和Cyt c的共定位减少了(图4C)。此外,ABL 的过表达显著抑制顺铂诱导的caspase-9活化(图4D)。有趣的是,ABL-APAF1结构对接分析还表明,ABL中包括nt 481-540的区域,尤其是482 GAACC 486基序,与APAF1的WD2结构域中的Leu1089/Gly1178和WD1结构域中的Trp884非常接近(图4E),它们也是通过冷冻电子显微镜确定的APAF1-Cyt c相互作用的特定残基。接下来,为了进一步确定ABL是否可以阻断Cyt c与APAF1的结合,体外转录的ABL有义、反义和突变有义(ΔAPAF1,APAF1 结合位点的缺失,nt 481-540)转录物是与纯化的APAF1-WD1/WD2结构域和Cyt c蛋白一起孵育,结果表明,在存在ABL正义的情况下,与APAF1的WD1/WD2结构域结合的Cyt c的量急剧下降,但没有ABL反义或突变正义(ΔAPAF1) (图4F)。总之,这些数据表明ABL竞争性地抑制Cyt c与APAF1的相互作用,从而削弱caspase-9的激活。
随后,作者检查了ABL是否以依赖于nt 481-540核心区域的方式拮抗GC凋亡。构建了表达野生型ABL(WT)或突变型ABL(缺失nt481-540, Mut)的质粒。Annexin-V-FITC/PI染色分析结果表明,与对照表达相比,过表达ABL-WT而不是ABL-Mut可减少顺铂诱导的细胞凋亡(图4G, H)。检测凋亡细胞的TUNEL试验也证实了该结果(图4I, J)。

图4 ABL通过竞争性阻断APAF1与Cyt c的结合来拮抗GC细胞凋亡
为了进一步研究ABL在药物诱导的细胞凋亡中的作用,作者还建立了GC类器官模型。当用顺铂或PTX处理类器官时,与相应的对照类器官相比,ABL上调的类器官显示出顺铂/PTX诱导的细胞凋亡显著减少(图5A)。Cleaved caspase-3染色还表明,与对照组相比,ABL过表达组的凋亡细胞数量显著减少(图5B)。然后,作者进行了肿瘤异种移植研究,以验证ABL在体内GC生长和顺铂敏感性中的作用。结果表明,过表达ABL可以促进肿瘤生长,过表达组与对照组相比,肿瘤的大小和重量证明了这一点(图5C-E)。此外,ABL的过表达显著拮抗顺铂的抗肿瘤作用(图5C-E)。与对照组相比,ABL过表达组的ABL表达显著增加(图5F)。此外,免疫组织化学(IHC)结果显示,与接受或不接受顺铂治疗的对照组相比,ABL过表达组的肿瘤组织中Ki-67(一种增殖标志物)的表达增加(图5G)。最后,cleaved caspase-3染色和TUNEL测定显示,与顺铂处理后的对照组相比,ABL过表达组的凋亡细胞数量显著减少(图5G)。这些结果表明ABL通过竞争性阻断Cyt c与APAF1的结合来拮抗药物诱导的细胞凋亡。

图5 ABL在体内促进GC细胞生长和多药耐药性
5. IGF2BP1结合并识别ABL上METTL3介导的m6A修饰,保持ABL稳定性
为了探索ABL在GC中高表达的机制,作者首先使用UCSC基因组浏览器(http://genome.ucsc.edu/) 分析了ABL启动子区域的表观遗传修饰。在ABL的启动子区域发现了高度富集的H3K27乙酰化(H3K27ac)信号,表明ABL表达可能被染色质乙酰化激活。已知H3K27ac被P300/CBP复合物催化。然而,使用两种特异性siRNA敲除P300并不能调节ABL的水平。因此,作者推测其他机制调节ABL的表达。
m6A甲基化已被确定为在mRNA和非编码RNA中普遍存在的最丰富的修饰,可影响RNA的稳定性、剪接、定位和翻译。最近的研究报告说,IGF2BPs,包括 IGF2BP1/2/3,是一个独特的m6A阅读器家族,其靶向数千个RNA以增强RNA稳定性。作者之前的研究还表明,IGF2BP3依赖性m6A修饰可维持HDGF mRNA的稳定性。作者首先使用两个特异性siRNA敲低IGF2BP1和IGF2BP3。只有敲低 IGF2BP1显著抑制ABL表达,而敲低IGF2BP3 没有明显效果(图6A)。此外,RNA pull-down和RIP检测证实了ABL与IGF2BP1的相互作用(图6B, C)。IF测定还表明,细胞质ABL与IGF2BP1共定位(图6D)。此外,蛋白质结构域作图分析显示ABL特异性结合IGF2BP1的KH1/2结构域(图6E, F)。作者还发现由 IGF2BP1结合/保护的ABL基序序列被鉴定为包含 nt 121-180(图6G)。ABL中该序列(nt 121-180)的缺失完全消除了其与重组IGF2BP1的直接相互作用,而ABL中APAF1结合序列(nt 481-540)的缺失不影响这种结合(图6H)。先前的一项研究表明,IGF2BP1/3优先与富含CA的序列相互作用,并且IGF2BPs也可以识别关键的m6A基序GGAC。令人惊讶的是,作者发现ABL的核心序列(nt 121-180)含有“122 GGACCACA 129”基序,暗示IGF2BP1可能直接与“CACA”基序结合,进而识别m6A基序“GGAC”ABL(图6I)。为了进一步验证ABL的121-180 nt区域中的“GGAC”基序被m6A修饰,作者将腺苷(A)替换为胞嘧啶(C),并插入了带有野生型的ABL的部分121-180 nt序列或将m6A位点突变为荧光素酶报告质粒(图6J),这表明IGF2BP1在ABL-WT组中引起相对荧光素酶活性的上调,但在ABL-Mut组中没有(图6K)。此外,RNA-蛋白质对接分析还表明,ABL的“GGACCACA”序列在与IGF2BP1的KH1/2结构域中的几个残基结合中起重要作用(图6L)。
为进一步探索m6A对ABL调控的影响,作者构建了表达野生型METTL3或其催化突变体(aa395-398,DPPW→APPA)的质粒。结果表明,在METTL3过表达细胞中ABL的表达增加,而催化突变体METTL3过表达不能促进ABL表达(图6M)。同时,METTL3的敲低降低了ABL的水平(图6N)。MeRIP-qPCR数据还显示,m6A特异性抗体在广泛型METTL3过表达后显著富集ABL;然而,与对照细胞相比,它在催化突变METTL3过表达细胞中没有明显效果(图6O)。有趣的是,作者通过RIP-qPCR分析发现IGF2BP1可以在METTL3过表达时富集更多的ABL(图6P),表明ABL上的m6A修饰促进了其与IGF2BP1的结合。随后,作者探讨了IGF2BP1对ABL稳定性的影响。GC细胞用放线菌素D(一种转录抑制剂)处理指定的时间。ABL水平在METTL3过表达时显示出高度稳定,而在IGF2BP1敲低时观察到相反的效果(图6Q,R)。
为了进一步表征IGF2BP1-ABL轴在GC细胞存活和耐药性中的致癌功能,进行了集落形成测定。METTL3的过表达显著促进了GC细胞存活并抵消了顺铂诱导的细胞凋亡,但使用特异性siRNA敲低METTL3过表达的GC细胞中的ABL显著抑制了这些作用(图6S, T)。此外,在顺铂处理后,IGF2BP1或METTL3的敲低增加了切割的caspase-3表达和APAF1与Cyt c结合的能力(图6U)。因此,作者的数据表明IGF2BP1结合并识别METTL3介导的ABL上的m6A修饰,并稳定ABL转录物,这可能导致多药耐药性。
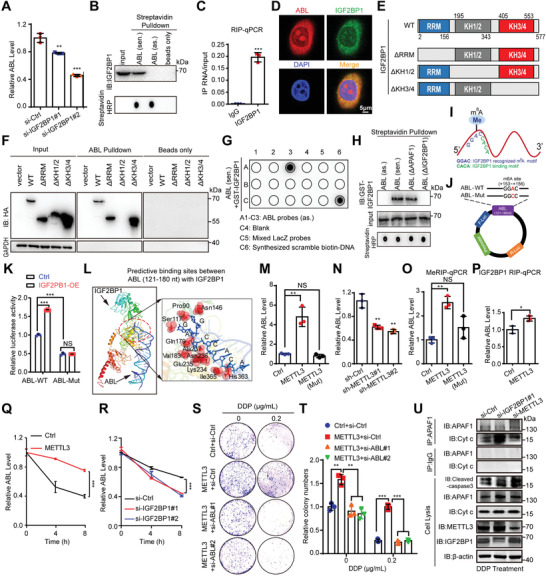
图6 IGF2BP1结合并识别METTL3介导的m6A对ABL的修改,保持ABL的稳定性
6. 脂质体介导的ABL特异性siRNA和PTX的协同递送协同诱导体内GC细胞凋亡
为了研究ABL作为GC治疗靶点的潜在价值,作者开发了载有ABL特异性siRNA的聚(乙二醇)修饰的阳离子脂质体(PEG-CLs)。阴离子ABL特异性siRNA (si-ABL) 首先由阳离子鱼精蛋白缩合,形成的siRNA/鱼精蛋白复合物进一步包裹在负载PTX的阳离子脂质体中(图7A)。siRNA/鱼精蛋白复合物的N:P比为4:1,总脂质量为100 nmol µg -1 (脂质/siRNA)。优化的si-ABL和PTX共载PEG-CLs (si-ABL+PTX/PEG-CLs),PEG与总脂质的摩尔比为 5%,平均直径为73.12±1.92 nm,zeta电位为0.172±0.609 mV(图7B)。
此外,作者使用异种移植小鼠模型评估了si-ABL+PTX/PEG-CLs的体内抗肿瘤功效。在指定时间通过尾静脉将不同的脂质体制剂注射到模型小鼠中(图7C)。结果表明,与PBS 或si-Ctrl/ PEG-CLs(图7D-F)。在所有组中,si-ABL+PTX/PEG-CL组显示出最高的抗肿瘤能力(图7D-F)。此外,通过RNA-FISH分析证实,在si-ABL/PEG-CL和si-ABL+PTX/PEG-CL 组中ABL的表达显著降低(图7G)。作者还发现,在单独使用si-ABL/PEG-CLs、PTX/PEG-CLs 或 si-Ctrl+PTX/PEG-CLs处理的小鼠中,凋亡细胞数量显著增加,而Ki-67阳性细胞数量减少,并且这种效果在si-ABL+PTX/PEG-CL 组中比在PBS或si-Ctrl/PEG-CL 组中更明显(图7G),表明si-ABL和PTX的协同抗肿瘤能力。
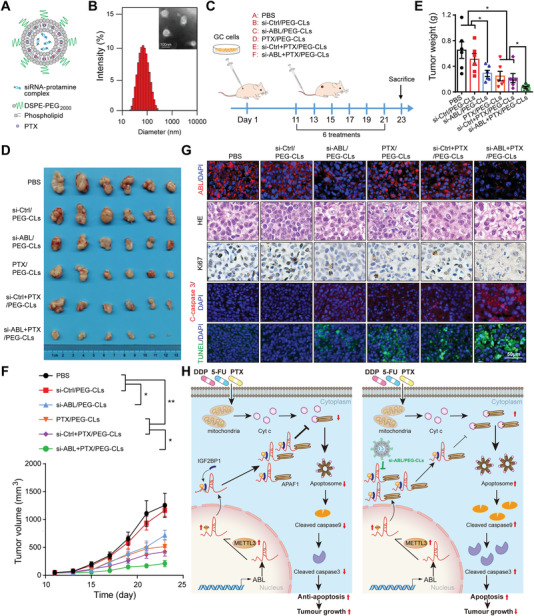
图7 纳米封装的ABL特异性siRNA和PTX在体内协同诱导GC细胞凋亡
结论:
该研究结果揭示了lncRNA ABL在GC中的抗凋亡作用,这与GC细胞存活和化疗药物耐药性相关,导致GC患者预后不良。此外,使用纳米封装的siRNA结合化疗药物靶向ABL可能代表了一种新的GC治疗策略。因此,ABL可能是GC的潜在预测因子和治疗靶点。
参考文献:
Wang Q, Chen C, Xu X, Shu C, Cao C, Wang Z, et al. APAF1-Binding Long Noncoding RNA Promotes Tumor Growth and Multidrug Resistance in Gastric Cancer by Blocking Apoptosome Assembly. Adv Sci (Weinh). 2022 Oct;9(28):e2201889. doi: 10.1002/advs.202201889.






