表征与唾液酸化相关的长非编码RNA,以开发一种新的信号来预测结直肠癌的预后、免疫状况和化疗反应
结直肠癌(CRC)是2020年全球第三大最常见和第二致命的肿瘤。转移性结直肠癌患者的5年生存率仅为14%,这凸显了早期和精确识别不同风险人群的患者以进行适当和个性化治疗的必要性。正常的分期过程遵循美国癌症联合委员会(AJCC)的标准,这是基于肿瘤大小(T),淋巴结受累(N)和转移(M)的TNM分期系统。CRC的共识分子亚型(CMS)也被提出作为基于基因表达的亚型。尽管这两种分期策略在CRC治疗选择中很有价值,但同一亚型的患者仍可能表现出广泛的临床结局差异;因此,需要更精细的分类方法来提供更个性化的治疗策略。此外,癌细胞对化疗和靶向药物的耐药性仍然很常见,并严重阻碍了癌症的管理。预测每位患者药物敏感性的工具有助于指导治疗决策。最近,免疫学方法之一的程序性细胞死亡蛋白1(PD-1)抗体治疗已被证明仅在治疗微卫星不稳定性高肿瘤方面成功,这使得85%的CRC患者无法从免疫疗法中受益。新版本的免疫检查点抑制剂有望扩大免疫疗法的疗效。因此,迫切需要发现新的生物标志物或治疗靶点来预测结直肠癌的预后、治疗反应和发展。该研究发表于《FRONTIERS IN IMMUNOLOGY》,IF: 8.786。
技术路线:

主要研究结果:
1. 识别预后唾液酸化相关的lncRNA特征
探索唾液酸化相关lncRNA在结直肠癌中的预后价值的过程显示在图1。首先,将543名临床信息完整的患者随机分为训练组和验证组。作者从MsigDB网站上下载了120个参与唾液酸和Siglec相互作用的mRNA,并带有lncRNA注释。正如皮尔逊相关性所揭示的那样,共有1268个lncRNA与mRNA强相关,阈值为|r|训练组中>0.3和P<0.001。作者接下来专注于这些与唾液酸化相关的lncRNA;单因素Cox回归分析显示9个lncRNA与患者OS显著相关(P<0.01,图2A)。ZEB1反义RNA 1(ZEB1-AS1),LOC100506691,编号:AC092687.3和编号:AC010973.2风险比(HR)超过1,这表明它们是危险因素。其余5个lncRNA,LOC100507403,LINC00261,ITGB8反义RNA 1(ITGB8-AS1),ENTPD1反义RNA 1(ENTPD1-AS1)和B4GALT1反义RNA 1(B4GALT1-AS1)是HR的保护因子<1。
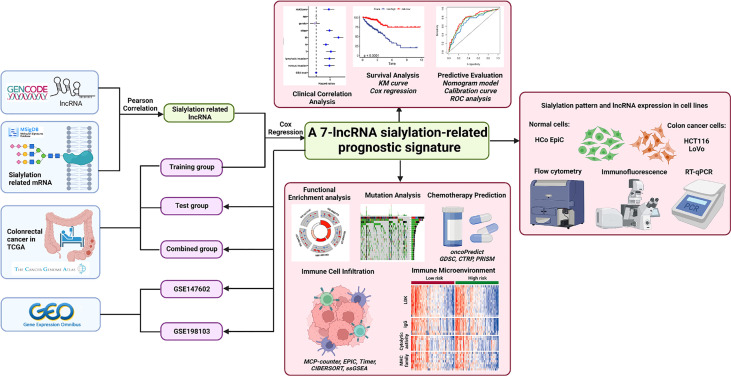
图1 本研究的流程图
其次,通过多元Cox回归和逐步算法构建了基于7种唾液酸化相关lncRNA的签名。基因如下:ZEB1-AS1,编号:AC092687.3、LOC100506691、LOC100507403、ENTPD1-AS1、LINC00261和ITGB8-AS1。每个lncRNA的系数(图2B)与单变量Cox回归中的HR值具有相同的趋势。具体来说,ZEB1-AS1,编号:AC092687.3,LOC100506691显示正系数导致较高的风险评分,而LOC100507403、ENTPD1-AS1、LINC00261和ITGB8-AS1具有负系数,因为它们是保护因素。
5种lncRNA在肿瘤组织中的表达水平均显著较高,但LINC00261(无差异)和LOC100507403(在正常组织中显著升高)除外(图2C)。在组合组中,7种唾液酸化相关的lncRNA在高风险组和低风险组之间表达显著差异,由中位风险评分(图2D)。此外,通过Spearman检验计算了风险评分与七种唾液酸化相关lncRNA的关系;LINC00261呈最高负相关(r = −0.567,图2E)。
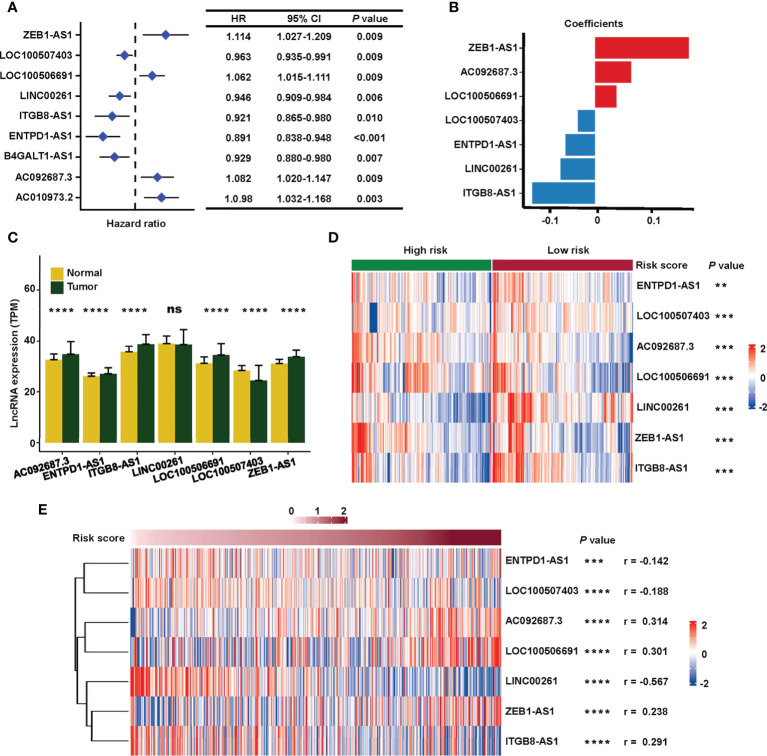
图2 构建与唾液酸化相关的lncRNA特征
2. 基于七种唾液酸化相关lncRNA验证特征,用于生存预测和作为独立预后因素
根据每组计算的风险评分的中位数将患者分为高风险或低风险类型。训练、测试和组合集的风险评分和生存状态显示在图3A(上)。在高危组中观察到较高的死亡率,表明训练组(图3A(左),P<0.001)和测试集(图3A(中),P= 0.036)。高危患者的OS明显更差(图3A(右),P<0.001),DSS (图3B,P< 0.001)和PFS(图3C,P< 0.001)在TCGA组合集合中。
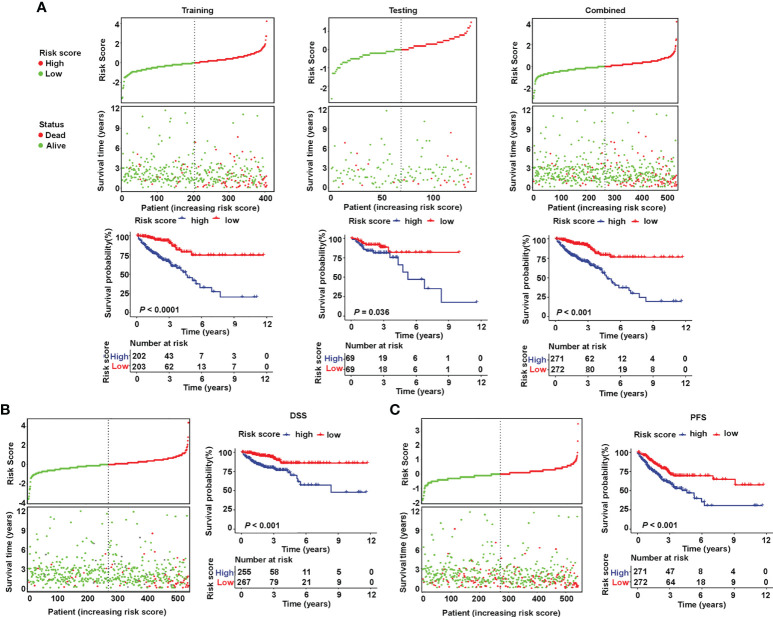
图3 验证TCGA中唾液酸化相关lncRNA标记的预后价值
为了检查临床病理特征与风险评分之间的关系,χ2在组合集合上使用检验和Cox回归。高危组和低危组OS、静脉浸润、临床分期、转移分期、淋巴结分期、CMS差异,χ2测试 (图4A)。此外,基于7种唾液酸化相关lncRNA的签名分层的风险组与M、N和T阶段以及癌胚抗原水平显著无关,OS的多元Cox回归结果证实了这一发现(HR = 4.343,95%CI = 2.223–8.482,P< 0.001,图4B), PFS(HR = 1.695,95% CI = 1.095–2.623,P= 0.018,图4C)和DSS(HR = 3.243,95%CI = 1.525–6.896,P= 0.002,图4D)。这些结果表明,作者的唾液酸化相关的结直肠癌lncRNA标记对于预测生存结果是可靠的,可以作为独立的预后因素。

图4 验证风险评分与临床病理特征之间的关系
3. 结合临床特征的列线图的构建和验证
由于风险评分独立于其他临床特征,作者试图优化特征以提高临床效率。基于OS的多变量Cox回归分析,作者整合了年龄,M分期和风险评分,以生成预测1年,3年,5年和7年后生存概率的列线图(图5A)。评估列线图预测准确性的ROC曲线显示,列线图在1年(AUC = 0.769)、3年(AUC = 0.771)、5年(AUC = 0.781)和7年(AUC = 0.808)(图5B)。此外,绘制校准曲线以检查实际测量结果和预测预后值的一致性。结果表明,列线图的预测结果与观测结果高度一致(图5C)。这些数据表明,作者成功地建立了一个列线图,该列线图结合了与唾液酸化相关的lncRNA特征和临床特征,以实现更准确的预测。
图5 列线图的构建和评估
4. 唾液酸化相关lncRNA标记的潜在机制分析
为了探索风险特征对患者预后进行分层的潜在机制,作者进行了突变、KEGG通路、GSEA和GO分析。由于体细胞突变是恶性肿瘤的主要原因,作者使用“maftool”包可视化了TCGA中突变谱的景观,其中前20个最常见的突变分别显示在高风险组和低风险组中(图6A)。Fisher试验显示,除突变基因TP53(图6B)。此外,两组体细胞突变和新抗原数量差异无统计学意义(图6C)。这些结果表明,基于唾液酸化lncRNA的标记的预后意义可能与体细胞突变无关。
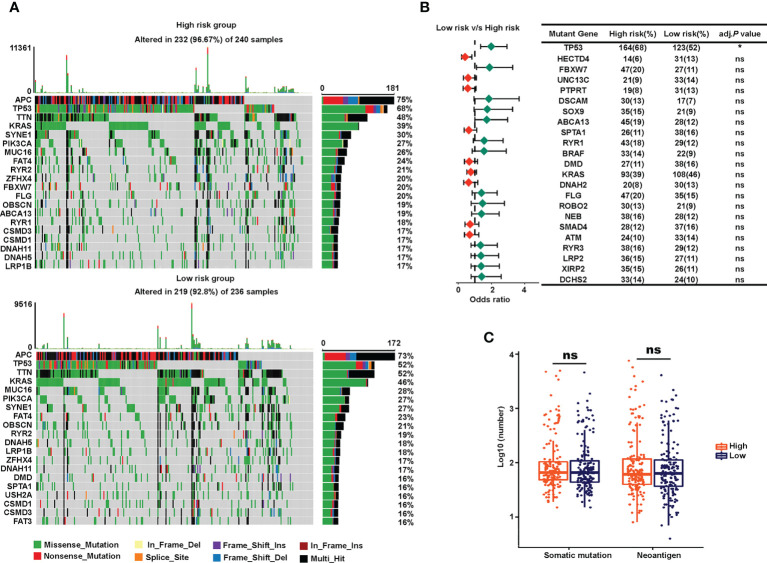
图6 高危和低危组的体细胞突变
接下来,作者进行了通路分析和GSEA,以研究与唾液酸化相关的lncRNA特征的潜在生物学重要性。共有603个DEG被识别为|log。2(FC)|> 0.5和调整后的P<0.05 使用R包“edgeR”(图7A)。GSEA显示,与细胞外基质(ECM)相关的通路,如基底细胞癌、ECM-受体相互作用、局灶粘附和刺猬信号通路,在高危组中富集,风险评分较低的患者具有丰富的细胞因子-细胞因子受体相互作用、氧化磷酸化、过氧化物酶体和核糖体(图7B)。此外,GSEA显示,低风险组(图7C)。在风险预测较高的患者中,富含胶原蛋白和轴突的途径,例如轴突发育,细胞外基质结构成分,胶原原纤维组织和轴索生成的调节。作者还对603个DEGs进行了GO分析,并确认免疫过程参与了CRC患者的唾液酸化特征相关划分(图 7D)。通路分析表明,免疫学和细胞外组成可能解释了作者签名的辨别力。
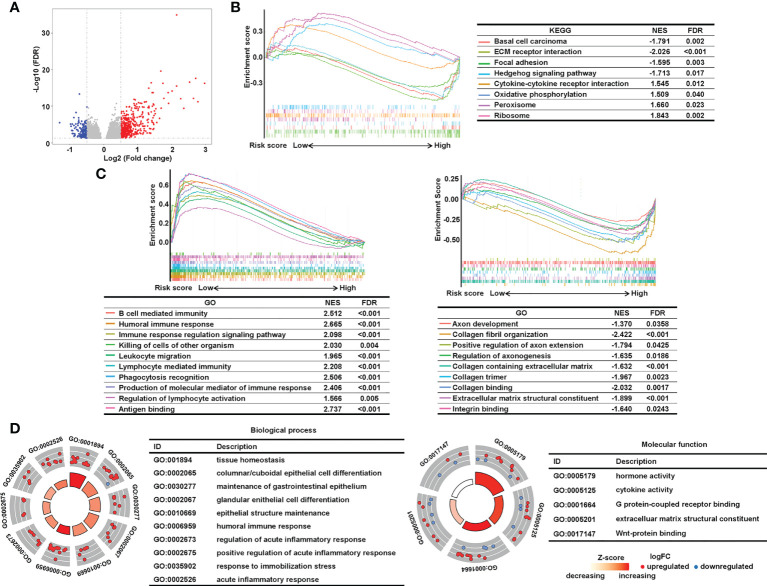
图7 分析唾液酸化相关lncRNA特征的潜在生物学途径
5. 唾液酸化相关特征评分的免疫微环境
为了进一步研究免疫过程是否与风险评分密切相关,作者挖掘了TCGA转录组学数据,通过在TIMER中使用反卷积算法来探索两个风险组之间肿瘤免疫浸润的差异。MCP-counter(图8A)和EPIC(图8B)均表明,癌症相关成纤维细胞(称为肿瘤间充质的关键成分)在高风险患者中显著更高。抗肿瘤免疫细胞,如EPIC(图8B)和TIMER(图8C),以及CD8+ T细胞和CIBERSORT鉴定的幼稚B细胞(图8D)在低风险组中的比例较高。为了进一步验证这些发现,作者使用GSVA计算免疫浸润(图8E)。有趣的是,与高风险组相比,低风险组的免疫细胞比例更高,无论它们是抗肿瘤、中细胞还是促肿瘤免疫细胞,如GSVA热图所示。
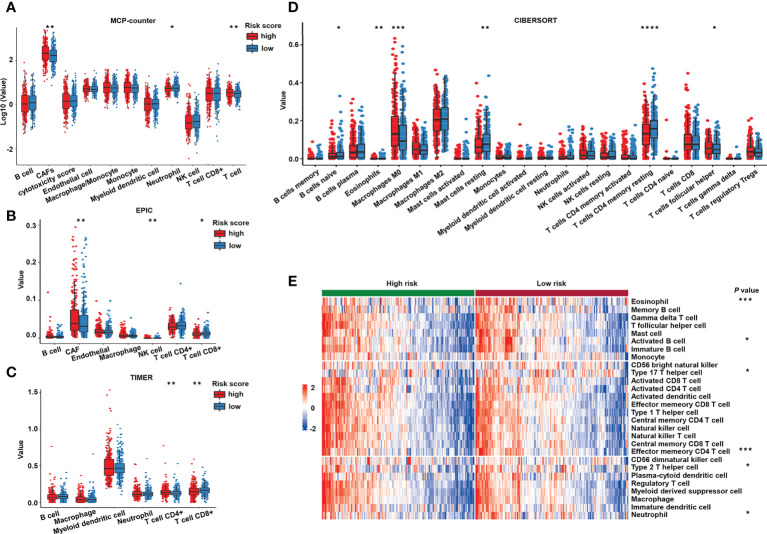
图8 不同风险人群的免疫细胞浸润
此外,为了研究免疫系统亚基因,作者检查了参与炎症活动和免疫分子的关键基因。检查所选基因与唾液酸化相关lncRNA之间的相关性(图9A)。Serpin家族B成员1(SERPINB1)和组织蛋白酶S(CTSS)与7个lncRNA中的4个显著相关,即ITGB8-AS1,LINC00261,ZEB1-AS1和LOC100506691。特定基因和家族,包括淋巴细胞特异性蛋白酪氨酸激酶(LCK)途径;免疫球蛋白G(IgG)、MHC 家族和溶细胞活性基因,例如白细胞介素7受体(IL7R)、CD48、免疫球蛋白重常数γ1(IGHG1)、CTSE和CD209(图9B);和免疫刺激剂,如CD28、IL6R 和TNFSF13 (图9C),在高风险样品中的表达率显著降低。这些数据表明,不同风险组的免疫原性各不相同。
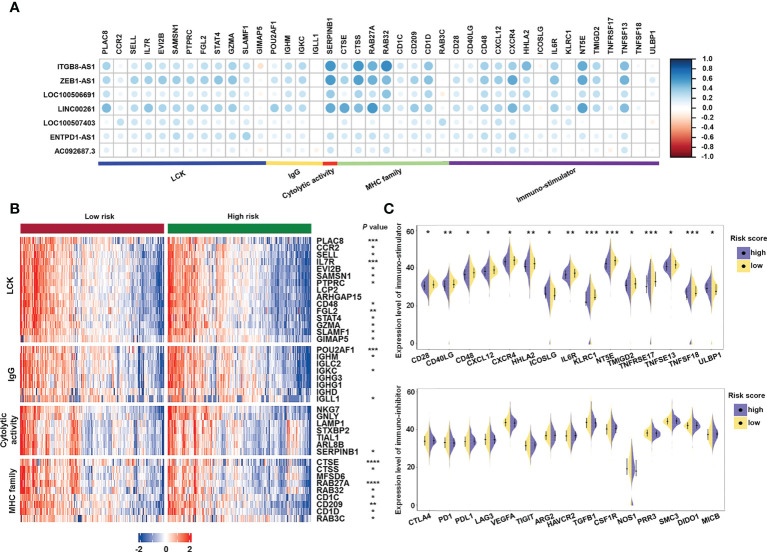
图9 免疫相关基因与唾液酸化相关lncRNA特征的相关性分析
6. 唾液酸化相关lncRNA特征的验证
作者使用流式细胞术和免疫荧光来探索不同细胞表面的唾液酸化模式。作者观察到HCoEpiC和HCT116细胞的荧光强度明显强于LoVo细胞(图10A-C )当细胞表面用SNA染色时,SNA是一种与α-2,6连接的唾液酸结合的特定凝集素。这些结果表明,LoVo细胞的唾液酸化水平显著降低。为了确认这七个唾液酸化相关的lncRNA标记基因的表达,对HCoEpiC和结肠癌细胞(HCT116和LoVo)进行了RT-qPCR。将HCT116细胞与HCoEpiC进行比较,作者发现ENTPD1-AS1,ITGB81-AS1,LINC00261,LOC100506691,LOC100507403和ZEB1-AS1在肿瘤细胞中显著过表达(图10D)。将LoVo细胞与正常结肠上皮细胞进行比较,作者发现LOC100506691和ZEB1-AS1在肿瘤细胞中的表达较高,而ENTPD1-AS1,LINC00261和LOC100507403在正常细胞中的表达较高。编号: AC092687.3ITGB8-AS1在细胞类型之间没有显著差异。
作者还使用了两个GEO队列,GSE147602和GSE198103,以调查作者签名的预后能力。在GSE147602,该公式计算的风险评分与LOC100506691,ZEB1-AS1,ITGB8-AS1,ENTPD1-AS1和LINC00261具有很强的相关性(图10E)。如图10F,风险评分与转移分期显著相关,但与其他临床病理特征(如性别和年龄)无显著相关性。在GSE198103,风险评分与编号:AC092687.3、LINC00261和ITGB8-AS1(图10G)。远处转移期患者的风险评分显著高于局部或区域分期患者(图10H)。唾液酸化相关的lncRNA标记评估CRC患者预后的能力被这两个队列清楚地验证。
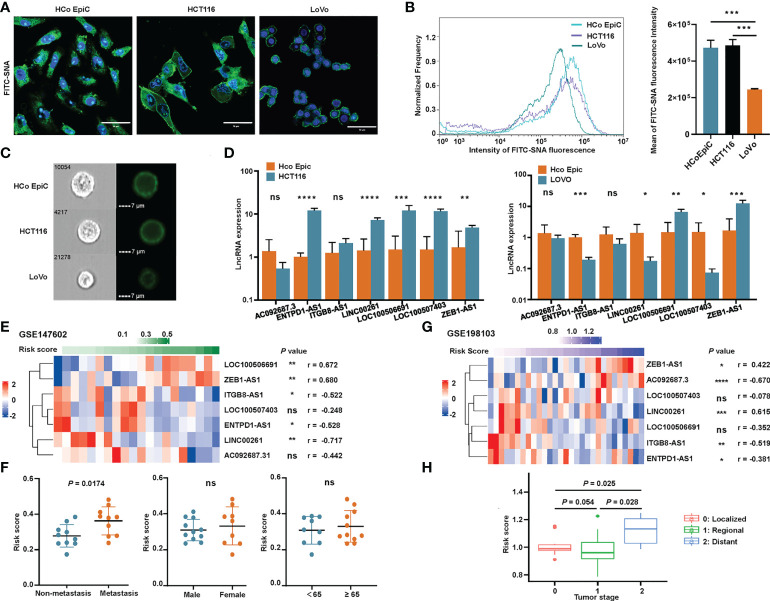
图10 验证与唾液酸化相关的lncRNA特征
7. 高危和低危组结直肠癌患者的药物敏感性预测
为了评估作者的唾液酸化相关特征在临床治疗中的应用,并确定针对高危患者的有前途的药物,作者分析了化疗药物的敏感性。在预测了543名患者的1900种化合物的敏感性后,作者在两个风险组之间进行了Wilcoxon测试,并将调整后的P<0.05(图11A)。在GDSC的198种化合物中,低风险组中有49种化合物的IC50显著降低,而高风险组中只有5种化合物。临床化疗常用药物见图11B。5-氟尿嘧啶和奥沙利铂的IC50在风险组间无差异,而喜树碱、伊立替康和多西他赛的IC50在低风险组中显著降低,这意味着风险评分较低的患者可能对这些化疗化合物更敏感。靶向受体酪氨酸激酶(RTK)途径的化合物,如西地尼、沃利替尼、福替尼和索拉非尼,预计在低风险组中更有效。两个风险组在靶向细胞外信号调节激酶/丝裂原活化蛋白激酶(ERK/MAPK)途径的化合物方面没有差异。
CTRP中的44种化合物和PRISM中的280种化合物在高风险组中的AUC显著降低。氯硝柳胺和苯丁酸氮芥处于两个数据库(图11C),这意味着在CTRP(图11D)和PRISM(图11E)的高危组中,它们都被预测为较低的AUC。作者的研究结果表明,风险特征可以支持临床药物选择,氯硝柳胺和苯丁酸氮芥可能适用于高风险患者。
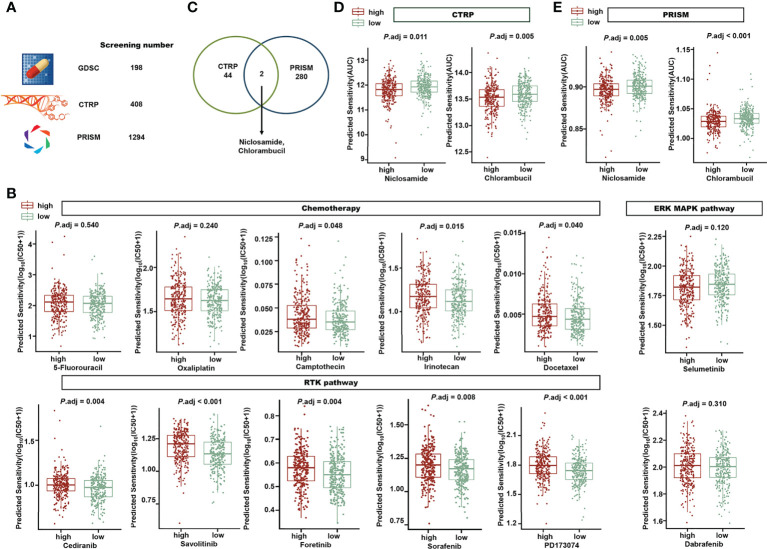
图11 探索风险特征和药物敏感性
结论:
综上所述,该研究是迄今为止对唾液酸化相关lncRNA在结直肠癌患者中临床意义的最系统的探索。作者成功开发并验证了一种新型的七唾液酸化相关lncRNA标记,该标记在预测CRC患者的预后,免疫状态和化疗敏感性方面表现出准确的性能。该研究可为结直肠癌患者的临床预后预测提供创新视角,为深化免疫治疗改善和个体化抗肿瘤治疗的理论基础做出贡献。
参考文献:
Zhou M, Lv S, Hou Y, Zhang R, Wang W, Yan Z, Li T, Gan W, Zeng Z, Zhang F, Yang M. Characterization of sialylation-related long noncoding RNAs to develop a novel signature for predicting prognosis, immune landscape, and chemotherapy response in colorectal cancer. Front Immunol. 2022 Oct 18;13:994874. doi: 10.3389/fimmu.2022.994874.






