发现病毒性心肌炎新靶点的途径——酶切割炎症小体
心肌炎的治疗方案目前有限。抑制钙激活酶已被证明可以预防CVB3诱导的心脏损伤,但钙激活酶的潜在作用机制尚未阐明。本研究证明CVB3感染诱导钙离子依赖的中性蛋白酶-I 1在线粒体中积累,并导致随后的ATP5A1裂解、线粒体ROS过量产生和线粒体功能受损,最终引起NLRP3炎症小体活化并诱导细胞焦亡。本发现确立calpain在病毒性心肌炎中的作用,并揭示其潜在的作用机制。因此,calpain有望成为治疗病毒性心肌炎的新靶点。
技术路线:

主要研究结果:
1、MCC950抑制CVB3诱导的凋亡和炎症反应,保护心肌功能
作者首先探讨直接抑制NLRP3炎症小体在心肌炎中的作用。在柯萨奇病毒B3(CVB3)感染前给予NLRP3选择性抑制剂MCC950后,NLRP3、Gasdermin D N端结构域(Gasdermin D-NT)和cleaved caspase-1(c-caspase-1)蛋白水平降低(图1A)。与CVB3单独感染小鼠相比,MCC950和CVB3共同感染小鼠心脏组织中c-caspase-1的免疫荧光密度降低,与WB结果一致(图1B)。重要的是,给予MCC950后,NLRP3与ASC的共定位明显被抑制,提示NLRP3炎症小体的平台形成减少(图1C)。ELISA检测细胞焦亡情况,结果显示CVB3刺激后血清CK-MB、LDH、cTnI、IL-18、IL-18β水平升高,而MCC950处理后可逆转上述效应(图1D-H)。此外,CVB3感染诱导的CD4阳性T淋巴细胞和F4/80阳性巨噬细胞浸润在CVB3 + MCC950组中不明显(图1I)。此外,与CVB3组相比,CVB3 + MCC950组通过降低射血分数(EF)和短轴缩短率(FS)显著改善心功能(图1J)。此外,CVB3 + MCC950组的心肌细胞存活率高于CVB3组,表明MCC950介导的抑制NLRP3炎症小体活化减轻CVB3诱导的死亡(图1K)。因此,MCC950能抑制CVB3诱导的凋亡和炎症反应,保护心肌功能。
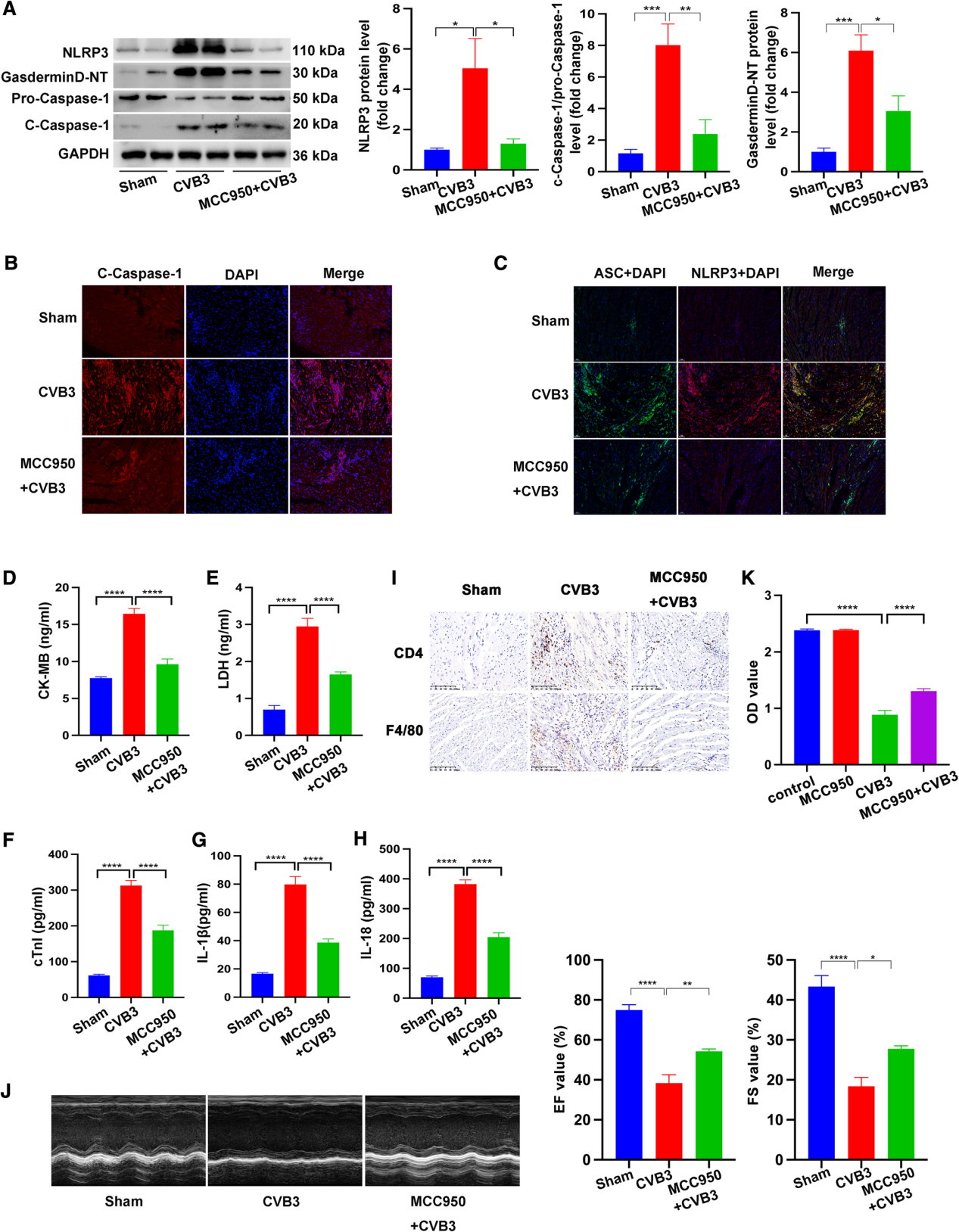
图1 腹腔注射CVB3建立小鼠心肌炎模型
2、Calpastatin过表达抑制CVB3诱导的细胞凋亡、纤维化和炎症,改善心功能障碍
接下来揭示calpain在CVB3诱导的心肌炎中潜在作用机制。如图2A所示,在CVB3注射后第7天,WT + CVB3组145/150 kDa处的α-Fodrin显著增加,而Tg-CAST + CVB3组α-Fodrin显著减少,提示calpastatin过表达对calpain活化的抑制作用。TUNEL染色显示WT + CVB3组TUNEL阳性细胞数较Tg-CAST + CVB3组增多(图2B)。HE染色结果显示,与WT + CVB3组相比,calpastatin过表达抑制CVB3诱导的炎症反应,Tg-CAST + CVB3组可见较少的炎性细胞浸润和坏死灶(图2C)。与WT小鼠相比,CVB3感染后Tg-CAST小鼠心脏组织中CD4 + T淋巴细胞和F4/80 +巨噬细胞浸润减少(图2D)。这说明长期CVB3感染导致心脏纤维化和心功能障碍。心脏组织切片的Masson染色显示,CVB3感染后100个月,WT小鼠心脏纤维化显著增加,而Tg-CAST小鼠心脏纤维化无明显变化(图2E)。CVB3感染导致WT小鼠出现明显的心功能障碍,表现为左心室EF和FS降低,而过表达calpastatin的Tg-CAST小鼠心功能显著改善(图2F)。因此,在体内抑制calpain不仅在急性期保护小鼠心脏免受CVB3感染诱导的细胞凋亡和炎症反应,而且在长期保护小鼠心脏免受心脏纤维化和心功能障碍。
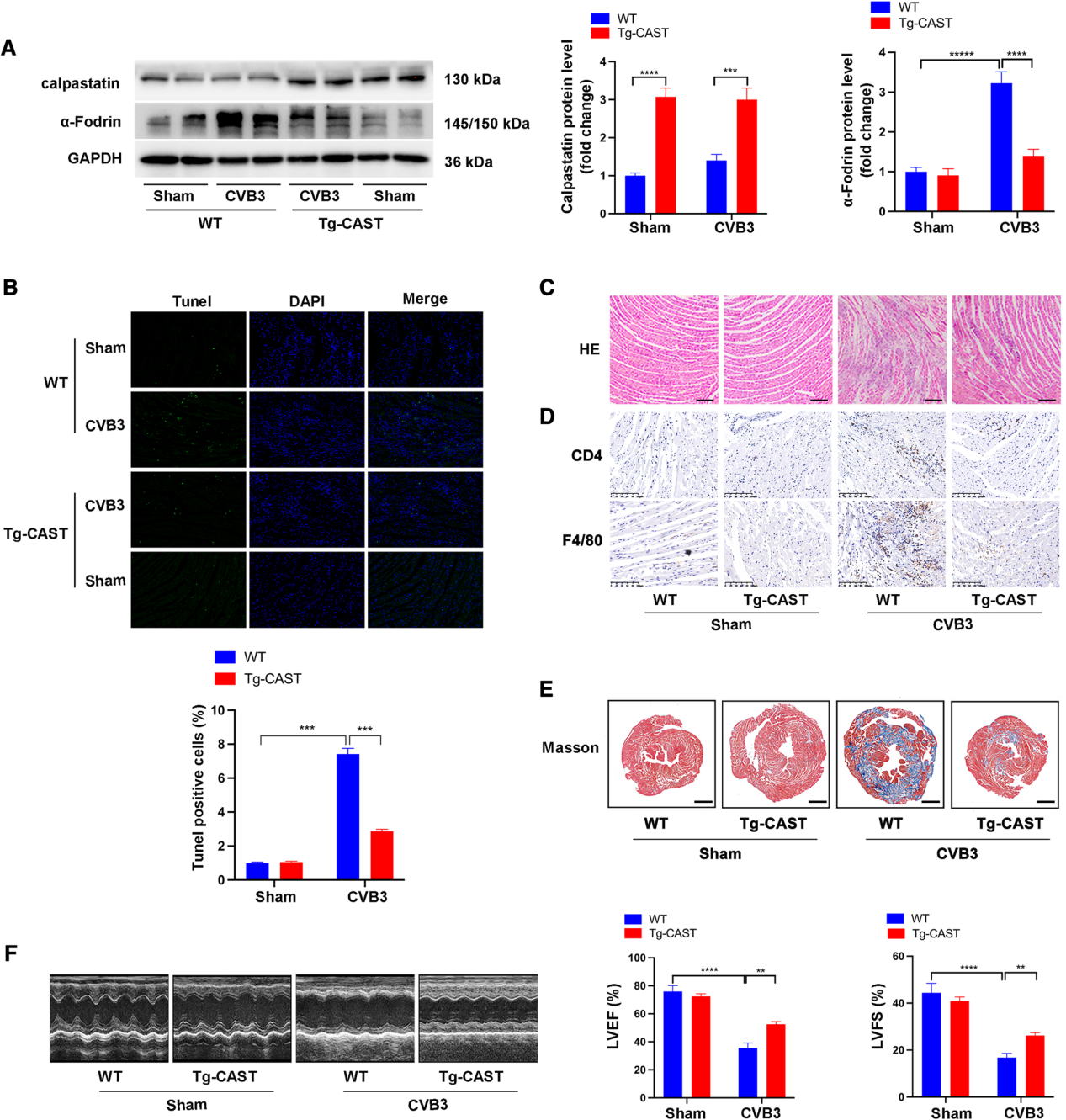
图2 在calpastatin过表达小鼠(Tg-CAST)及其同窝野生型小鼠(WT)中构建CVB3诱导的心肌炎模型
3、calpastatin过表达抑制CVB3感染后NLRP3炎症小体和细胞焦亡
接下来,作者确定calpain是否在NLRP3炎症小体的激活中发挥作用。在CVB3感染后,与WT小鼠相比,Tg-CAST小鼠的NLRP3、gasdermin D-NT和c-caspase-1水平显著降低(图3A)。免疫荧光染色也显示,在Tg CAST + CVB3组中过表达calpastatin抑制c-caspase-1、ASC、NLRP3的表达以及ASC与NLRP3的共定位(图3B-C)。此外,Tg-CAST + CVB3组血清CK-MB、LDH、cTnI、IL-18和IL-1 β水平较低,表明细胞焦亡较少(图3D-H)。为验证在体内的发现,并确定钙离子依赖的中性蛋白酶-I1是否是CVB3诱导的心肌炎中的主要钙蛋白酶,用钙离子依赖的中性蛋白酶-I1选择性抑制剂PD151746处理乳鼠心肌细胞后降低145/150 kDa处α-Fodrin的水平,证实钙激活酶的激活被PD151746显著抑制(图3I)。此外,PD151746处理抑制CVB3感染后心肌细胞中NLRP3、Gasdermin D-NT和c-caspase-1水平升高(图3I)。此外,PD151746保护心肌细胞免受CVB3诱导的细胞死亡(图3J)。这些发现证实钙离子依赖的中性蛋白酶-I 1是CVB3诱导的心肌炎中主要的钙蛋白酶。总之,体内和体外实验的结果提示,在CVB3感染的环境中抑制钙激活酶的激活可以阻断NLRP3炎症小体的激活,抑制细胞焦亡。
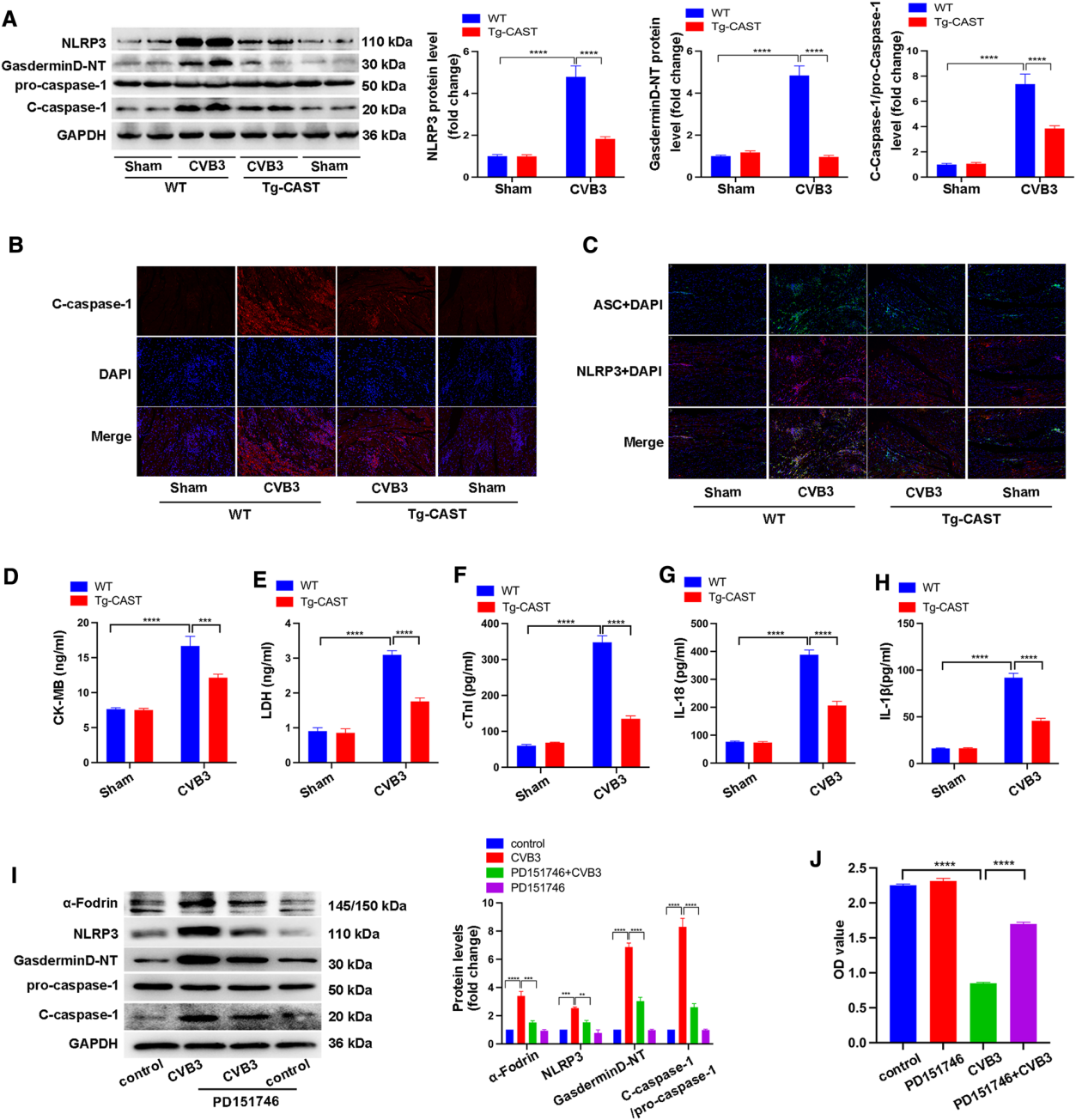
图3 CVB3感染的Tg-CAST和WT小鼠NLRP3炎症小体活化和细胞焦亡
4、mito-TEMPO预防炎症,抑制NLRP3炎症小体,改善心脏功能
下面进一步研究CVB3对病毒心肌组织发育过程中线粒体功能的影响。HE染色显示,CVB3感染后第3天,几乎看不到浸润的炎性细胞和坏死灶,但在CVB3感染后第7天,心肌出现严重的心脏炎症和损伤(图4A)。透射电镜观察发现,CVB3感染后第3天开始出现线粒体形态的改变。线粒体肿胀,排列不规则,内含不规则排列的嵴,嵴异常,空泡增多(图4A)。因此,在炎症反应之前出现异常线粒体,表明线粒体功能障碍可能导致CVB3诱导的心肌炎炎症。在CVB3感染前腹腔注射线粒体靶向抗氧化剂(mito-TEMPO)的小鼠,可降低CVB3诱导的线粒体活性氧(reactive oxygen species,ROS)水平(图4B)。CVB3感染诱导的CD4阳性T淋巴细胞和F4/80阳性巨噬细胞的浸润也被mito-TEMPO阻断(图4C)。重要的是,mito-TEMPO改善心脏功能,表现为增强的EF值和FS值(图4D)。线粒体ROS能否作为NLRP3炎症小体激活的原因。mito-TEMPO处理不仅降低CVB3诱导的Gasdermin D-NT和c-caspase-1水平的升高(图4E),而且降低血清CK-MB、LDH、IL-18和IL-1 β水平的升高(图4F-J)。总之,这些结果表明在CVB3诱导的心肌炎中,线粒体ROS与NLRP3炎症小体活化之间存在关联。
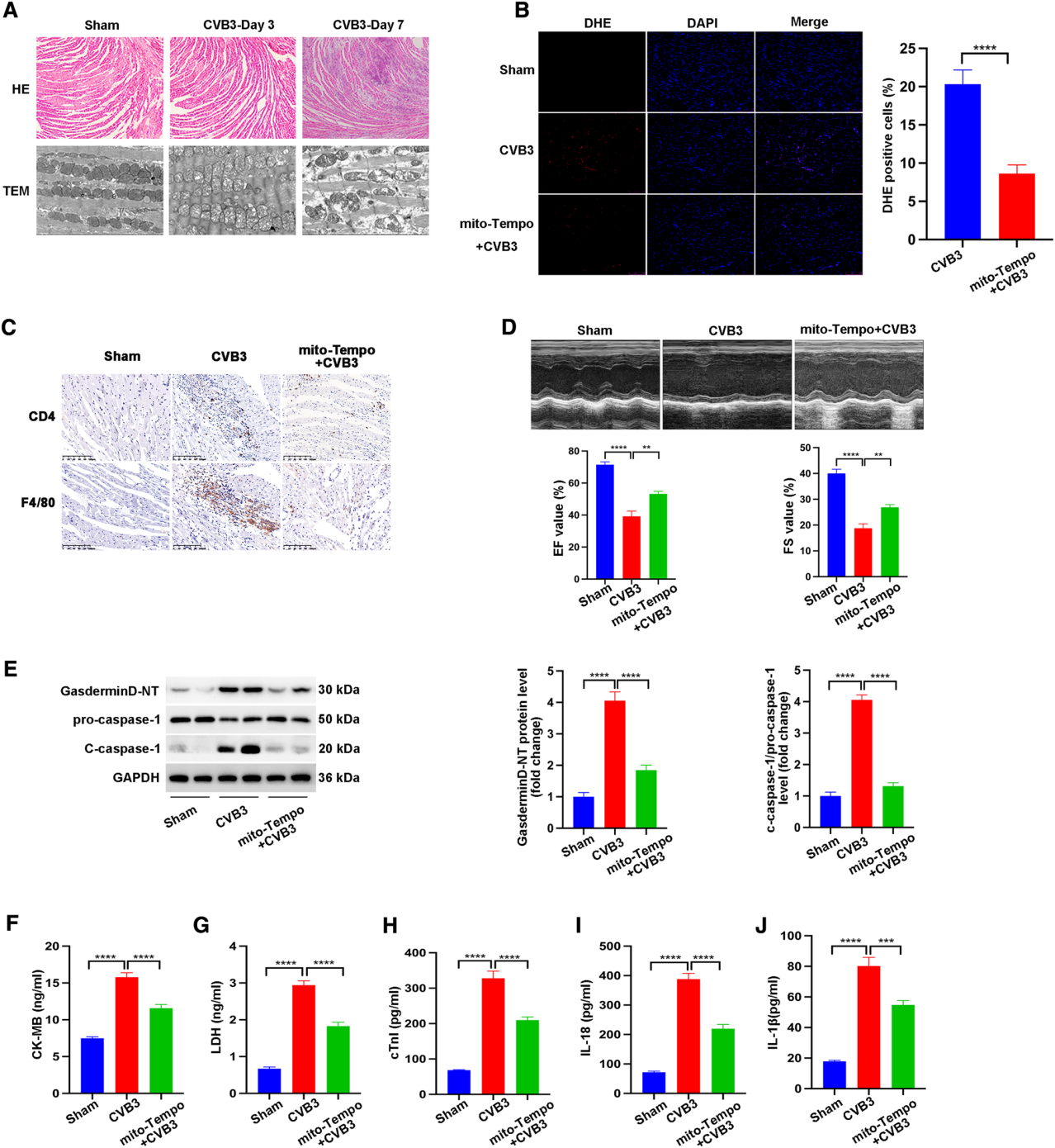
图4 mito-TEMPO预防炎症,抑制NLRP3炎症小体,改善心脏功能
5、Calpain-1调节线粒体功能,mito-TEMPO逆转calpain-1介导的NLRP3炎症小体活化
作者检测calpain在CVB3诱导的心肌炎中线粒体功能障碍与炎症反应中的作用。透射电镜显示,第3天起,与WT + CVB3组相比,过表达calpastatin的Tg-CAST + CVB3组线粒体结构损伤减轻,线粒体排列整齐,嵴排列较规则,空泡较少(图5A)。此外,如图所示,CVB3感染显著降低心肌ATP生成,而calpastatin过表达逆转受损的ATP生成,尽管并不显著(图5B)。此外,与WT + CVB3组相比,Tg-CAST + CVB3组心脏ROS染色不明显(图5C)。以上结果提示体内抑制calpain活性时线粒体功能更好。此外,JC-1染色检测线粒体膜电位(mitochondrial membrane potential,Δψm)结果显示CVB3感染导致Δψm降低,表现为较高的绿/红荧光比值,而PD151746单独处理并不影响Δψm,但PD151746处理可以阻止CVB3感染时Δψm的丢失(图5D)。此外,CVB3感染降低心肌细胞ATP生成,但PD151746处理在CVB3感染时一定程度上保留ATP生成(图5E)。接下来,作者使用MitoSOX Red探针检测线粒体氧化应激。如图5F所示,CVB3增加心肌细胞线粒体ROS生成,PD151746可抑制CVB3诱导的线粒体ROS生成。为直接地检测Calapin-1在心肌细胞中的作用,用带有Flag标签的过表达钙离子依赖的中性蛋白酶-I腺病毒(Ad-CAPN1)感染原代心肌细胞。Ad-CAPN1显著上调Flag表达,表明具有较高的感染效率(图5G)。心肌细胞用Ad-CAPN1或对照腺病毒(Ad-CT)处理48 h后感染CVB3,或Ad-CT感染的心肌细胞用CVB3和PD151746处理,然后用XFe96细胞外流量分析仪测定耗氧率(OCR)。CVB3处理下线粒体的基础呼吸、ATP连接的呼吸和最大呼吸均受到抑制,而钙离子依赖的中性蛋白酶-I1过表达并感染Ad-CAPN1进一步加剧这些效应。相反,PD151746缓解CVB3损伤的线粒体呼吸(图5H-K)。此外,钙离子依赖的中性蛋白酶-I1过表达加重CVB3诱导的细胞死亡,而mito-TEMPO保留细胞活性(图5L)。同样,CVB3处理后,mito-TEMPO孵育后钙离子依赖的中性蛋白酶-I1过表达增强的Gasdermin D-NT和c-caspase-1蛋白水平降低(图5M)。综上所述,钙离子依赖的中性蛋白酶-I1通过线粒体ROS介导的NLRP3炎症小体活化调节CVB3处理下的线粒体功能。
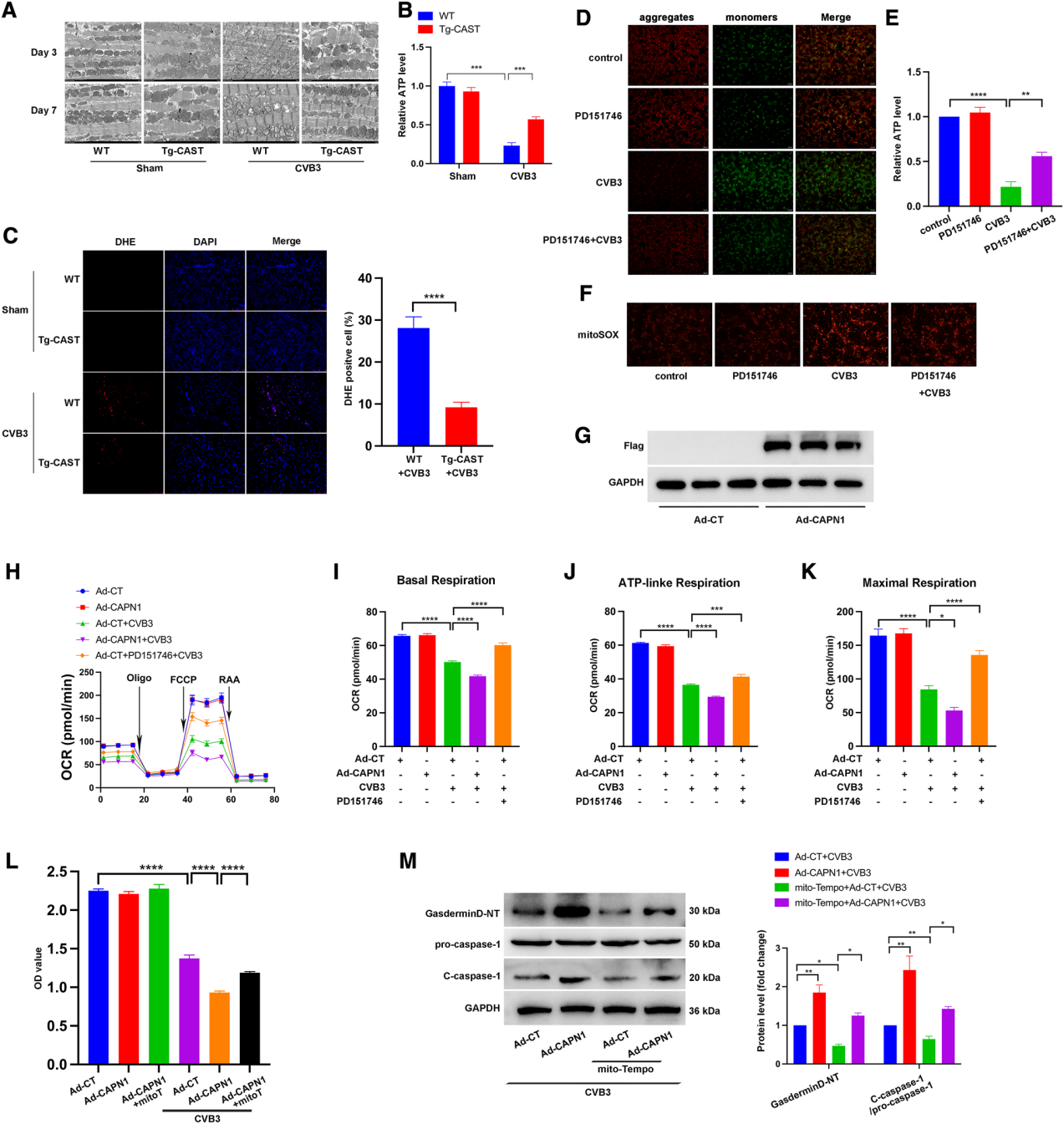
图5 calpain-1调节线粒体功能,mito-TEMPO逆转calpain-1介导的NLRP3炎症小体活化
6、CVB3刺激后calpain‑1在线粒体中积累
钙离子依赖的中性蛋白酶-I 1在心肌细胞中的具体作用靶点尚不清楚,作者评估CVB3感染下钙离子依赖的中性蛋白酶-I 1在心肌细胞中的胞浆和线粒体定位。在心脏组织中分离胞浆和线粒体组分,然后检测钙离子依赖的中性蛋白酶-I 1的蛋白水平。GAPDH的缺失和VDAC1的富集证实线粒体的纯度,CVB3感染的心脏中线粒体钙离子依赖的中性蛋白酶-I 1与胞浆钙离子依赖的中性蛋白酶-I 1的比值显著升高(图6A)。与体内研究结果一致,免疫荧光染色显示CVB3感染促进体外培养的心肌细胞中钙离子依赖的中性蛋白酶-I 1与线粒体的共定位(图6B),且CVB3感染后钙离子依赖的中性蛋白酶-I 1在线粒体中的蛋白水平高于细胞质(图6C)。因此,在CVB3感染下,细胞内钙离子依赖的中性蛋白酶-I 1的重新分布可能有助于其作用的发挥。然后,钙离子依赖的中性蛋白酶-I 1过表达仅限于线粒体(图6D)。在线粒体中过表达钙离子依赖的中性蛋白酶-I 1导致AC16细胞活力降低,该作用可被mito-TEMPO阻断(图6E)。此外,过表达线粒体钙离子依赖的中性蛋白酶-I 1增加gasdermin D-NT和c-caspase-1的蛋白水平,而mito-TEMPO抑制gasdermin D-NT和c-caspase-1的蛋白水平(图6F)。总之,数据表明CVB3刺激后钙离子依赖的中性蛋白酶-I 1的细胞质到线粒体的转位负责其对细胞活力和NLRP3炎症小体活化的调节。

图6 CVB3刺激后Calpain-1在线粒体中积累
为进一步探索CVB3感染下钙离子依赖的中性蛋白酶-I-1在心肌细胞中的直接作用靶点,作者用Ad-CAPN1在新生大鼠心肌细胞中过表达calpain-1,然后在CVB3感染或不感染的情况下,将提取的蛋白与抗Flag抗体或对照抗IgG抗体进行免疫共沉淀并进行质谱分析。筛选出假阳性蛋白,即抗Flag抗体免疫沉淀的蛋白与相应对照的重叠蛋白,在Ad-CAPN1感染的细胞中,有8个蛋白被抗Flag抗体免疫沉淀,有或没有CVB3处理(图7A)。因此,作者检测WT + CVB3组和Tg-CAST + CVB3组中ATP synthase-α(ATP5A1)的表达。研究发现CVB3感染降低WT小鼠ATP5A1的表达,但在Tg-CAST小鼠中没有发现(图7B),这表明CVB3感染激活的calpain可能切割ATP5A1,导致功能性ATP5A1蛋白水平降低。体外实验结果也显示CVB3感染降低ATP5A1水平,而PD151746共处理逆转的这一现象(图7C)。此外,CVB3处理NRCMs后,在抗钙离子依赖的中性蛋白酶-I 1抗体免疫沉淀样品中检测到ATP5A1的表达,在抗ATP5A1抗体免疫沉淀样品中检测到钙离子依赖的中性蛋白酶-I 1的表达,OV07 1与NRCMs中的ATP5A1存在相互作用(图7D-E)。将siATP5A1转染NRCMs敲低ATP5A1表达(图7I),JC-1染色和MitoSOX染色发现siATP5A1降低线粒体Δψm,增加线粒体ROS(图7F)。ATP5A1下调也降低ATP的生成(图7G)。此外,与对照siRNA相比,siATP5A1降低NRCMs的活力(图7H),促进NLRP3炎症小体的激活,表现为gasdermin D-NT和c-caspase-1的水平升高(图7I)。因此,ATP5A1是钙蛋白酶-1的切割靶点。
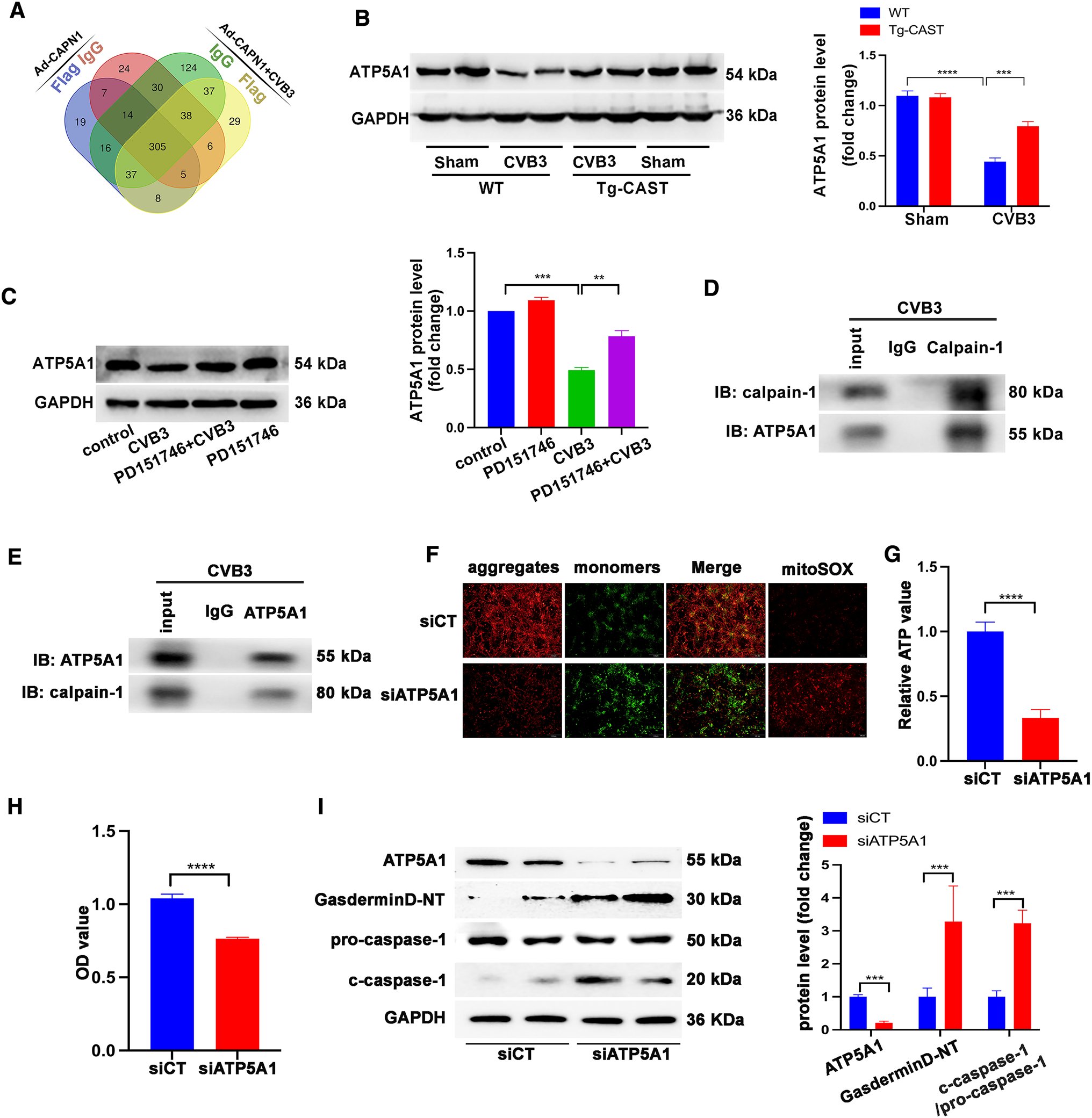
图7 ATP5A1是钙蛋白酶-1的切割靶点
结论
在本研究中,作者证明体内外抑制calpain通过抑制NLRP3炎症小体的激活减轻CVB3诱导的心肌损伤。此外,作者发现CVB3处理下钙离子依赖的中性蛋白酶-I 1的作用改变线粒体功能,因为钙离子依赖的中性蛋白酶-I 1易位到线粒体并切割ATP5A1,导致ATP合成不足,线粒体ROS过量产生,线粒体功能障碍,随后激活NLRP3炎症小体和细胞焦亡(图8)。
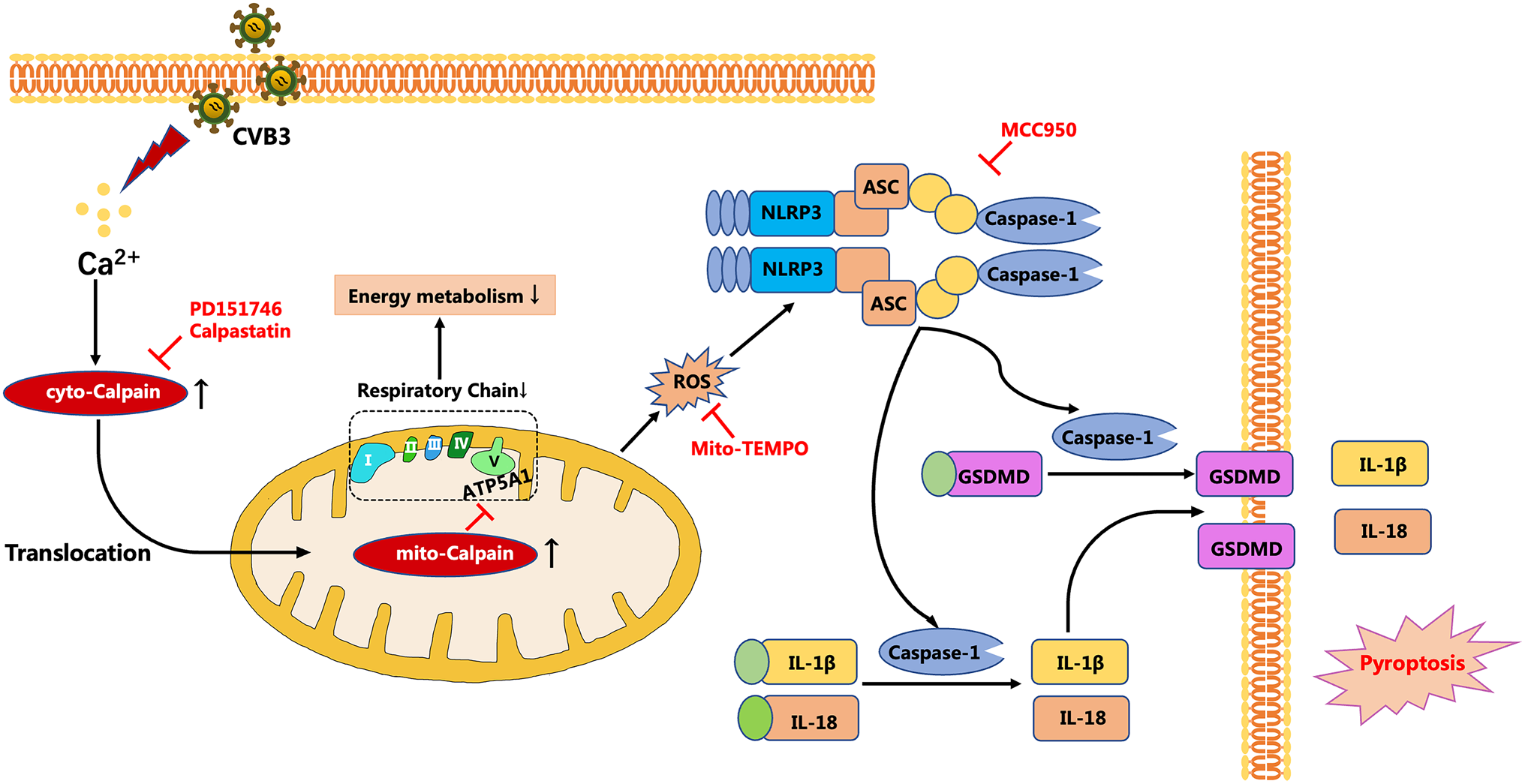
图8在CVB3刺激下激活的Calpain-1通过线粒体中ATP5A1的裂解和ROS的过量产生促进NLRP3炎性体依赖性的焦亡
参考文献
Liu X, Li M, Chen Z, Yu Y, Shi H, Yu Y, Wang Y, Chen R, Ge J. 2022. Mitochondrial calpain-1 activates NLRP3 inflammasome by cleaving ATP5A1 and inducing mitochondrial ROS in CVB3-induced myocarditis. Basic Res Cardiol; 117(1):40. doi: 10.1007/s00395-022-00948-1.






