pTINCR微蛋白通过CDC42 SUMO化和激活促进上皮分化,抑制肿瘤生长
人类转录组包含数千个小的开放阅读框(sorf),它们编码的微蛋白的功能在很大程度上仍未被探索。在本研究中,我们发现TINCR lncRNA编码pTINCR, pTINCR是一种进化保守的泛素样蛋白(UBL),在许多上皮细胞中表达,在分化和细胞应激下表达上调。通过功能获得和功能丧失的研究,我们证明了pTINCR是体外和体内上皮分化的一个关键诱导因子。有趣的是,在几种上皮性癌症中,TINCR的低表达与较差的预后相关,而pTINCR的过表达降低了患者源性异种移植瘤的恶性程度。在分子水平上,pTINCR通过SUMO相互作用motif (SIM)与SUMO结合,并与CDC42结合,CDC42是一种RhoGTPase,对肌动蛋白细胞骨架重塑和上皮分化至关重要。此外,pTINCR增加CDC42的sumo化并促进其激活,触发促分化级联反应。我们的研究结果表明,微蛋白质组是与癌症相关的细胞身份的新调控源。本文于2022年11月11日发表于Nature Communications(IF=17.694)。
技术路线:

主要研究结果:
(1) pTINCR是由TINCR lncRNA编码的一种保守微蛋白,在上皮组织中表达
TINCR是角化细胞和其他上皮细胞分化过程中上调的3.7千碱基lncRNA 40 - 42。我们证实了TINCR在人和小鼠皮肤中表达,也在其他上皮细胞中表达(图1b)。对TINCR转录本的保守分析显示sORF为264 bp(图1c)。小鼠皮肤核糖体谱分析(RibORF评分≥0.7)显示,该sORF被翻译成一种高度保守的具有87个氨基酸的微蛋白,我们将其命名为pTINCR(图1c, d)。为了确认pTINCR sORF被翻译成一种稳定的微蛋白,我们在35s -蛋氨酸存在的情况下,使用全长TINCR lncRNA (integrl: ENST00000448587.5)进行了体外翻译(图1e, f),并获得了约12 kDa的肽产物。值得注意的是,突变pTINCR的起始密码子会损害任何可检测产物的翻译(图1e, f)。

(2) pTINCR促进体外和体内上皮分化
为了表征pTINCR的细胞和分子功能,我们在强力环素诱导的慢病毒载体中克隆了标记HA表位的pTINCR sORF。我们生成了两种不同的结构,将ha标记放置在微蛋白的c端(pTINCR-HA)或n端(HA-pTINCR)部分。为了最大限度地减少标签对pTINCR的可能影响,我们在HA和pTINCR sORF之间引入了一个灵活的连接器。此外,为了分离TINCR lncRNA和pTINCR微蛋白的功能,我们还通过突变约20%的pTINCR-HA核苷酸序列,开发了一个合成的ORF (syORF),在生产相同的蛋白质的同时显著改变了RNA的二级结构。我们在整个手稿中使用syORF来验证我们的主要发现(见图图例)。在U2OS中瞬时表达时检测到C-和N-末端结构,并显示出类似的分布,在所有细胞组分中均可检测到,但最显著的是在细胞核和细胞间连接处,与蛋白质的内源性定位一致(图1k)。

(3) 体外上皮分化需要pTINCR
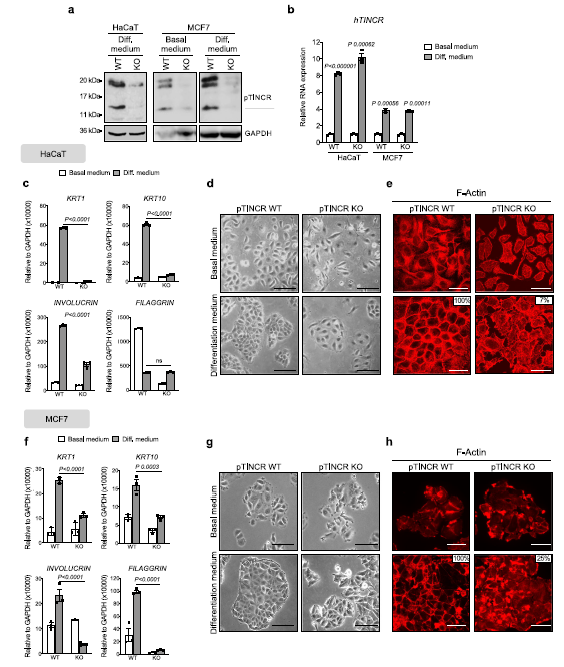
我们使HaCaT和MCF7细胞都受到高钙的作用,高钙是一种众所周知的表皮分化诱导剂50,同时也是其他上皮组织如食管或乳腺的分化诱导剂。WTMCF7细胞(图4a) O n, p t I n C R p R O e x p R s n n t M cf7细胞(图4a)。重要的是,我们观察到在WT和pTINCR-KO细胞中,TINCR lncRNA在钙诱导的分化过程中有相同程度的上调(图4b),表明在工程pTINCR-KO细胞中,TINCR lncRNA的调控不受影响。然而,ptincro缺陷细胞无法像WT细胞一样上调分化标志物(图4c, f)。此外,pTINCRKO细胞在分化条件下没有获得上皮形态(图4d, g),也没有重塑其肌动蛋白细胞骨架向皮层倾向(图4e, h)。这些结果表明,pTINCR蛋白独立于TINCR lncRNA,在体外实现完全上皮分化是必需的。
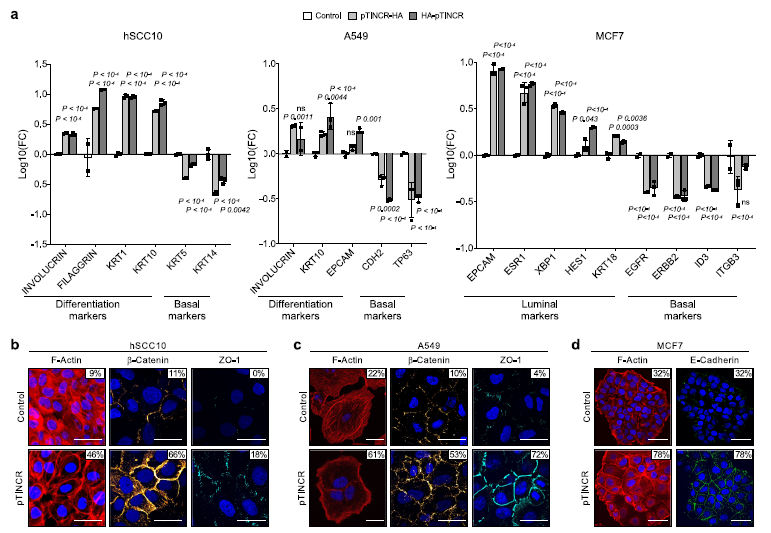
(4) pTINCR触发上皮分化转录程序
为了证实pTINCR的促分化功能,我们分析了pTINCR过表达诱导的转录谱。我们在pTINCR过表达的hSCC10细胞系中进行了广泛的RNA-seq分析,以评估早期转录组变化(6、12和24小时)和长期变化(4、7、14和21天),后者可能反映了细胞特性的变化。首先,我们使用脉冲算法研究了pTINCR过表达驱动的转录动力学,脉冲算法是纵向测序实验的框架,揭示了与time54相关的差异基因表达。我们检测到6组不同的基因,根据它们的动态表达聚集在一起(图5a, b)。我们对每个聚类进行了基因本体富集分析(图5c, d)。有趣的是,其中两个簇1和簇2是动态对立的簇,都丰富了与细胞骨架相关的基因本体术语。
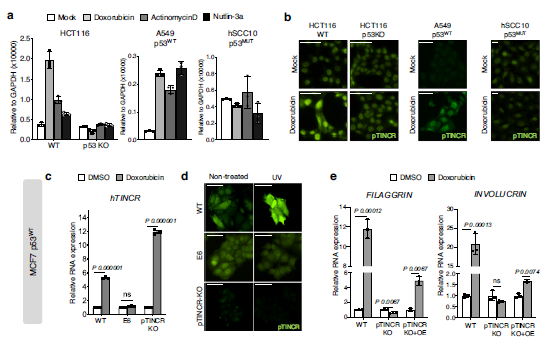
(5) pTINCR在细胞应激时以p53依赖的方式上调,是损伤诱导分化所必需的
pTINCR过表达21天后,其他上皮特异性的信号(“上皮细胞分化”、“细胞-细胞连接”、“上皮细胞-细胞粘附”、“顶端表面”、“Notch信号”)和表皮相关的信号(“表皮细胞分化”、“皮肤发育”、“角化细胞分化”、“角化”)也会发生变化(图5g, h)。与pTINCR表达负相关的基因集在与细胞周期、细胞代谢和蛋白质加工等相关的通路中富集(图5g)。有趣的是,我们发现ptincr下调基因也富集在“Myc靶点”的信号区,这是cSCC中的一种致癌途径,与肿瘤的分化级别和该恶性肿瘤的临床预后密切相关44,56,57。我们通过RT-qPCR分析验证了这些结果。总之,该转录组学研究强烈支持我们的功能研究揭示的pTINCR促分化功能。

众所周知,P53是一种肿瘤抑制因子,在50%以上的人类癌症中都发生了突变。此外,越来越多的证据表明p53也参与胚胎发育和细胞分化58,59。我们之前的研究结果表明,考虑到HaCaT细胞是p53突变体,pTINCR在钙诱导分化中的作用不需要功能p53。考虑到在上皮组织中,细胞损伤会激活末端分化程序36,37,我们想知道pTINCR的表达是否与损伤时p53的激活有关。首先,我们用几种p53诱导剂或稳定剂(阿霉素、放线菌素- d或nutlin-3a)处理不同的癌细胞系,并分析TINCR表达和pTINCR水平。我们观察到,只有p53功能正常(A549或HCT116)的细胞在mRNA和蛋白水平上调了pTINCR,而p53- ko细胞(HCT116 p53KO)或p53突变(hSCC10)没有表现出相同的反应(图6a, b)。
这些结果证实了pTINCR在应激中以p53依赖的方式上调。我们分析了已发表的p53 ChIP-seq实验60,61,我们没有观察到p53与pTINCR位点结合,无论是在对照组细胞中还是在使用dna损伤剂处理的细胞中,这表明p53对pTINCR的调控是间接的。接下来,我们使用pTINCR- ko MCF7细胞系研究了pTINCR缺乏对p53依赖性dna损伤诱导分化的影响。MCF7细胞是p53 WT,正如预期的那样,在pTINCR-WT和pTINCR-KO细胞中,TINCR转录水平在损伤后上调(图6c)。
结论:
总之,我们揭示了pTINCR是一种以前被忽视的UBL-微蛋白,它调节上皮细胞的识别并显示出肿瘤抑制活性(图10)。pTINCR作为一种假设lncRNA的生物活性产物的发现,促进了由lncRNA编码的微蛋白所代表的额外调控水平的想法。对微蛋白质组的探索可以为调控生理和病理过程(如癌症)提供新的细胞识别调节因子。
参考文献:
Boix, O., Martinez, M., Vidal, S., Giménez-Alejandre, M., Palenzuela, L., Lorenzo-Sanz, L., Quevedo, L., Moscoso, O., Ruiz-Orera, J., Ximénez-Embún, P., Ciriaco, N., Nuciforo, P., Stephan-Otto Attolini, C., Albà, M. M., Muñoz, J., Tian, T. V., Varela, I., Vivancos, A., Ramón Y Cajal, S., Muñoz, P., … Abad, M. (2022). pTINCR microprotein promotes epithelial differentiation and suppresses tumor growth through CDC42 SUMOylation and activation. Nature communications, 13(1), 6840. https://doi.org/10.1038/s41467-022-34529-6.






