外泌体miR-140-5p通过靶向IGF1R和调节后纵韧带骨化过程中的mTOR通路抑制成骨
后纵韧带骨化(OPLL)是一种致残性疾病,其发病机制尚不清楚,尚无有效的治疗或预防方法。外泌体miRNA在异位骨的成骨过程中起着重要作用。最近,有作者关注miR-140-5p在OPLL细胞来源外泌体中的下调,因此以探索外泌体miR-140-5p抑制OPLL成骨的机制。该研究于2022年10月发表在《Journal of Nanobiotechnology》,IF:9.249.
技术路线:
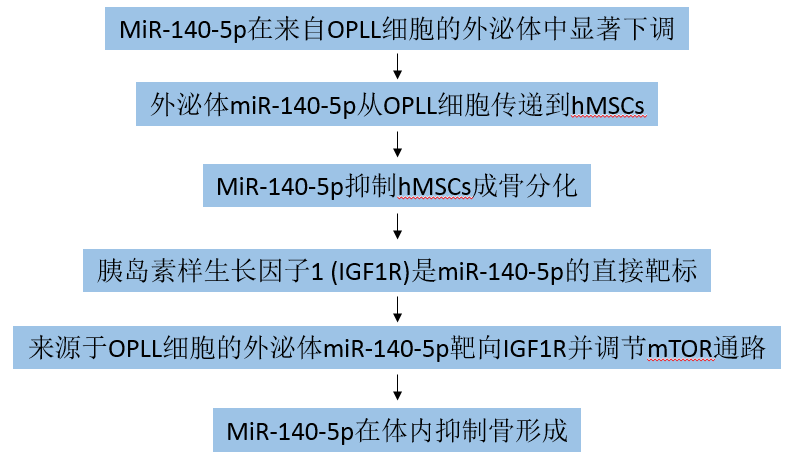
主要研究结果:
1. MiR-140-5p在来自OPLL细胞的外泌体中显著下调
作者在手术过程中收集OPLL患者的组织样本,利用靠近骨化块的韧带体外培养细胞,并在后纵韧带细胞培养上清中收集外泌体。以从颈椎外伤(non-OPLL)患者的后纵韧带(PLL)细胞培养上清中获得外泌体作为对照组。在透射电镜下观察到典型的外泌体双层膜结构(图1a)。纳米颗粒跟踪分析(NTA)显示各组收集到的胞外囊泡大小约为108 nm至120 nm(图1b)。检测到外泌体标记CD63和TSG101(图1c)。随后,使用下一代测序(NGS)技术分析外泌体中差异表达的miRNAs(图1d)。用PCR检测前三种下调的miRNA以验证NGS数据,结果显示miR-140-5p在OPLL细胞来源的外泌体中显著下调(图1e)。

图1 MiR-140-5p在来自OPLL细胞的外泌体中显著下调
2. 外泌体miR-140-5p从OPLL细胞传递到hMSCs
为了阐明miR-140-5p是否由OPLL细胞分泌并传递到hMSCs,用慢病毒(LV-miR-140-5p)或其阴性对照转染OPLL细胞,使miR-140-5p过表达(图2a),然后收集细胞培养上清分离外泌体。qPCR显示miR-140-5p在外泌体中富集(图2b)。用PKH67标记过表达miR-140-5p的外泌体,然后将其添加到hMSC培养中。在hMSCs的细胞质中PKH67荧光呈阳性(图2c),表明miR-140-5p通过外泌体传递到hMSCs中。此外,在用过表达miR-140-5p的外泌体和对照外泌体培养的hMSCs中,分析miR-140-5p的前体miR-140的表达水平(图2d),均无显著差异。这些结果表明,miR-140-5p在hMSCs中的上调是由外泌体传递而非内源性miR-140转录诱导的。

图2外泌体miR-140-5p从后纵韧带细胞传递到hMSCs
3. MiR-140-5p抑制hMSCs成骨分化
形成异位骨化的前提是hMSCs开始成骨分化。因此,为了阐明外泌体miR-140-5p在OPLL发病机制中的作用,研究外泌体miR-140-5p对hMSCs成骨分化的影响。用慢病毒LV-miR-140-5p或LV-sponge分别转染OPLL细胞(图3a),使miR-140-5p过表达或下调;同时转染阴性对照慢病毒LV-miR-NC或LV-sponge-NC。随后,收集细胞条件培养基分离以下外泌体:miR-140-5p-exo, miR-NC-exo, sponge-exo和sponge-NC-exo。qPCR证实miR-140-5p在外泌体中成功过表达或下调(图3b)。hMSC与上述外泌体培养24 h后,qPCR显示miR-140-5p-exo处理后,miR-140-5p在hMSCs中的表达上调(图3c),说明miR-140-5p通过外泌体传递到hMSCs中。随后使用成骨诱导培养基诱导hMSCs成骨分化。7天后,用alkaline phosphatase对hMSCs进行染色。14 d后,用Alizarin red染色hMSCs。结果显示,miR-140-5p-exo处理后hMSC染色阳性率明显低于其他各组(图3d,e)。qPCR和Western blotting显示,在miR-140-5p-exo处理的hMSCs中,成骨相关基因的表达被显著抑制(图3f,g)。综上所述,这些结果表明外泌体miR-140-5p抑制了hMSCs的成骨分化。外泌体中miR-140-5p的缺失可促进hMSCs成骨分化和成骨相关基因的表达。
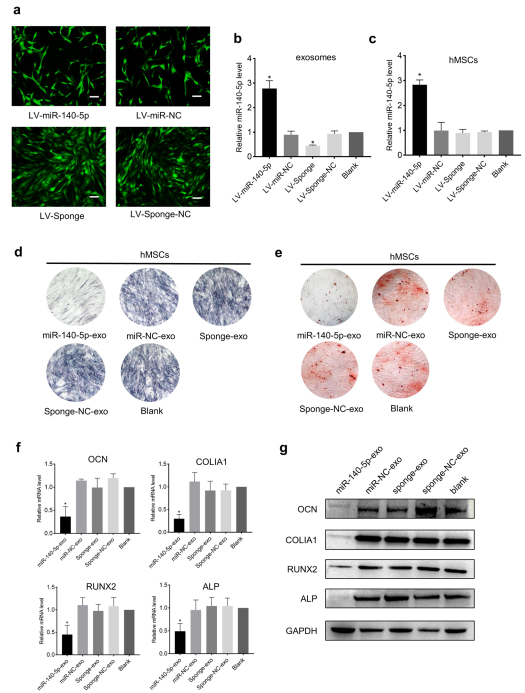
图3 MiR-140-5p抑制hMSCs成骨分化
4. 胰岛素样生长因子1 (IGF1R)是miR-140-5p的直接靶标
为了阐明miR-140-5p抑制hMSCs成骨分化的机制,使用TargetScan数据库预测了miR-140-5p的靶基因,发现了434个转录本。使用miRDB数据库预测靶点,miRDB中有413个miR-140-5p预测靶点。为了缩小可能的候选基因范围,我们测定了上述两个数据库的重叠,共显示191个基因(图4a)。其中一种是IGF1R,它属于受体酪氨酸激酶家族。我们检测了miR-140-5p-exo处理后hMSCs中IGF1R的mRNA水平,结果显示IGF1R的mRNA水平明显降低(图4b)。荧光素酶报告实验证明IGF1R与miR-140-5p能直接结合(图4c,d)。此外, miR-140-5p mimic下调了hMSCs中IGF1R mRNA和IGF1R蛋白(图4e, f)。综上所述,这些结果表明IGF1R是miR-140-5p的直接靶标。外泌体miR-140-5p与IGF1R 3'UTR相互作用,并在hMSCs中发挥转录抑制作用。
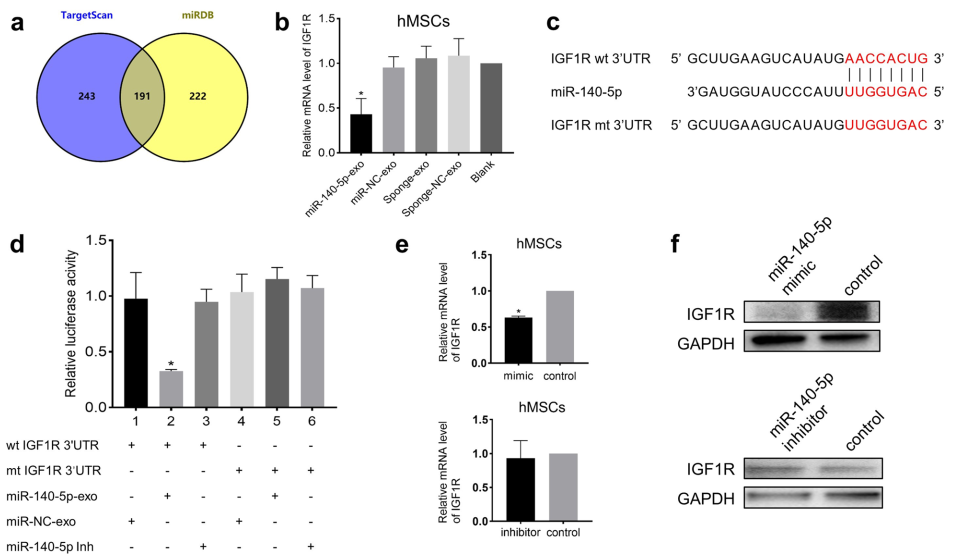
图4 IGF1R是miR-140-5p的直接靶标
5. 来源于OPLL细胞的外泌体miR-140-5p靶向IGF1R并调节mTOR通路
为了阐明外泌体miR-140-5p对hMSCs成骨分化的抑制作用是通过抑制IGF1R介导的,使用IGF1R siRNA直接敲除hMSCs中的IGF1R(图5a)。hMSCs成骨诱导后,敲低组hMSCs alkaline phosphatase和Alizarin red染色阳性率明显低于对照组(图5b, c)。OCN、COLIA1、RUNX2和ALP的表达也被抑制(图5d,e)。IGF1R拯救实验表明,上调IGF1R后,alkaline phosphatase和Alizarin red染色呈强阳性,OCN、COLIA1、RUNX2、ALP表达水平也升高(图5f-j)。此外,在用LV-IGF1R转染hMSCs后,用miR-140-5p-exo处理,IGF1R促进成骨的作用被逆转(图5k, l)。
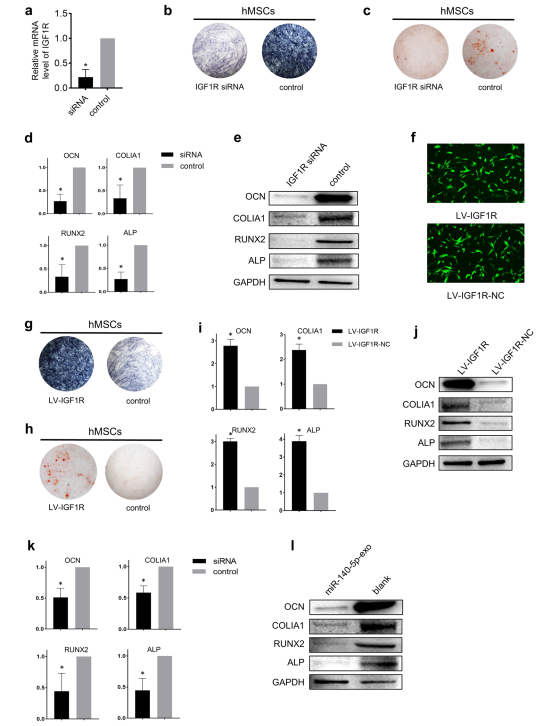
图5 IGF1R对于外泌体miR-140-5p抑制hMSCs成骨至关重要
有文献报道IGF1和IGF1R联合使用可以通过激活mTOR通路促进MSCs成骨,从而改善小鼠骨质疏松症。在用miR-140-5p-exo处理hMSCs后,IGF1不刺激IGF1R、IRS1、PI3K、Akt或mTOR的磷酸化,而在miR-NC-exo、sponge-exo或sponge-NC-exo处理后,IGF1刺激IGF1R、IRS1、PI3K、Akt和mTOR的磷酸化(图6a)。为了阐明IRS1、PI3K、Akt和mTOR的上下行关系,用IRS1抑制剂NT157处理hMSCs。结果表明,IGF1不能引起PI3K、Akt、mTOR的磷酸化。LY294002 (PI3K抑制剂)治疗可降低IGF1引起的Akt和mTOR磷酸化,但不影响IGF1R和IRS1的磷酸化。此外,MHY1485 (mTOR抑制剂)治疗不能抑制IGF1引起的IRS1、PI3K或Akt的磷酸化(图6b)。因此,上述关键分子的上下行关系为IGF1R/IRS1/PI3K/Akt/mTOR。为了进一步阐明IGF1R/IRS1/PI3K/Akt/mTOR轴的作用,分别使用NT157 (IRS1抑制剂)、LY294002 (PI3K抑制剂)、MK2206 (Akt抑制剂)和MHY1485 (mTOR抑制剂)干扰hMSCs的成骨诱导。结果显示NT157、LY294002、MK2206、MHY1485分别抑制hMSCs的成骨分化(图6c, d)。综上所述,这些数据表明外泌体miR-140-5p通过靶向IGF1R和调节mTOR途径抑制hMSCs的成骨分化。

图6外泌体miR-140-5p通过IGF1R/IRS1/PI3K/Akt轴调控mTOR通路抑制成骨
6. MiR-140-5p在体内抑制骨形成
为了进一步探索miR-140-5p在体内的功能,在裸鼠中进行了异位骨形成实验。用miR-140-5p-exo、miR-NC-exo、sponge-exo或sponge-NC-exo培养hMSCs 48 h。成骨诱导后,将上述hMSCs与Bio-Oss Collagen充分混合并培养48 h。最后,将支架和细胞的混合物植入裸鼠背部皮肤下(图7a)。8周后处死动物,通过显微计算机断层扫描计算骨体积/组织体积(BV/TV)和骨密度(BMD)(图7b)。结果显示,miR-140-5p-exo处理后,异位骨BV/TV和BMD显著降低(图7c和d)。随后,对异位骨进行免疫组化检测,结果显示miR-140-5p-exo处理后,异位骨中OCN、COLIA1、RUNX2、ALP的表达均被抑制,而对照组均为阳性(图7e)。此外,还对异位骨切片进行IGF1R免疫染色,结果显示,miR-140-5p-exo处理的异位骨中IGF1R阳性率明显低于对照组(图7e)。上述结果表明,miR-140-5p在体内对骨形成具有抑制作用。
综上所述,外泌体miR-140-5p在PLL细胞中的表达明显低于PLL细胞。MiR-140-5p通过外泌体转入hMSCs,靶向IGF1R,调控IRS1/PI3K/Akt,最终通过mTOR途径抑制成骨分化(图7f)。在OPLL细胞中过表达miR-140-5p可抑制hMSCs的成骨分化,这是一种潜在的治疗OPLL的新策略。

图7 MiR-140-5p在体内抑制骨形成
结论:
外泌体miR-140-5p可以通过靶向IGF1R和调节mTOR途径抑制hMSCs的成骨分化。外泌体作为一种药物传递系统,可能在未来成为治疗OPLL的潜在药物治疗手段。IGF1B也可能是未来OPLL分子治疗的靶点。
参考文献:
Tang Y, Sun Y, Zeng J, Yuan B, Zhao Y, Geng X, Jia L, Zhou S, Chen X. Exosomal miR-140-5p inhibits osteogenesis by targeting IGF1R and regulating the mTOR pathway in ossification of the posterior longitudinal ligament. J Nanobiotechnology. 2022;20(1):452.






