LSD1缺失降低胃癌外泌体PD-L1,恢复T细胞应答
组蛋白赖氨酸特异性去甲基化酶1 (LSD1)在胃癌(GC)中的表达明显升高,可能与胃癌的增殖和转移有关。据报道,LSD1在黑色素瘤和乳腺癌中通过程序性细胞死亡1配体1 (PD-L1)抑制肿瘤免疫。LSD1在胃癌免疫微环境中的作用尚不清楚。本研究中采用免疫组化(IHC)和免疫印迹(Western Blot)分析胃癌患者LSD1和PD-L1的表达情况。通过体内探索,LSD1 KO(敲除)的小鼠前胃癌(MFC)细胞在615只小鼠体内的生长明显慢于T细胞缺失的BALB/c裸鼠。同时在GC标本中,LSD1的表达与CD8的表达呈负相关,与PD-L1的表达呈正相关。进一步研究表明,LSD1通过诱导外泌体中PD-L1的积累,抑制T细胞在GC微环境中的反应,而在GC细胞中,膜PD-L1保持不变。使用外泌体作为载体,LSD1也阻碍了其他癌细胞的T细胞反应,而LSD1的缺失挽救了T细胞的功能。研究发现,外泌体在依赖供体细胞中LSD1存在的情况下,可调节MFC细胞增殖,其作用与体内外泌体PD-L1介导的T细胞免疫有关。上述结果表明,LSD1缺失降低胃癌外泌体PD-L1,恢复T细胞应答;这一发现提示了LSD1可能调控胃癌肿瘤免疫的新机制,为胃癌的免疫治疗提供了新的靶点。本文于2022年3月发表于Molecular Cancer (IF=41.444)上。
技术路线:

主要研究结果:
(1) LSD1的去除通过抑制GC中T细胞的反应来抑制肿瘤的生长
为了确定LSD1在GC中对肿瘤免疫的调节作用,使用TIMER2.0平台分析了LSD1和免疫细胞信号之间的相关性。在各种免疫细胞中,LSD1与肿瘤浸润CD8+ T细胞呈负相关,主要发生在GC中(图1a)。癌症基因组图谱数据库分析发现,胃癌中LSD1的mRNA与CD8和CD3的mRNA表达呈负相关(图1b)。因此,LSD1被认为是通过抑制T细胞反应来维持肿瘤的生长。在人GC细胞系BGC-823和MGC803以及MFC细胞系中建立LSD1 KO细胞系(补充图未展示)。分别将MFC和MFC LSD1 KO细胞皮下接种于615只小鼠和T细胞缺陷BALB/c裸鼠。在BALB/c裸鼠中,MFC LSD1 KO组的肿瘤重量和体积与MFC组相当,而在615只小鼠中,MFC LSD KO组的肿瘤几乎完全根除(图1c,d),而它们的体重保持一致(补充图未展示)。这些结果表明,LSD1可能通过抑制T细胞反应来维持肿瘤的生长。此外,将人GC细胞与抗CD3/CD28珠激活的T细胞共孵育,无论LSD1是否被敲除,BGC-823和MGC-803细胞在体外都能稳定生长(图1e),而当LSD1缺失时,这两种癌细胞更容易被激活的T细胞杀死(图1f)。通过分析图1c中615只小鼠的剥脱肿瘤,LSD1的缺失导致CD8+ T细胞浸润增加(图1g)。综上所述,LSD1是GC中T细胞应答的抑制因子,LSD1的缺失可能通过促进T细胞在体内外杀伤能力而显著抑制GC细胞的生长。
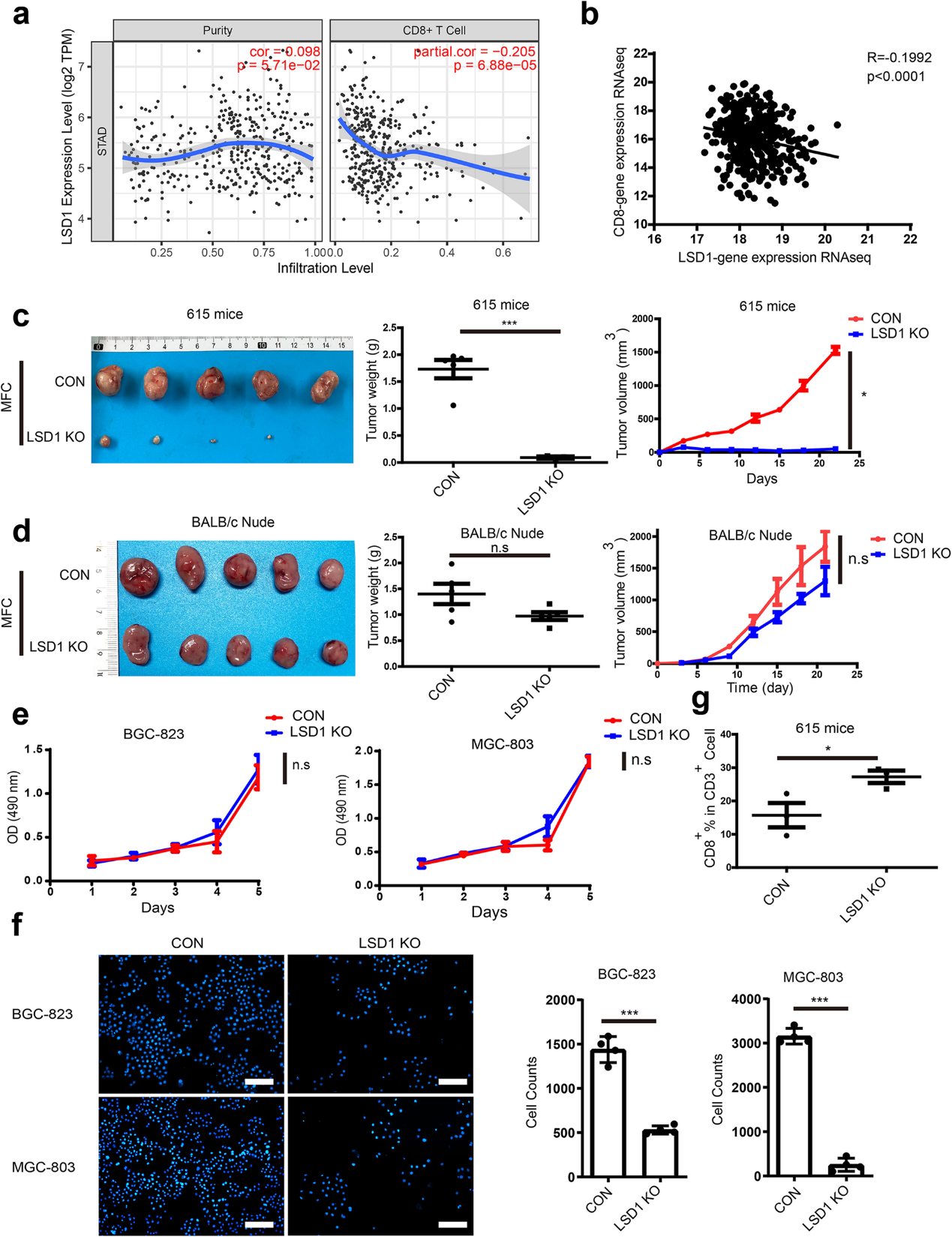
图1:LSD1 KO可通过促进胃癌中T细胞的应答抑制肿瘤生长
(2) GC标本中LSD1与CD8呈负相关,与PD-L1呈正相关
为了探讨LSD1如何影响肿瘤浸润的CD8+ T细胞水平,我们在用我们内部GC标本构建的组织微阵列(TMA)阻滞剂上进行免疫组化,分析LSD1、CD8和T细胞吸引趋化因子、C-X-C基序趋化因子9 (CXCL9)和C-X-C基序趋化因子10 (CXCL10)的表达。图2a,b表明,LSD1在GC组织中过表达,与CD8呈负相关(图2c),而CXCL9和CXCL10在GC组织中几乎不表达(补充图未展示)。由于抑制LSD1刺激抗肿瘤免疫,增强PD-1/PD-L1阻滞剂在乳腺癌和黑色素瘤中的抗肿瘤疗效,而PD-L1是免疫治疗的有效靶点,可通过结合PD-1抑制T细胞激活,我们推测LSD1可能主要通过抑制PD-L1激活和增殖T细胞而参与胃癌的发展。为探讨胃癌中LSD1与T细胞辅抑制因子PD-L1的相关性,收集36例胃癌标本进行进一步分析。图2d表明,肿瘤组织中LSD1和PD-L1的表达高于癌旁组织,且PD-L1与LSD1呈正相关(图2e)。在TCGA数据库中,PD-L1的表达也与GC中LSD1 mRNA的表达呈正相关(图2f)。这些结果初步支持了我们的假设,LSD1和PD-L1之间可能存在调节关系。
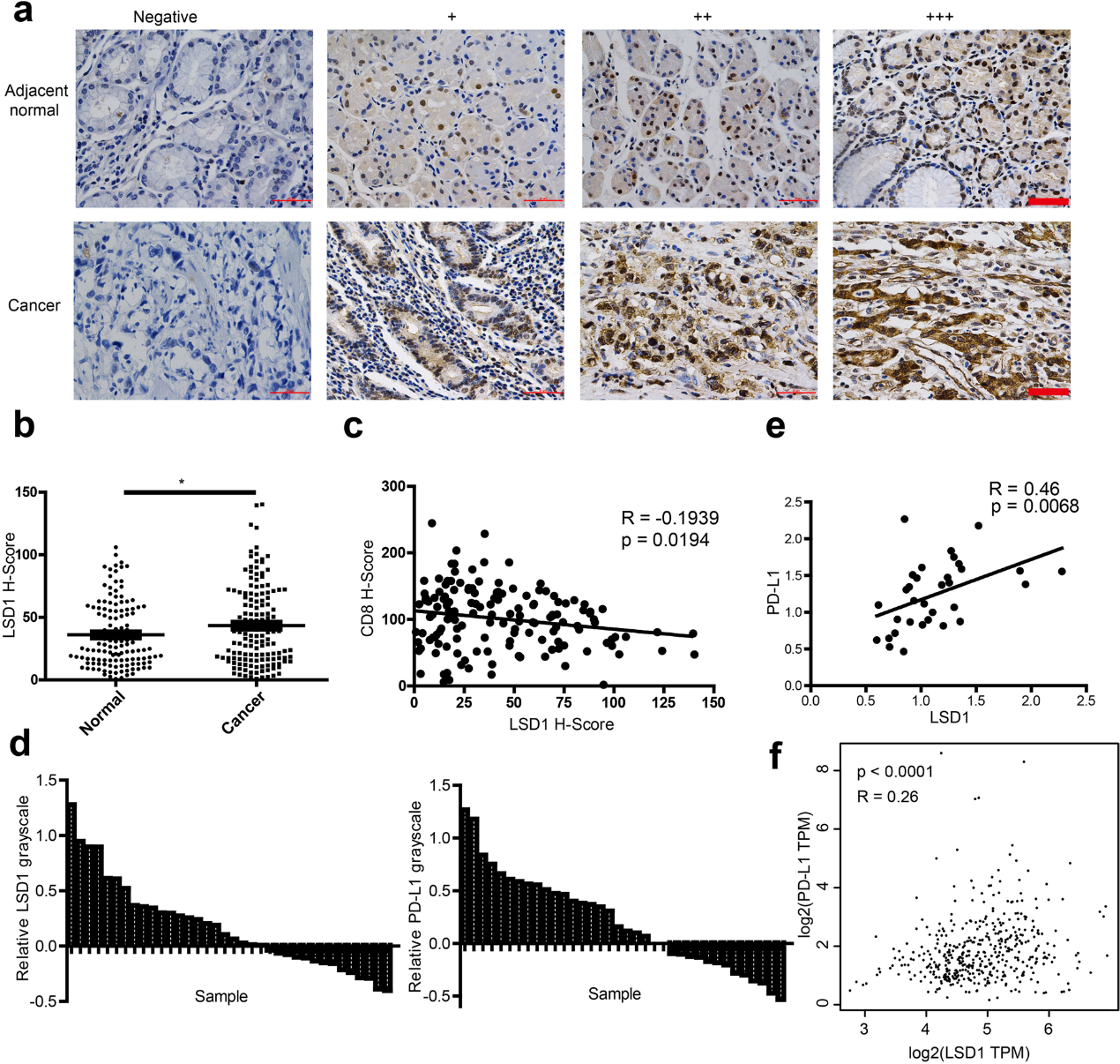
图2:胃癌标本中LSD1表达与免疫调节基因呈正相关
(3) 抑制LSD1可下调GC中PD-L1的水平
为了进一步探讨LSD1对GC中PD-L1的调控作用,我们对GC细胞中总PD-L1和膜PD-L1进行了量化。如图3a,b所示,不同GC细胞系中总PD-L1和膜PD-L1表达明显不均。为了研究LSD1对PD-L1的调节作用,通过使用LSD1抑制剂GSK2879552(图3c,d)或使用sgRNA基因抑制LSD1(图3e,f)。当LSD1被废去后,PD-L1的表达在mRNA水平和蛋白水平上均被下调。膜PD-L1的表达水平没有显著变化(补充图未展示)。已有研究报道PD-L1可通过蛋白酶体和溶酶体途径降解,但LSD1抑制剂是否影响PD-L1的降解途径尚不清楚。采用蛋白质合成抑制剂环己酰亚胺(CHX)和溶酶体抑制剂氯喹(CQ)处理GC细胞。LSD1的缺失并没有减少蛋白酶体和溶酶体对PD-L1的降解(补充图未展示)。为了探究LSD1在内体转运中的作用,我们检测了恢复内体标志蛋白RAB11和多泡小体标志蛋白TSG101。LSD1缺失可增加RAB11的表达,PD-L1与RAB11和TSG101在细胞质中共定位(补充图未展示)。SEM结果还显示,敲除LSD1后,多泡体数量减少(图3g,h),删除LSD1后,TSG101表达减少(图3i)。以上结果表明,LSD1的缺失可以降低PD-L1的总表达量,维持细胞膜PD-L1水平,减少细胞外通过多泡体分泌PD-L1,促进PD-L1在GC细胞中向膜循环。

图3:抑制LSD1可下调GC中PD-L1基因水平
(4) LSD1缺失下调GC中外泌体PD-L1
已有研究报道外泌体PD-L1也可发挥免疫抑制功能。PD-L1通过外泌体作为载体分泌,可能受LSD1调控。从GC细胞中分离出的外泌体,进行扫描电镜和NTA分析。GC细胞衍生的外泌体的大小在30到200 nm之间(图4a,b)。使用蔗糖梯度离心纯化的外泌体进行的进一步分析表明,外泌体标记CD63、ALG-2相互作用蛋白X (ALIX)和CD9在20-40%的蔗糖馏分中移动,PD-L1与这些外泌体标记共定位(图4c)。PD-L1被打包到GC细胞的外泌体中,PD-L1积累在来自几个人GC细胞系的外泌体中(图4d)。为了进一步证实外泌体中的PD-L1来自癌细胞而非其他成分,采用外泌体分泌抑制剂GW4869抑制胞外囊泡的分泌,当从相同数量的细胞中纯化外泌体时,外泌体分泌明显减少,当BGC-823细胞暴露于GW4869时,观察到膜PD-L1和总PD-L1(补充图未展示)的显著积累。在被抑制的BGC-823和MGC-803细胞中,当LSD1在基因上(图4e)和药理学上(图4f)被删除时,外泌体PD-L1被降低,表明LSD1在正向调节外泌体PD-L1的积累方面具有潜在作用。使用基于磁珠的方法从LSD1缺失的BGC-823和MGC-803细胞中收集的外泌体也比野生型细胞的外泌体含有更少的PD-L1(图4g,h)。当LSD1缺失时,GC细胞来源的外泌体浓度降低(图4i)。因此,我们认为LSD1 KO可以维持细胞膜PD-L1的同时减少外泌体的分泌,抑制外泌体分泌有可能挽救这种作用。用GW4869处理BGC-823细胞,对膜PD-L1进行定量。去除LSD1可以减少PD-L1总量(图3d,f),但保持膜PD-L1(补充图未展示)。使用GW4869抑制外泌体分泌可以诱导BGC823细胞中膜PD-L1的积累,GW4869还可以在LSD1缺失的BGC-823细胞中重新诱导膜PD-L1的积累(图4j)。综上所述,PD-L1存在于GC细胞衍生的外泌体中,LSD1的去除减少了细胞总PD-L1的量,但保持了膜PD-L1,并减少了外泌体PD-L1的分泌和积累。
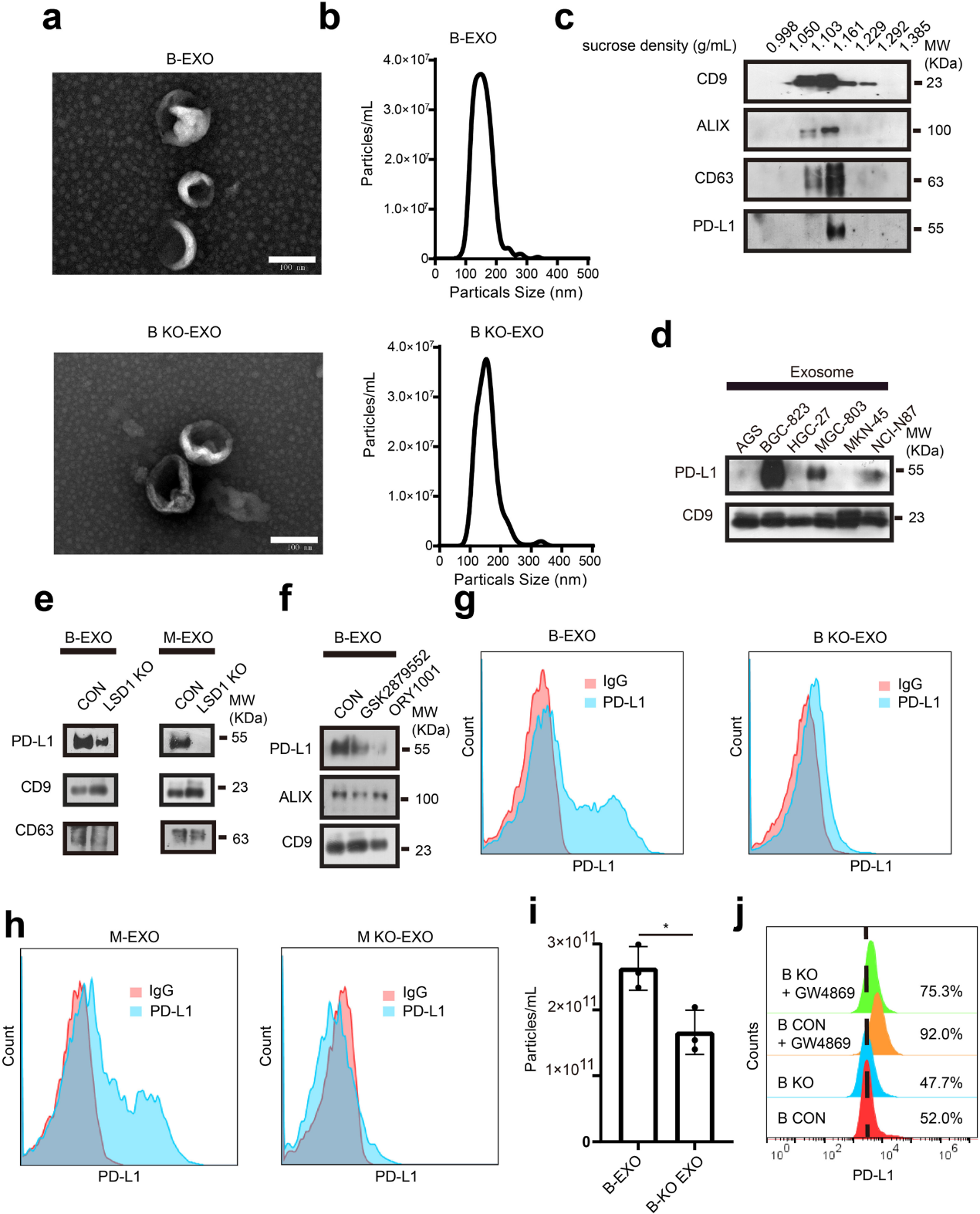
图4:LSD1缺失下调GC中外泌体PDL1
(5) LSD1的缺失逆转了GC衍生的外泌体PD-L1的直接T细胞应答抑制
为保证外泌体PD-L1功能的保留,采用PD-1/PD-L1结合试验检测外泌体PD-L1与PD-1的结合能力。标记有PKH26的GC细胞外泌体与重组PD-1涂层的孔结合,当BGC-823细胞中LSD1被删除时,这种结合可以显著取消(图5a)。用GC细胞源性外泌体孵育的T细胞的SEM图像也验证了GC细胞源性外泌体可以直接与T细胞结合,而LSD1 KO消除了这种相互作用(图5b)。为了确定LSD1是否可以通过TCR途径调节外泌体PD-L1介导的免疫抑制作用,采用抗CD3/CD28珠激活健康人体供体PBMCs,并与B-EXO共孵育,用于T细胞刺激模型,并测定T细胞的激活和增殖。以CD8+ T细胞的激活标记CD69为代表,抗CD3/CD28珠大大提高了CD69的表达,B-EXO处理后CD8+ T细胞中CD69表达明显下调,而B KO-EXO或用PD-L1抗体或PD-1重组体阻断外泌体PD-L1的作用挽救了CD8+ T细胞中被抑制的CD69表达(图5c)。T细胞增殖在B-EXO存在时下降,而在LSD1缺失时没有,说明GC细胞源性外泌体的免疫抑制功能被LSD1 KO去除(图5d),这与外泌体中PD-L1的表达水平一致。为了进一步证实外泌体可以调节T细胞的GC细胞杀伤能力,将激活的PBMCs与GC细胞共培养,并在存在或不存在LSD1的情况下,用BGC-823细胞来源的外泌体处理。外泌体可以减少T细胞杀伤以保持GC细胞存活,而B KO-EXO由于PD-L1的表达极少,对T细胞杀伤没有影响(图5e,f)。T细胞激活过程中分泌的三种主要反应性细胞因子IL-2(图5g)、IFN-γ(图5h)和TNFα(图5i)的分泌也可以被B-EXO抑制,并被B KO-EXO挽救。这些结果一致表明,GC细胞衍生的外泌体可以直接抑制TCR介导的T细胞激活,依赖于LSD1调节的外泌体PD-L1。
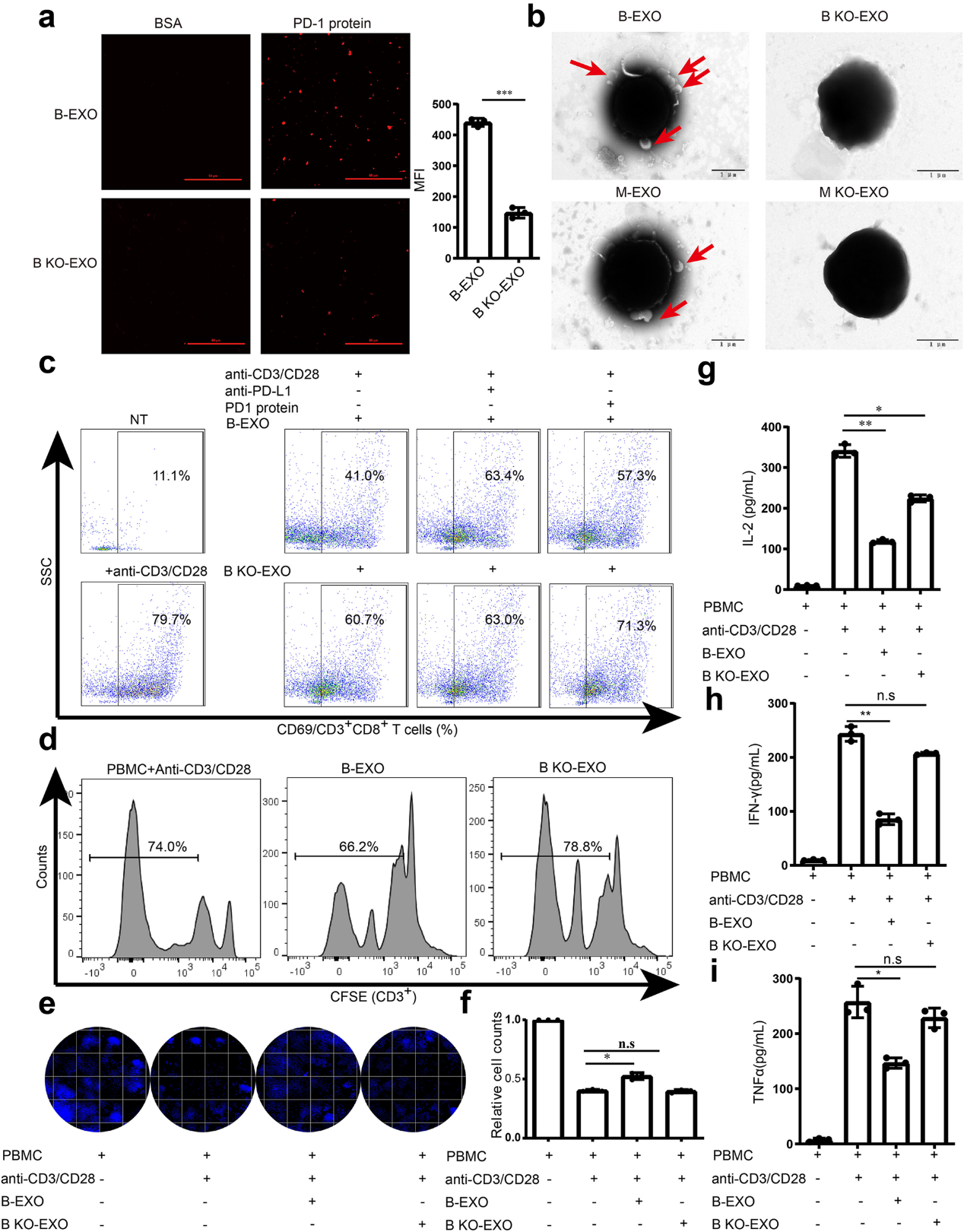
图5:LSD1的缺失逆转了GC衍生的外泌体PD-L1的直接T细胞应答抑制
(6) LSD1的缺失通过影响靶细胞中PD-L1的表达,逆转了GC细胞来源的外泌体在T细胞应答中的抑制作用
为了探索GC来源的外泌体向其他癌细胞的转运功能,我们用荧光PD-L1抗体对B-EXO和B KO-EXO进行染色,并与GC细胞系MGC-803孵育。外泌体PD-L1被转运到目标GC细胞中(图6a)。B-EXO可以诱导靶细胞中膜PD-L1的积累,而B-KO-EXO处理的BGC-823细胞中没有显著的PD-L1积累(图6b);在总PD-L1上也看到了类似的作用(图6c,d)。当B-EXO处理后,PD-1与细胞表面的结合显著增加,而PD-1在B KO-EXO处理的细胞上的结合则保持不变(图6e,f)。活化的T细胞与B-EXO处理的BGC823细胞共孵育时,CD3+CD8+ T细胞中CD69的表达降低,而B KO-EXO处理的细胞组中CD69的表达没有降低(图6g)。辅助T细胞杀伤分析的表型分析也表明,B-EXO处理的GC细胞有逃避T细胞杀伤的意图,而B KO-EXO对癌细胞对T细胞杀伤的敏感性没有显著影响(图6h)。这些结果表明,外泌体中的PD-L1可以运输到其他癌细胞中,从而诱导肿瘤细胞从T细胞的免疫逃逸,而LSD1的缺失降低了GC细胞来源的外泌体的免疫抑制功能,这说明LSD1是一种潜在的肿瘤免疫治疗的免疫抑制因子。
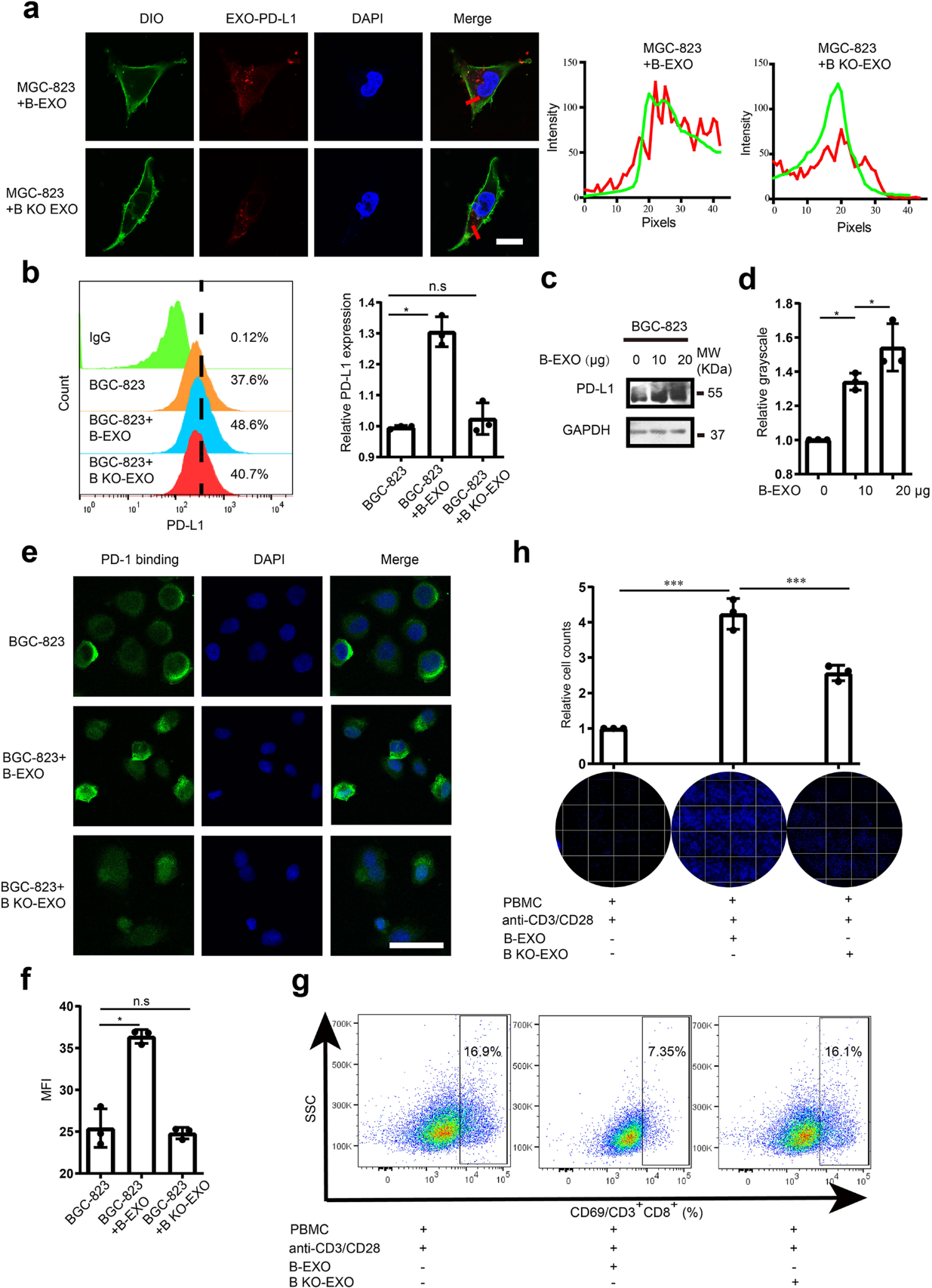
图6:LSD1的缺失通过影响靶细胞中PDL1的表达,逆转了GC细胞来源的外泌体在T细胞应答中的抑制作用
(7) LSD1缺失GC细胞的外泌体在体内通过外泌体PD-L1促进T细胞介导的肿瘤免疫
鉴于GC细胞衍生的外泌体在体外抑制T细胞的激活,我们进行了一个验证性的体内实验。LSD1抑制剂GSK2879552可下调MFC细胞中PD-L1的表达,LSD1缺失可降低外泌体PD-L1的表达,LSD1抑制剂GSK2879552和ORY1001也一样(补充图未展示)。我们使用了615只携带MFC细胞的小鼠建立胃癌模型,以探索胃癌细胞来源的外泌体是否可以调节体内肿瘤的进展。LSD1 KO显著抑制了615只小鼠的肿瘤生长。肿瘤的老鼠注射液从MFC细胞明显大于那些未经治疗的肿瘤(MFC组),而注射MFC LSD1 KO细胞外泌体的小鼠(MFC+KO EXO组)肿瘤比这两组小得多(图7a-c)。当MFC和MFC LSD1的外泌体与PD-1孵育以阻塞PD-L1外泌体(MFC+CON EXO+PD-1组和MFC+KO EXO+PD-1组)时,MFC+CON EXO+PD-1组、MFC+KO EXO+PD-1组和MFC+KO EXO组之间的肿瘤体积和肿瘤重量无显著差异(图7a-c)。我们推测外泌体治疗在一定程度上抑制了肿瘤中CD8+ T细胞的浸润。与MFC组相比,MFC+CON EXO组CD8+ T细胞比例明显增加,而LSD1 KO细胞衍生的外泌体促进了CD8+ T细胞的比例(图7d)。当PD-1重组蛋白阻断外泌体PD-L1时,MFC+CON EXO+PD-1组CD8+ T细胞比例高于MFC+CON EXO组(图7d)。MFC+KO EXO组与MFC+KO EXO+PD-1组间CD8+ T细胞比例无明显差异(图7d)。肿瘤浸润性CD3和CD8在这些肿瘤中的表达(图7e,f)以及细胞因子IL-2和IFN-γ的数量(图7g,h)的结果一致。携带MFC LSD1 KO细胞的小鼠血浆中外泌体PD-L1的表达量远低于携带MFC细胞的小鼠血浆中表达量(图7i),提示LSD1具有通过外泌体PD-L1调节全身免疫反应的潜力。总之,LSD1的缺失可以抑制同质GC模型中MFC细胞的增殖。同时,外泌体依靠供体细胞中LSD1的存在,可调节MFC细胞增殖,其作用依赖于体内外泌体PD-L1介导的T细胞免疫。
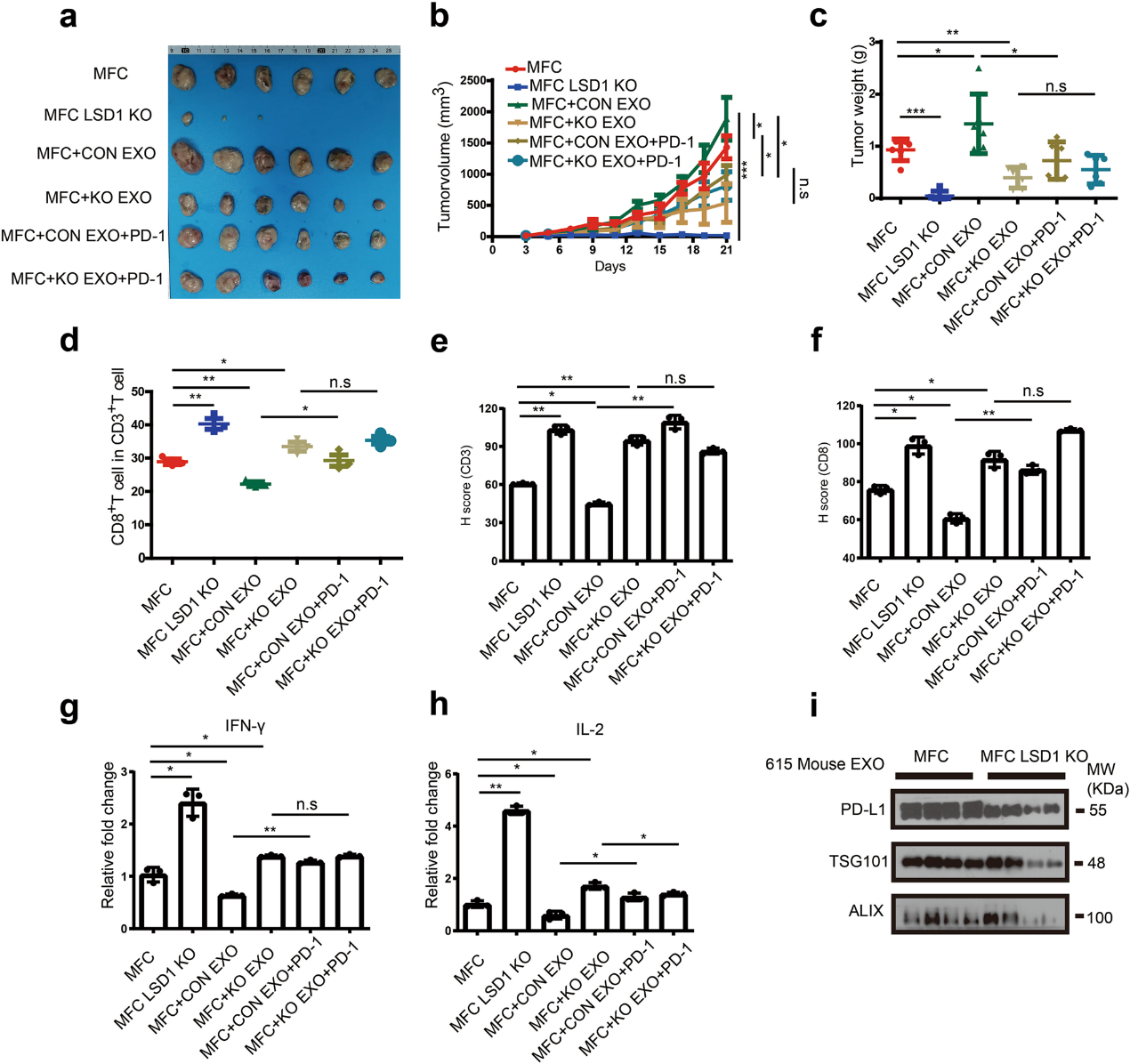
图7:来自LSD1被废的GC细胞的外泌体在体内通过外泌体PD-L1促进T细胞介导的肿瘤免疫
结论:
综上所述,LSD1的缺失通过减少外泌体中PD-L1的积累来增强T细胞活性,从而抑制肿瘤生长,而在GC细胞中,膜PD-L1保持不变。不仅如此,LSD1以外泌体为载体,通过外泌体PD-L1阻碍了其他癌细胞的T细胞反应,而LSD1的缺失则恢复了T细胞的功能。这些结果揭示了LSD1通过外泌体PD-L1调节T细胞免疫的新途径,为以LSD1为靶点的GC免疫治疗提供了新的策略。
参考文献:
Shen, D. D., Pang, J. R., Bi, Y. P., Zhao, L. F., Li, Y. R., Zhao, L. J., Gao, Y., Wang, B., Wang, N., Wei, L., Guo, H., Liu, H. M., & Zheng, Y. C. (2022). LSD1 deletion decreases exosomal PD-L1 and restores T-cell response in gastric cancer. Molecular cancer, 21(1), 75. https://doi.org/10.1186/s12943-022-01557-1.






